



Home | Patienten | Gesundheitssystem | International | GKV | Prävention | Epidemiologie | Websites | Meilensteine | Impressum
Sämtliche Rubriken in
"Patienten"
Arzneimittel-Information |
Verhaltenssteuerung (Arzt, Patient), Zuzahlungen, Praxisgebühr |
Alle Artikel aus:
Patienten
Arzneimittel-Information
Mehr Transparenz über verordnete und gekaufte Medikamente für PatientInnen und ÄrztInnen durch Medikationsplan!? Ja, aber….
 Seit vielen Jahren weisen ExpertInnen auf die möglichen unerwünschten gesundheitlichen Folgen der gleichzeitigen Verordnung und Einnahme von Arzneimitteln durch verschiedene, über die Parallelverordnungen uninformierten Ärzte und die nicht geringe Anzahl von nicht rezeptpflichtigen von den PatientInnen in der Apotheke gekauften so genannten "Over-the-counter (OTC)"-Arzneimittel hin. Die für Ärzte aber auch PatientInnen herrschende Intransparenz erklärt einen Teil der Wechselwirkungen, der Wirkungsblockaden oder auch der Noncompliance mit deren oft auch ebenfalls erheblichen Folgen für PatientInnen und Ärzte. So dürfte hinter der in Deutschland immer noch überdurchschnittlich großen Anzahl von Patient-Arzt-Kontakten zum Teil gesundheitliche Beschwerden stecken, die durch diese Verordnungswirklichkeit verursacht wurden. Über diese die gebotene Transparenz herzustellen gehörte daher viele Jahre in jeden gesundheits- oder versorgungspolitischen Themenkatalog.
Seit vielen Jahren weisen ExpertInnen auf die möglichen unerwünschten gesundheitlichen Folgen der gleichzeitigen Verordnung und Einnahme von Arzneimitteln durch verschiedene, über die Parallelverordnungen uninformierten Ärzte und die nicht geringe Anzahl von nicht rezeptpflichtigen von den PatientInnen in der Apotheke gekauften so genannten "Over-the-counter (OTC)"-Arzneimittel hin. Die für Ärzte aber auch PatientInnen herrschende Intransparenz erklärt einen Teil der Wechselwirkungen, der Wirkungsblockaden oder auch der Noncompliance mit deren oft auch ebenfalls erheblichen Folgen für PatientInnen und Ärzte. So dürfte hinter der in Deutschland immer noch überdurchschnittlich großen Anzahl von Patient-Arzt-Kontakten zum Teil gesundheitliche Beschwerden stecken, die durch diese Verordnungswirklichkeit verursacht wurden. Über diese die gebotene Transparenz herzustellen gehörte daher viele Jahre in jeden gesundheits- oder versorgungspolitischen Themenkatalog.
Seit dem 1. Oktober 2016 gibt es nun für GKV-Versicherte, wenn sie mindestens 3 oder mehr unterschiedliche ärztlich verordnete, Arzneimittel einnehmen oder anwenden nach § 31a SGB V den gesetzlichen Anspruch auf einen bundeseinheitlichen schriftlichen und evtl. künftig auch elektronischen Medikationsplan. Die Ausstellung und Pflege des Medikationsplans erhalten die ausstellenden Ärzte auch extrabudgetär vergütet.
Ob und wie der Medikationsplan im ersten Jahr seiner Existenz funktioniert, wollte die Handeskrankenkasse (hkk) in Bremen genauer wissen und befragte schriftlich 1.000 ihrer Versicherten, die zumindestens in einem Quartal, dem letzten Quartal 2016, nach den Routinedaten über die Arzneimittelverordnungen die Kriterien für die Ausstellung eines Plans erfüllt hatten. 324 Versicherte, ein angesichts der qualitativen Zusammensetzung der ArzneimittelkonsumentInnen guter Anteil, antworteten.
Die Ergebnisse waren überwiegend ernüchternd und zeigen ein weiteres Mal, dass selbst gut gemeinte und von allen Akteuren seit Jahren geforderte Instrumente und Interventionen ohne zusätzliche Unterstützung bei der Implementation nicht oder nur sehr schleppend funktionieren.
Die wichtigsten Ergebnisse lauten
• Nur 37,7 % der Versicherten, die den Anspruch und Bedarf für einen Medikationsplan gehabt hätten, haben ihn auch erhalten.
• Ein Viertel der Befragten mit Medikationsplan hat eine ausreichende Erklärung zum Sinn des Planes entweder gar nicht oder nur mit Einschränkungen erhalten.
• Mit knapp 21 % der Befragten sprachen die den Medikationsplan ausstellenden Ärzte nicht über den Nutzen und die Einnahme der verordneten Medikamente.
• 51,6 % aller Befragten mit Medikationsplan wurden nicht gefragt, ob sie sich zusätzlich rezeptfreie Arzneimittel in der Apotheke gekauft haben.
• 43 % aller Befragten mit Medikationsplan wurden nicht darauf hingewiesen, den Plan auch beim Besuch anderer Ärzte mitzunehmen und ggfls. ergänzen zu lassen.
• 32,5 % der Befragten, die auch von anderen Ärzten als dem Ersteller des Medikationsplans Medikamente verordnet bekamen, wurden von diesen nicht nach dem Medikationsplan gefragt.
• Sofern der Medikationsplan bei diesen Arztkontakten überhaupt eine Rolle spielte, wurde er ohne genauere Erklärung bei 14,3 % dieser Befragten nicht ergänzt.
Der Verfasser der Studie, der Bremer Gesundheitswissenschaftler Dr. Bernard Braun (Bremer Institut für Arbeitsschutz und Gesundheitsforschung - BIAG und SOCIUM der Universität Bremen) stellt zu den konzeptionellen Mängeln und Umsetzungsschwächen schließlich noch folgendes fest:
• Angesichts einer Reihe von Unterschieden zwischen den offiziell im SGB V und in der dreiseitigen Vereinbarung zwischen Kassenärztlicher Bundesvereinigung der Bundesärztekammer Arbeitsgemeinschaft der Deutschen Ärztekammern und dem Deutschen Apothekerverband festgelegten Kriterien für die Erstellung eines Medikationsplans und den in Darstellungen z.B. der Kassenärztlichen Bundesvereinigung (KBV) genannten Kriterien, sollte untersucht werden welche Kriterien bei den Ärzten "angekommen" sind und für Entscheidungen über die Erstellung eines Medikationsplans genutzt werden und möglicherweise die Erstellung von Medikationsplänen verhindern. In einem Pretest des Fragebogens erwähnten dort Befragte Ärzte, die offensichtlich weder ihren Nutzen noch den des Patienten kannten oder kommunizierten. Einige Ärzte hattren aber auch bereits vor der gesetzlichen Regelund handgestrickte Übersichten erstellt und ausgehändigt.
• Obwohl z.B. in der dreiseitigen Vereinbarung zum Teil bis auf den Millimeter genau die Höhe und Breite von Zeilen oder die Größe von Zeichen geregelt wird, existieren dort wo es um Inhalte des Medikationsplan geht häufig nur vage und Willkür fördernde Bemerkungen wie "in der Regel" oder "sofern möglich", die einen breiten Gestaltungsspielraum ermöglichen, der sich mehr oder weniger negativ auf den für Patienten erfahrbaren Nutzen einer möglichst vollständigen Übersicht über ihre rezeptpflichtige und rezeptfreie medikamentöse Behandlung auswirken kann. Unklar oder zu schwammig bleibt außerdem ob und wie sich Ärzte durch Nachfragen bei Patienten denen sie selber ein oder mehrere Arzneimittel verordnen, darüber informieren müssen, ob derselbe Patient nicht bereits von anderen Ärzten Arzneimittel unter der 3-Arzneimittelgrenze erhalten hat und damit zusammen diese Grenze überschritten wird. Eine Reihe dieser Bestimmungen sollte daher präzisiert und verpflichtend gemacht werden.
• Abgesehen davon, ob wirklich ab dem 1. Januar 2019 die technischen und datenschutzrechtlichen Voraussetzungen geschaffen oder gesichert sind, um zusätzlich zum schriftlichen einen elektronischen Medikationsplan auf der elektronischen Gesundheitskarte (eGK) zu dokumentieren, sollte generell geklärt werden, ob damit nicht für große Teile der PatientInnen die schon mit der schriftlichen Form nicht einfach zu gewinnende Übersicht über ihren Arzneimittelkonsum massiv be- oder gar mangels einfacher Lesbarkeit der eGK sogar verhindert wird.
• Aber selbst für den schriftlichen Medikationsplan gilt nach Kenntnis der akribisch auf 97 Seiten einer Anlage zur bereits erwähnten Vereinbarung festgehaltenen Vorschriften zu den zu dokumentierenden Daten und zur Formatierung der Plandaten sowie des Aussehens des Plans, dass lesbare und wirksame Dokumente für "normale" NutzerInnen anders aussehen sollten. Die oft geäußerte Kritik am Layout der Qualitätsberichte von Krankenhäusern und die dort gemachten Verbesserungsvorschläge, sind bei der Konzipierung des Medikationsplans völlig ignoriert worden.
In jedem Fall sollten sich alle Beteiligten überlegen was sie tun können die gesetzlichen Vorgaben umzusetzen. Regelmäßige Kontrollen sind dabei sicherlich hilfreich.
Der hkk-Report Medikationsplan 2017 umfasst 18 Seiten und ist komplett kostenlos abrufbar.
Bernard Braun, 26.10.17
Wie gelingt es ohne Nachteile für Patient und Arzt bei den meisten Atemwegserkrankungen Antibiotika zu verhindern?
 Darüber, dass die Verordnung und Einnahme von Antibiotika bei den meisten Infektionen der oberen Atemwege und des Mittelohrs, da durch Viren verursacht, keine heilende oder nur eine symptomatische Wirkung hat, dafür aber massiv die Entstehung von immer mehr resistenten Keimen fördert und daher eine Gesundheitsgefahr darstellt, besteht seit Jahren ein weltweiter Konsens. Trotz einiger Fortschritte zögern aber immer noch viele Ärzte "für alle Fälle" oder weil es bei Kindern "die besorgten Eltern so wollen" auf Antibiotika zu verzichten oder mit einer "watchful waiting"-Behandlung zu reagieren und allenfalls etwas gegen Schmerzen zu verordnen oder zu empfehlen.
Darüber, dass die Verordnung und Einnahme von Antibiotika bei den meisten Infektionen der oberen Atemwege und des Mittelohrs, da durch Viren verursacht, keine heilende oder nur eine symptomatische Wirkung hat, dafür aber massiv die Entstehung von immer mehr resistenten Keimen fördert und daher eine Gesundheitsgefahr darstellt, besteht seit Jahren ein weltweiter Konsens. Trotz einiger Fortschritte zögern aber immer noch viele Ärzte "für alle Fälle" oder weil es bei Kindern "die besorgten Eltern so wollen" auf Antibiotika zu verzichten oder mit einer "watchful waiting"-Behandlung zu reagieren und allenfalls etwas gegen Schmerzen zu verordnen oder zu empfehlen.
Um diese Ärzte doch noch für eine zurückhaltende Behandlungsweise zu gewinnen, entwickelte sich in einigen Ländern ein völlig neuer Verordnungstypus. Der Arzt kann weiterhin für Patienten mit einer der genannten Krankheiten ein Antibiotikum verordnen, empfiehlt dann aber den Patienten das Rezept erst nach einem oder zwei Tagen oder erst dann einzulösen, wenn bis zu diesem Zeitpunkt die Erkrankungssymptome nicht verschwunden sind bzw. sich nicht erheblich verbessert haben.
Da aber auch diese Strategie von Befürchtungen über erhöhte Komplikationsraten oder eine größere Unzufriedenheit der Patienten und damit deren möglicher Verlust als Praxisnutzer begleitet wurde und wird, bereitet eine Cochrane Reviewergruppe seit 2007 Studien auf, die Vergleiche zwischen drei verschiedenen Verordnungsstrategien (sofortige Verordnung und Einlösung, Verordnung mit dem Hinbweis mit der Einlösung noch etwas zu warten und gar keine Verordnung von Antibiotika) und ihren verschiedenen Wirkungen angestellt haben.
Der neueste, dazu am 7. September 2017 veröffentlichte Cochrane Review bilanziert die über mehrere Jahre gewonnenen und evidenten Erkenntnisse folgendermaßen:
• Symptome wie Schmerzen oder Fieber werden bei Empfängern von sofort verordneten und eingenommenen Antibiotika gegenüber Empfängern eines erst verzögert einzulösenden Rezepts etwas mehr gebessert.
• Zwischen den drei Verordnungsweisen gab es keinen Unterschied bei den Komplikationsraten.
• Die Zufriedenheit der Patientengruppen unterscheidet sich nicht signifikant.
• Vergleicht man Patienten mit verzögertem Rezept mit Patienten, die überhaupt keine Verordnung bekamen, war die Zufriedenheit der ersten Gruppe sogar etwas höher (87%) als die der zweiten (82%).
• Der Anteil von Patienten, die während einer Halsentzündung oder einer Mittelohrentzündung Antibiotika eingenommen haben, ist bei einer sofortigen Verordnung erheblich höher (93%) als bei den Patienten, die ihr Rezept bei Bedarf erst nach ein paar Tagen einlösen sollten (31%).
• Bei Patienten, die zunächst gar kein Antibiotikarezept erhalten, beträgt der Anteil, der dann doch noch Antibiotika verordnet bekommt und einnimmt nur noch 14%.
Die meisten Befürchtungen für Patient wie Arzt gegenüber der Ausstellung von erst verzögert einzulösenden Rezepten erweisen sich also nahezu vollständig als unberechtigt.
Von dem 2017er Cochrane Review Delayed antibiotic prescriptions for respiratory infections von Spurling GKP, Del Mar CB, Dooley L, Foxlee R und Farley R. (Cochrane Database of Systematic Reviews 2017, Issue 9) gibt es kostenlos ein umfangreiches Abstract.
Mit welch relativ einfachen Mitteln erwachsene Patienten aber auch Eltern von erkrankten Kindern überzeugt werden können, daran mitzuwirken, den Gebrauch von Antibiotika bei Erkrankungen der oberen Atemwege möglichst gering zu halten, zeigte bereits ein 2016 veröffentlichter anderer Cochrane Review über zum Teil methodisch hochwertige Studien in den USA und Großbritannien. Danach führte die Verteilung einer zweiseitigen schriftlichen Information über die Vor- und Nachteile der Verordnung von Antibiotika zu einer signifikanten Verringerung der Menge von eingenommenen Antibiotika ohne dass es zu einem signifikanten Anstieg der Patient-Arzt-Kontakte oder zu Unterschieden der Zufriedenheit von Eltern mit der Behandlung kam.
Wegen der geringen Zahl der an diesen Studien teilnehmenden Kindern und ihren Eltern und einer Reihe nicht erhobener Aspekte der Behandlung (z.B. Patientenwissen) plädieren die Reviewer für eine Fortsetzung derartiger Untersuchungen.
Auch von dem Review Written information for patients (or parents of child patients) to reduce the use of antibiotics for acute upper respiratory tract infections in primary care von O'Sullivan JW, Harvey RT, Glasziou PP und McCullough A. (Cochrane Database of Systematic Reviews 2016, Issue 11) gibt es kostenlos ein längeres Abstract.
Bernard Braun, 28.9.17
...fragen sie ihren...Apotheker, aber was wenn der selber Antworten sucht und nicht findet?
 Ein nicht unbeträchtlicher Anteil aller Medikationsmittel werden nicht von Ärzten verordnet, sondern direkt von PatientInnen oder um ihre Gesunderhaltung besorgten Gesunden in Apotheken erworben und komplett privat bezahlt. Die meisten dieser Mittel werden von ihren Herstellern als kurativ wie präventiv hilfreich beworben.Eine ganze Reihe dieser so genannten "Over-The-Counter (OTC)"-Arzneimittel sind auch nachgewiesenermaßen hochwirksame Mittel, die zum Teil auch mit anderen Arzneimitteln und dann auch noch zum Nachteil des sie einnehmenden Menschen interagieren können. Wenn es darum geht den Nutzen der OTC-Präparate oder auch das bei der Einnahme zu Beachtende zu bestätigen oder zu erfahren, sind ihre Käufer in hohem Maße von der fachlichen Beratung der ApothekerInnen abhängig. Dies umso mehr als dass rund die Hälfte der in Apotheken abgegebenen Packungen Präparate zur Selbstmedikation enthalten.
Ein nicht unbeträchtlicher Anteil aller Medikationsmittel werden nicht von Ärzten verordnet, sondern direkt von PatientInnen oder um ihre Gesunderhaltung besorgten Gesunden in Apotheken erworben und komplett privat bezahlt. Die meisten dieser Mittel werden von ihren Herstellern als kurativ wie präventiv hilfreich beworben.Eine ganze Reihe dieser so genannten "Over-The-Counter (OTC)"-Arzneimittel sind auch nachgewiesenermaßen hochwirksame Mittel, die zum Teil auch mit anderen Arzneimitteln und dann auch noch zum Nachteil des sie einnehmenden Menschen interagieren können. Wenn es darum geht den Nutzen der OTC-Präparate oder auch das bei der Einnahme zu Beachtende zu bestätigen oder zu erfahren, sind ihre Käufer in hohem Maße von der fachlichen Beratung der ApothekerInnen abhängig. Dies umso mehr als dass rund die Hälfte der in Apotheken abgegebenen Packungen Präparate zur Selbstmedikation enthalten.
Dazu benötigen sie aber bei der Vielzahl alter und neuer Präparate selber wissenschaftlich gesicherte oder evidente Informationen. Und um diese in knapper, verständlicher aber dennoch inhaltlich valider Form zugänglich zu machen, startete eine der populären pharmazeutischen Fachzeitschriften, die "Pharmazeutische Zeitung (PZ)" im Jahr 2015 eine Serie "Evidenzbasierte Selbstmedikation".
Das Mitglied der Chefredaktion, Professor Dr. Manfred Schubert-Zsilavecz, begründete dieses Angebot folgendermaßen, was wegen der weiteren Ereignisse ausführlich zitiert werden soll: "Kommt ein Kunde in die Apotheke, dann entscheidet er zusammen mit dem Apotheker über die nächsten Schritte. Behandlung unnötig? Selbstmedikation? Arztbesuch? Die Apotheker sind hier als Berater in der Schlüsselrolle. Das setzt eine hohe heilberufliche Kompetenz voraus. Aber nicht nur bei der Beantwortung dieser wichtigen Frage, auch bei der Auswahl des am besten für einen bestimmten Patienten geeigneten OTC-Arzneimittels ist die Kompetenz des Apothekers gefragt. Rationale OTC-Arzneimittel sind wahrlich keine Arzneimittel »zweiter Klasse«, vielmehr gelten auch für sie die Prinzipien Wirksamkeit, Unbedenklichkeit und pharmazeutische Qualität als Grundlage einer jeden Zulassung. Darüber hinaus gilt es im Kontext evidenzbasierter Pharmazie das für die jeweilige Erkrankung am besten geeignete OTC-Arzneimittel auszuwählen. Entscheidende Kriterien müssen dabei an erster Stelle die Ergebnisse klinischer Studien sein. Aber auch die individuellen therapeutischen Erfahrungen des beratenden Apothekers und die Wünsche des Patienten sollten in die Entscheidung eingebracht werden. In den letzten zehn Jahren hat es einen nicht unerheblichen Zuwachs an molekular-pharmakologischen Erkenntnissen und neuen Studiendaten für OTC-Arzneimittel gegeben, weshalb es sich lohnt, Umfang und Qualität der klinischen Evidenz der am häufigsten eingesetzten OTC-Arzneimittel zu kennen und die daraus zu ziehenden Schlüsse in den Beratungsgesprächen zu berücksichtigen."
Worüber die LeserInnen dann durch fundierte und mit Verweisen auf hochwertige Studienliteratur versehene Beiträge von PharmazeutInnen informiert wurden und welche Hinweise auf wissenschaftlich fundierte Hinweise zur Abgabe oder Nichtabgabe an nachfragende Personen sie erhielten, soll an zwei Beispielen aufgezeigt werden:
• Zu Vitamin C-präparaten gegen oder bei Erkältungen heißt es im PZ-Heft 48 2015: "Fazit: Auf der Datenbasis des Cochrane-Reviews senkt die prophylaktische Einnahme von Vitamin C das Risiko für eine Erkältung in der Allgemeinbevölkerung nicht. Eine Ausnahme sind Menschen, die akut starker körperlicher Belastung oder großer Kälte ausgesetzt sind. Dauer und Schweregrad (Zustand von Arbeitsunfähigkeit) verkürzen sich bei regelmäßiger Supplementierung für Erwachsene nur um einige Stunden. Bei therapeutischer Einnahme nach Beginn der Erkältungssymptome ist kein eindeutiger Effekt auf Dauer oder Schweregrad nachweisbar. Unklar ist bisher, ob für die therapeutische Anwendung höhere Dosierungen unter Umständen stärkere Therapieeffekte erzielen - für eine allgemeine Empfehlung sind derzeit aber bessere Belege aus qualitativ hochwertigen Studien nötig."
• Und zum Pelargonium-Extrakt, als "traditionelles Arzneimittel" angepriesen heißt es in der PZ-Ausgabe 8/2016 knapp: "Nutzen wahrscheinlich, aber nur für Tropfen".
Mindestens noch acht vergleichbare Artikel waren geplant, von denen aber letztlich ohne öffentliche Begründung nur vier erschienen.
Woran dies lag, erfuhr der Vorstand des "Verbandes der Pharmazeutinnen und Pharmazeuten (VdPP)" auf eine Anfrage bei der PZ in seltener Klar- und Offenheit. Der Chefredakteur Daniel Rücker nannte in seinem Antwortschreiben (zitiert nach der Veröffentlichung auf der Website doccheck vom 25. April 2017 zwei Gründe:
• "Zeitschriften wie die PZ sind nach unseren Erfahrungen mit der Serie wegen eines nicht auflösbaren Interessenkonflikts ungeeignet, OTC-Arzneimittel zu bewerten. OTC-Anzeigen sind eine wesentliche Einnahmequelle der PZ. (…) Es gibt schon einzelne OTC-Hersteller, die schnell dabei sind, mit der Stornierung von Anzeigen zu drohen." Und weiter: ""Es gab durchaus Gegenwind von pharmazeutischen Unternehmen. Manche wünschen sich, dass ihre Präparate positiver dargestellt werden, als es die Datenlage hergibt. Doch es war nicht so, dass wir die Serie hätten einstellen müssen. Wir haben nach sechs Folgen aufgehört."
• "Wir hatten erwartet, dass die Serie eine größere Aufmerksamkeit unter Apothekern erzeugt und es sie sehr stark interessiert, welche OTC-Arzneimittel tatsächlich erwiesen wirksam sind und welche nicht. Das war nicht der Fall."
Im Übrigen: Die PZ erscheint in der Avoxa Mediengruppe, die eine hundertprozentige Tochtergesellschaft des Spitzenverbandes der deutschen Apothekerschaft: der ABDA - Bundesvereinigung Deutscher Apothekerverbände e. V., ist also keine beliebige Publikation, sondern ein Standesorgan. Die Standesvertretung der ApothekerInnen soll aber nach Angaben des VdPP bisher auf das Bekanntwerden der Gründe "gelassen" reagiert haben.
So müssen ApotherInnen weiterhin auf alltagstaugliche (natürlich könnten sie auch selber stunden- oder tagelang nach Cochrane Reviews etc. suchen und sie zu lesen anfangen, würden dann aber genauso lang in der Apotheke fehlen) valide Antworten zum Nutzen wichtiger OTC-Präparate in ihrer verbandseigenen Fachzeitschrift warten bzw. verzichten und PatientInnen oder KundInnen bekommen entweder keine oder ausschließlich herstellergetränkte Antworten.
Bernard Braun, 27.4.17
Viel hilft viel - auch bei rezeptfreien Arzneimitteln nicht zu empfehlen, wie viel nicht schadet, kann aber reichlich unklar sein.
 Wer es nicht schon immer gewusst hat, dass rezeptfreie Arzneimittel nicht nur gegen Beschwerden wirksam sein können, sondern auch gravierende, ja lebensgefährliche Nebenwirkungen haben können, erfährt dies für ein häufig genutztes Mittel gegen Durchfall heute durch eine Warnmeldung der Arzneimittelkommission der Deutschen Apotheker (AMK). Sie hat darauf hingewiesen, dass eine Überdosierung des Wirkstoffs Loperamid zu schwerwiegenden Nebenwirkungen am Herzen führen kann.
Wer es nicht schon immer gewusst hat, dass rezeptfreie Arzneimittel nicht nur gegen Beschwerden wirksam sein können, sondern auch gravierende, ja lebensgefährliche Nebenwirkungen haben können, erfährt dies für ein häufig genutztes Mittel gegen Durchfall heute durch eine Warnmeldung der Arzneimittelkommission der Deutschen Apotheker (AMK). Sie hat darauf hingewiesen, dass eine Überdosierung des Wirkstoffs Loperamid zu schwerwiegenden Nebenwirkungen am Herzen führen kann.
Wie verbreitet der Wirkstoff seit langem ist, zeigt der folgende Auszug aus der Herstellerinformation eines loperamidhaltigen Markenmedikaments: "Loperamid ist in Deutschland schon seit 1976 unter IMODIUM® erhältlich und als IMODIUM® akut die Nummer 1 in der Selbstmedikation von akutem Durchfall."
Während auf derselben Website nur noch von vielen positiven Eigenschaften berichtet wird (Stand: 10. Juni 2016), äußert sich der AMK-Vorsitzende Martin Schulz unmissverständlich so: "Rezeptfrei heißt nicht harmlos: Wenn Loperamid missbräuchlich oder aus Versehen überdosiert wird, kann das lebensgefährlich sein".
Wie schwierig es aber auch bei solchen Medikamenten für PatientInnen ist, sich verlässliche Informationen zu verschaffen und sich vor Schäden zu bewahren, zeigt das Informationsgeschehen dieser Woche mehrfach.
• Erstens folgt die Meldung der AMK einer bereits am 7. Juni 2016 von der US-amerikanischen "Food and Drug Administration (FDA)" verbreiteten Meldung (FDA Drug Safety Communication: FDA warns about serious heart problems with high doses of the antidiarrheal medicine loperamide (Imodium), including from abuse and misuse). Dort wird zu der Menge des Wirkstoffs, die zu den gefährlichen Nebenwirkungen führen kann, folgendes gesagt: "The maximum approved daily dose for adults is 8 mg per day for OTC use and 16 mg per day for prescription use." Ergänzt wird diese Information noch durch deutliche Hinweise, Arzneimittel mit diesem Wirkstoff nicht länger als 2 Tage einzunehmen.
• Zweitens verbreitet eine Presseinformation der ABDA die Warnung der AMK am 10. Juni 2016 um 9.16 Uhr mit dem ausdrücklichen Hinweis, "die empfohlene Höchstdosis für Loperamid liegt für Erwachsene bei 16 Milligramm pro Tag". Da die "meisten Präparate ... 2 Milligramm pro Kapsel (enthalten)", "darf die Tageshöchstdosis von 8 Kapseln...nicht überschritten werden".
• Drittens meldet schließlich eine weitere ABDA-Presseinformation um 11.57 Uhr desselben Tages, dass in der ersten Meldung ein "Fehler unterlaufen" sei und die Tageshöchstdosis 12 Milligramm betrüge, was 6 Kapseln entspräche. Dies empfiehlt im Übrigen auch der Hersteller von Imodium selber auf seiner Website und wahrscheinlich auch schon längere Zeit im Beipackzettel.
Am Ende der informationsträchtigen Woche stellt sich also die Frage, ab welcher Menge des Wirkstoffs es denn jetzt für Erwachsene gefährlich werden kann: 8 mg oder 16 mg der FDA (diese Empfehlung gibt es offensichtlich auch schon länger, ohne dass selbst bei Lektüre der gesamten Information klar wird, warum 16 mg auf Rezept und mit verordnendem Arzt (?) keine gefährlichen Nebenwirkungen haben) oder doch lieber die fehlerfreien 12 mg der AMK bzw. des Herstellers? Und was, wenn die einzelne Kapsel oder Tablette mehr oder weniger als 2 mg Loperamid enthält - was man hoffentlich weiß und findet?
Und wenn sich offensichtlich im Moment verschiedene Experten nicht auf eine einfache mg-Höchstdosis einigen können, wirkt der zusätzliche Hinweis der AMK, "dass auch durch Wechselwirkungen mit anderen Arzneimitteln das Risiko für Nebenwirkungen von Loperamid steigt" und Personen, die z.B. Imodium einnehmen, "sollten in der Apotheke nach möglichen Wechselwirkungen fragen" nicht wirklich hilfreich. Es darf geraten werden: Auf wie viel Milligramm Loperamid muss man verzichten, um das genannte Risiko wieder zu senken und auf welches Niveau?
Klar ist also bei Reisedurchfall: so wenig wie möglich auch wenn trotz aller Informationsfülle nicht klar ist, was wenig ist und dies nicht länger als 48 Stunden ohne Arzt. Was zu tun ist, wenn kein gut informierter Arzt oder Apotheker in Reichweite des mit der Rache des Montezuma oder den Wirkungen sonstiger sommerlicher Salmonellenzuchtbasen (z.B. Tiramisu oder Kartoffelsalat mit Mayonnaise und Ei) kämpfenden Reiseapotheken-Urlaubers ist, bleibt hier mal offen.
Die Größe des Risikos unerwünschter gesundheitlicher Wirkungen im Falle des Überschreitens einer der Höchstdosen sieht in den USA laut FDA so aus: Von 1976 bis 2015 wurden der FDA 48 Berichte über schwere, mit der Anwendung von Loperamid-assozierte Herzprobleme gemeldet. In 10 Fällen verstarben die Patienten. Der Anteil der geschädigten PatientInnen, die versehentlich eine zu hohe Dosis eingenommen hatten war sogar kleiner, da die FDA vermutet, dass Loperamid in einigen Fällen absichtlich in hohen Dosen konsumiert wurde, um Sucht-Entzugssymptome zu lindern oder Euphoriegefühle auszulösen.
Bernard Braun, 11.6.16
Neue Krebsmedikamente 5: Niedrige Zulassungshürden behindern Fortschritte in der Forschung
 In den Jahren 2002 bis 2014 hat die amerikanische Arzneimittelzulassungsbehörde 71 Krebsmedikamente zur Behandlung fortgeschrittener Krebserkrankungen ("metastatic and/or advanced and/or refractory solid tumors") neu zugelassen. In ihrer Analyse dieser 71 Medikamente berechnen die Autoren einer amerikanischen Studie den Gewinn an Lebenszeit über alle Medikamente hinweg mit 2,1 Monaten (Median).
In den Jahren 2002 bis 2014 hat die amerikanische Arzneimittelzulassungsbehörde 71 Krebsmedikamente zur Behandlung fortgeschrittener Krebserkrankungen ("metastatic and/or advanced and/or refractory solid tumors") neu zugelassen. In ihrer Analyse dieser 71 Medikamente berechnen die Autoren einer amerikanischen Studie den Gewinn an Lebenszeit über alle Medikamente hinweg mit 2,1 Monaten (Median).
Mit 19,7 Monaten Verlängerung der Überlebenszeit ist die Substanz Cetuximab bei einer bestimmten Form eines Kopf- und Halstumors (Plattenepithelkarzinom) in Verbindung mit Bestrahlung am effektivsten. Mit weitem Abstand folgt als zweiteffektivste Substanz Oxaliplatin als Ersttherapie bei metastasiertem Dickdarmkrebs, das einen Gewinn an Lebenszeit von 5,6 Monaten verspricht. Zugelassen wurden auch 2 Medikamente, die die Lebenszeit verkürzen. Pemetrexed lässt Patienten mit einem nicht-kleinzelligen Bronchialkarzinom in der Erstbehandlung 0,3 Monate kürzer leben, Pazopanib verkürzt das Leben von Patienten mit fortgeschrittenem Nierenzellkarzinom gar um 0,6 Monate.
23 der 71 Medikamente wurden zugelassen, obwohl keine Informationen über die Auswirkungen auf die Lebenszeit vorlagen.
Der Median für das Surrogatkriterium progressionsfreies Überleben beträgt 2,5 Monate. Ein deutlicher Zusammenhang zwischen diesem Surrogatkriterium und dem patienterelevanten Kriterium Überlebenszeit erschließt sich zumindest auf den ersten Blick nicht.
Im Jahr 2014 hat das Cancer Research Committee der American Society of Clinical Oncology Kriterien für klinisch sinnvolle Behandlungsergebnisse ("Clinically Meaningful Outcomes) für 4 Krebsarten (Lungenkrebs, Darmkrebs, Brustkrebs und Bauchspeicheldrüsenkrebs) definiert und veröffentlicht. Mit einem Gewinn an Lebenszeit von mindestens 2,5 bis 4 Monaten je nach Tumorart sind die Kriterien eher niedrig angesetzt. Gemessen an diesen Kriterien fallen nur 30 der 71 (42%) Medikamente in die Kategorie "klinisch sinnvoll".
Die Autoren argumentieren, dass die niedrige Hürde für die Zulassung von Krebsmedikamenten zur Folge hat, dass viele Medikamente zur Zulassung gebracht werden, die keine oder keine nennenswerte Verbesserung bedeuten. Die Industrie habe zur Kenntnis genommen, dass Arzneimittel mit nur geringem oder nicht nachgewiesenem Patientennutzen zugelassen werden und für Therapiekosten von zumeist mehr als 10.000 Dollar pro Monat vermarktbar sind. Damit werde der pharmazeutischen Industrie ein starker Anreiz gesetzt, ähnliche Substanzen - sog. Me-too-Medikamente - zu entwickeln anstatt nach neuen und effektiveren Substanzen zu suchen. Ersteres erfordert einen vergleichsweise geringen, letzteres hingegen einen höheren Forschungsaufwand.
Diesen Sachverhalt unterstreicht ein Bericht des Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG). Bis zum 31.5.2015 hat das Institut im Rahmen des Arzneimittelmarkt-Neuordnungsgesetzes 29 Bewertungen für onkologische Erkrankungen auf Grundlage von 28 Dossiers erstellt. Alle Dossiers bezogen sich auf fortgeschrittene Krebserkrankungen und kein einziges auf ein Frühstadium.
Fojo T, Mailankody S, Lo A: Unintended consequences of expensive cancer therapeutics—the pursuit of marginal indications and a me-too mentality that stifles innovation and creativity: The John Conley Lecture. JAMA Otolaryngology-Head & Neck Surgery 2014, 140:1225-123 Volltext
Ellis LM, Bernstein DS, Voest EE, Berlin JD, Sargent D, Cortazar P, Garrett-Mayer E, Herbst RS, Lilenbaum RC, Sima C et al: American Society of Clinical Oncology Perspective: Raising the Bar for Clinical Trials by Defining Clinically Meaningful Outcomes. Journal of Clinical Oncology 2014, 32(12):1277-1280 Volltext
Lange S: Besonderheiten von Onkologischen Studien im Rahmen der frühen Nutzenbewertung von Arzneimitteln. ZEFQ 2015, 109(6):417-430 Volltext
Neue Krebsmedikamente 1: Nutzen für Patienten fraglich, Preise exorbitant Link
Neue Krebsmedikamente 2: Leichtfertige Zulassung in den USA Link
Neue Krebsmedikamente 3: "Durchbruch" in der Therapie weckt falsche Hoffnungen Link
Neue Krebsmedikamente 4: Wunder, Revolutionen und Durchbrüche - Superlative in der amerikanischen Presse häufig Link
Neue Krebsmedikamente 5: Niedrige Zulassungshürden behindern Fortschritte in der Forschung Link
David Klemperer, 17.11.15
Neue Krebsmedikamente 4: Wunder, Revolutionen und Durchbrüche - Superlative in der amerikanischen Presse häufig
 Journalistische Beiträge in der Laienpresse dürften für Patienten, die Öffentlichkeit und auch für Investoren eine wichtige Informationsquelle darstellen mit größerer Reichweite als Fachzeitschriften-Beiträge. Die Art der Darstellung dürfte wesentlich dazu beitragen, wie eine Therapieform in der Öffentlichkeit bewertet wird.
Journalistische Beiträge in der Laienpresse dürften für Patienten, die Öffentlichkeit und auch für Investoren eine wichtige Informationsquelle darstellen mit größerer Reichweite als Fachzeitschriften-Beiträge. Die Art der Darstellung dürfte wesentlich dazu beitragen, wie eine Therapieform in der Öffentlichkeit bewertet wird.
Eine amerikanische Studie ging der Frage nach, wie häufig neue Krebstherapien mit Superlativen beschrieben wurden. Die Autoren durchsuchten dafür Google news für den kurzen Zeitraum vom 21. bis 25. Juni 2015 mit dem Suchbegriff "cancer drug" in Verbindung mit den folgenden superlativen Begriffen: breakthrough, game changer, miracle, cure, home run, revolutionary, transformative, life saver, groundbreaking, marvel.
Sie fanden 94 Nachrichten aus 66 unterschiedlichen Nachrichtenquellen mit 97 Superlativen bezogen auf 36 bestimmte und 3 unbenannte Medikamente.
Unter den Therapieformen wurde die gezielte Therapie in 17 der 36 Artikel am häufigsten aufgegriffen, die zytotoxische Therapie bzw. Chemotherapie in 9 Artikeln, Checkpoint Inhibitoren in 5 Artikeln. 3 Artikel mit Superlativen bezogen sich auf Krebsimpfungen bzw. therapeutische Vakzine, einer auf Bestrahlungstherapie und einer auf Gentherapie.
Von den 97 Superlativen bezogen sich 39 auf eine gezielte Therapie, 37 auf einen Checkpoint-Inhibitor, 10 auf ein zytotoxisches Medikament, 5 auf eine Krebsimpfung, 3 nannten keine Therapieform, 2 auf eine Strahlentherapie, eine auf eine Gentherapie.
Von den 36 Substanzen hatten 18 bis Mitte Juli 2015 noch keine Zulassung von der Food and Drug Administration erhalten. Allein auf Grundlage von Tierversuchen, Zellkulturen oder präklinischer Forschung, also ohne Erkenntnisse aus Versuchen an Menschen, wurde 5 Substanzen mit einem Superlativ bedacht.
Die Superlative wurden 53 Journalisten, 26 Ärzten, 9 Industrievertretern, 8 Patienten und einem Kongressabgeordneten zugeschrieben. In der Mehrheit der Fälle wurde der Superlativ nicht vom Autor kommentiert.
Superlative wurden genauso häufig für zugelassene wie für nicht zugelassene Substanzen und für alle Arten von Krebstherapie gebraucht. Superlative erhielten auch Substanzen, wie z.B. Palbociclib und auch Krebsimpfungen, für die bisher keine Daten für einen Patientennutzen aus klinischen Studien vorliegt. Insgesamt wurden 5 Substanzen mit einem Superlativ vorgestellt, für die noch keinerlei Daten aus Studien an Menschen vorlagen.
Krebsmedikamente werden somit in der amerikanischen Öffentlichkeit häufig auf eine Weise dargestellt, dass die Leserinnen und Leser gefährdet sind, den Nutzen weit zu überschätzen, Risiken zu unterschätzen und falsche Hoffnungen zu entwickeln.
Dass eine entsprechende Studie in Deutschland ähnliche Ergebnisse erbringen könnte, zeigen die Ergebnisse bei Google News für die Eingabe der Begriffe "Krebstherapie" und "Durchbruch": zwischen dem 14.10. und 14.11.2015 finden sich 5 unkritische Berichte und 1 Bericht über die hier vorgestellte Studie. "Krebstherapie" und "Innovation" ergibt für denselben Zeitraum 14 Treffer.
Abola MV, Prasad V: THe use of superlatives in cancer research. JAMA Oncology 2015:1-2 Abstract
Serie Neue Krebsmedikamente
Neue Krebsmedikamente 1: Nutzen für Patienten fraglich, Preise exorbitant Link
Neue Krebsmedikamente 2: Leichtfertige Zulassung in den USA Link
Neue Krebsmedikamente 3: "Durchbruch" in der Therapie weckt falsche Hoffnungen Link
Neue Krebsmedikamente 4: Wunder, Revolutionen und Durchbrüche - Superlative in der amerikanischen Presse häufig Link
Neue Krebsmedikamente 5: Niedrige Zulassungshürden behindern Fortschritte in der Forschung Link
David Klemperer, 14.11.15
4 Jahre nach Beendigung Ergebnisse von 30% der klinischen Studien in USA nicht veröffentlicht - industriefinanzierte allen voran
 Ergebnisse von wissenschaftlichen Studien spielen eine immer gewichtigere und letztlich entscheidende Rolle in der institutionalisierten Zulassung von gesundheitsbezogenen Diagnostika und Therapeutika sowie in öffentlichen Debatten. Wie einige jüngeren Kontroversen gezeigt haben (z.B. die um das Influenza-Präparat Tamiflu der Firma Roche), spielen dabei die Veröffentlichung der Ergebnisse aller Studien, d.h. positiver wie negativer und der freie Zugang zu deren Daten eine oftmals entscheidende Bedeutung, wenn es um die Bewertung ihres Nutzens oder Schadens geht.
Ergebnisse von wissenschaftlichen Studien spielen eine immer gewichtigere und letztlich entscheidende Rolle in der institutionalisierten Zulassung von gesundheitsbezogenen Diagnostika und Therapeutika sowie in öffentlichen Debatten. Wie einige jüngeren Kontroversen gezeigt haben (z.B. die um das Influenza-Präparat Tamiflu der Firma Roche), spielen dabei die Veröffentlichung der Ergebnisse aller Studien, d.h. positiver wie negativer und der freie Zugang zu deren Daten eine oftmals entscheidende Bedeutung, wenn es um die Bewertung ihres Nutzens oder Schadens geht.
Nachdem zum einen seit einiger Zeit gewährleistet ist, dass Studienprotokolle und der zeitliche Ablauf solcher Studien in öffentlich zugänglichen Datenbanken erfasst werden und zum anderen mehrere Male kritisch über die selektive Veröffentlichung von Ergebnissen berichtet wurde, war anzunehmen, dass es damit Schluss sei.
Dass dies ein quantitativ relevanter Irrtum ist und daran auch die alten "Täter" maßgeblich mitwirken, zeigt eine am 15. Juli 2014 veröffentlichte Auswertung der us-amerikanischen Studiendatenbank ClinicalTrials.gov (CTG) bzw. der Veröffentlichungen auf ihrer Website durch ForscherInnen der Boston University School of Public Health (BUSPH).
In diese Auswertung gingen 400 zufällig ausgewählte klinische Studien ein, die im Jahr 2008 laut ihres eigenen Studienprotokolls beendet wurden.
Die wichtigsten Ergebnisse lauten so:
• 4 Jahre nach Beendigung gab es bei 118, d.h. 29,5% dieser Studien keinerlei Veröffentlichung von Ergebnissen in einer Fachzeitschrift oder auf der CTG-Website.
• Die Ergebnisse der restlichen 282 Studien wurden im Durchschnitt erst nach 602 Tagen veröffentlicht.
• Studienergebnisse wurden dann, wenn es sich um solche in früheren Studienphasen (2 versus 3 / 4), nur mit erwachsenen Personen, solche mit Randomisierung oder kleinem Umfang handelte, signifikant weniger veröffentlicht.
• Schließlich wurden die Ergebnisse der von der Industrie finanzierten Studien signifikant weniger veröffentlicht als die ohne Industriesponsoren.
Die Bostoner WissenschaftlerInnen sehen einen auch aktuell beträchtlichen "reporting bias", dessen Niveau und Entwicklung ihres Erachtens "threatens the validity of the clinical research literature in the U.S.". Hinzu kommt das ethische Problem, dass die TeilnehmerInnen an solchen Studien oft aus einer altristischen Grundhaltung heraus teilnehmen und daher auch die völlige Transparenz über jedes Resultat erwarten.
Der Aufsatz How Frequently Do the Results from Completed US Clinical Trials Enter the Public Domain? - A Statistical Analysis of the ClinicalTrials.gov Database. von Hiroki Saito und Christopher J. Gill ist in der Fachzeitschrift "PLoS ONE" (2014; 9 (7): e101826) erschienen und komplett kostenlos zugänglich.
Bernard Braun, 21.7.14
"Nur lesen. Fotografieren und Kopieren verboten" oder wie sich die "European Medicines Agency (EMA)" Transparenz vorstellt
 Auch wenn es lange Zeit gedauert hat und es bei jeder passenden Gelegenheit Verweigerung oder Tricksereien der Arzneimittelhersteller gibt: Um jedem und vor allem auch den gesetzlich damit beauftragten wissenschaftlichen Instituten die Möglichkeit zu geben, den Nutzen und den Schaden durch Arzneimittel überprüfen zu können, muss es vollständige Transparenz über die dazu u.a. von der Pharmaindustrie selbst durchgeführten Untersuchungen geben. Dass zur Transparenz auch die Möglichkeit gehört, die kompletten Texte zu kopieren und mit den darin enthaltenen Daten zusätzliche Berechnungen anzustellen, schien eigentlich zu den Grundregeln geistiger Arbeit oder zur selbstverpflichtenden Transparenzkultur der Hersteller zu gehören.
Auch wenn es lange Zeit gedauert hat und es bei jeder passenden Gelegenheit Verweigerung oder Tricksereien der Arzneimittelhersteller gibt: Um jedem und vor allem auch den gesetzlich damit beauftragten wissenschaftlichen Instituten die Möglichkeit zu geben, den Nutzen und den Schaden durch Arzneimittel überprüfen zu können, muss es vollständige Transparenz über die dazu u.a. von der Pharmaindustrie selbst durchgeführten Untersuchungen geben. Dass zur Transparenz auch die Möglichkeit gehört, die kompletten Texte zu kopieren und mit den darin enthaltenen Daten zusätzliche Berechnungen anzustellen, schien eigentlich zu den Grundregeln geistiger Arbeit oder zur selbstverpflichtenden Transparenzkultur der Hersteller zu gehören.
Dass dies ein Irrtum ist, zeigt ein Blick auf die noch im Mai 2014 öffentlich vorgetragenen Vorstellungen der europäischen Zulassungsbehörde für Arzneimittel zur Nutzung der auf ihrer Website künftig veröffentlichten klinischen Arzneimittel-Bewertungsstudien. In einer am 27. Mai 20124 verbreiteten Pressemitteilung weist das "Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)" - selbst zeitweise an der Expertendiskussion über die Transparenz durch die EMA beteiligt - auf die Absicht der EMA hin, am 12. Juni 2014 folgendes zu beschließen: "Demnach dürfen Interessenten die klinischen Studiendaten lediglich am Bildschirm betrachten. Untersagt sind dagegen das Herunterladen, das Abspeichern, die Bearbeitung, das Abfotografieren, das Ausdrucken, die Verteilung und die Übertragung der Informationen."
Dies ist u.a. einer Präsentation des Chief Policy Adviser der EMA, Noël Wathion, zu entnehmen, der ausgerechnet unter der Überschrift "very user friendly system" u.a. die Akzeptanz der "terms of use" "'view -on-screen-only', not downloadable, not printable" verlangt.
Zusätzlich besteht aber nach derzeitigem Stand noch die Möglichkeit, dass wichtige Details der Studiendaten wie z.B. die Auswirkungen des Medikaments auf patientenrelevante Endpunkte wie die gesundheitliche Lebensqualität von den Herstellern rechtlich zulässig geschwärzt oder gelöscht werden können. So korrekt es ist, Daten, die Rückschlüsse auf einzelne Patienten zuließen, nicht zu veröffentlichen, so nachteilig ist für Patienten die gerade skizzierte Intransparenz.
Die EMA-Präsentation Finalisation of EMA policy on publication of and access to clinical trial data. Targeted consultation with key stakeholders vom Mai 2014 ist kostenlos erhältlich.
Die komplette Pressemitteilung des IQWiG Nur gucken, nicht anfassen: EMA-Nutzungsbedingungen für klinische Studiendaten impraktikabel ist ebenfalls kostenlos erhältlich.
Noch ausführlicher setzen sich mit den herstellerergebenen Vorstellungen der EMA und den damit verbundenen Nachteilen für die Versorgungsqualität drei IQWiG-VertreterInnen, Beate Wieseler, Natalie McGauran und Thomas Kaiser, in dem "rapid response"-Beitrag European drug agency backtracks on plan to give researchers access to clinical trial reports im Medizinjournal "British Medical Journal (BMJ)" vom 21. Mai 2014 (2014;348:g3432) auseinander.
Was bis zur endgültigen Entscheidung der EMA im Juni 2014 und auch danach gilt, ist, dass offensichtlich weder für die Hersteller noch für angeblich unabhängige öffentliche Zulassungs- und Kontrollinstitutionen uneingeschränkte und wirklich nutzerfreundliche Transparenz zu den Grundtugenden gehört auf die man sich verlassen kann.
Bernard Braun, 27.5.14
Finger weg von Makrolidantibiotika bei Herzkranken
 Antibiotika vom Typ der Makrolide erfreuen sich wegen Ihrer einfachen Anwendung und eher leichten unerwünschten Arzneimittelwirkungen insbesondere im ambulanten Bereich seit Jahren größter Beliebtheit bei der Behandlung von Atemwegs- und anderen Infektionen. Nach dem Arzneimittelverordnungs-Report 2012 gehören Makrolide in Deutschland mit 56,7 Mio. verordneten Tagesdosen zu dem am häufigsten verordneten Antibiotika (nach Amino-Penicillinen, Cephalosporinen und Tetrazyklinen (59,1 Mio.)). Die breite massenhafte Anwendung von Makrolidantibiotika nicht nur in Deutschland lässt auch seltene unerwünschte Wirkungen zu Tage treten, die vor allem für die Verordnungspraxis und therapeutische Verwendung von großer Bedeutung sind.
Antibiotika vom Typ der Makrolide erfreuen sich wegen Ihrer einfachen Anwendung und eher leichten unerwünschten Arzneimittelwirkungen insbesondere im ambulanten Bereich seit Jahren größter Beliebtheit bei der Behandlung von Atemwegs- und anderen Infektionen. Nach dem Arzneimittelverordnungs-Report 2012 gehören Makrolide in Deutschland mit 56,7 Mio. verordneten Tagesdosen zu dem am häufigsten verordneten Antibiotika (nach Amino-Penicillinen, Cephalosporinen und Tetrazyklinen (59,1 Mio.)). Die breite massenhafte Anwendung von Makrolidantibiotika nicht nur in Deutschland lässt auch seltene unerwünschte Wirkungen zu Tage treten, die vor allem für die Verordnungspraxis und therapeutische Verwendung von großer Bedeutung sind.
Lange Zeit galten Antibiotika und insbesondere Makrolide auch als Ansatz zur medizinischen Prävention oder sogar Behandlung der koronaren Herzkrankheit (KHK). Bereits Ende der 1980er Jahre war zunächst in Finnland aufgefallen, dass Patienten mit KHK häufiger als bei Vergleichspersonen einen positiven Titer von Antikörpern gegen Chlamydia pneumoniae aufwiesen. Mit ihrem Artikel Serological Evidence of an Association of a Novel Chlamydia, TWAR, with Chronic Coronary Heart Disease and Acute Myokardial Iinfarction, von dem kostenfrei nur das Abstract zur Verfügung steht, erweckte die Helsinkier Forschungsgruppe um Pekka Saikku Hoffnungen, die KHK nicht mehr nur symptomatisch, sondern auch antibiotisch und damit ursächlich behandeln zu können. Später gelang den finnischen Experten auch der Nachweis von Clamydien in atheromatösen Plaques - die 1993 in der Zeitschrift Circulation (87 (4), S: 1130-1134) veröffentlichte Studie von Eila Linnanmäki und Kollegen mit dem Titel Chlamydia pneumoniae-specific circulating immune complexes in patients with chronic coronary heart disease steht allen Interessierten als Volltext zur Verfügung. Da Makrolide gegen Chlamydien wirksam sind, folgten alsbald erste Untersuchungen zur Behandlung der Arteriosklerose mit Azithromycin oder Roxithromycin unter der sich anfangs abzeichnenden Erwartung, unter den behandelten Patienten die Häufigkeit koronarer Ereignisse senken zu können.
Allerdings waren die Fallzahlen waren eher klein, die Befunde waren insgesamt uneinheitlich und blieben folglich umstritten, wie aus einer Übersichtsarbeit der drei Epidemiologen John Danesh, Rory Collins und Richard Peto aus Oxford hervorgeht. Ihre Studie mit dem Titel Chronic infections and coronary heart disease: is there a link? erschien 1997 im Lancet, kostenfrei ist hier für Nicht-Abonenten wiederum nur das Abstract einsehbar. Ihre Zusammenfassung spricht für sich: "The available evidence about chronic infections and CHD is still sparse and its interpretation is limited by potential biases. For H(elicobacter) pylori , residual confounding by causal risk factors may account entirely for the rather weak epidemiological associations that have been reported. For C(hlamydia) pneumoniae, the evidence of association is stronger, but the temporal sequence of infection and CHD is uncertain." Eine deutschsprachige Zusammenfassung der damaligen Studienlage findet sich in dem mittlerweile frei zugänglichen Artikel Behandlung der Koronaren Herzerkrankung mit Antibiotika? aus dem Arzneimittelbrief Nr 31 von 1997 (AMB 1997, 31, 75b).
Einer Reihe größerer kontrollierter Studien zur Wirksamkeit von Makroliden bei KHK bestätigte in der Folgezeit zunehmend die Zweifel an der These einer wirksamen Behandlung von Durchblutungsstörungen des Herzens mit chlamydien-wirksamen Antibiotika. Eine Metaanalyse dieser Untersuchungen kam zu dem Ergebnis, dass Makrolide auf den Verlauf der Erkrankung keinen wesentlichen Einfluss nehmen. Das Journal of the American Medical Association stellt den Beitrag Effects of Antibiotic Therapy on Outcomes of Patients With Coronary Artery Disease: A Meta-analysis of Randomized Controlled Trialsder New Yorker Kardiologen Richard Andraws, Jeffrey Berger und David Brown kostenfrei als Volltext zum Download bereit.
Spätestens seit 2006 kam zusätzlich zu den Zweifeln an der Wirksamkeit einer antiobiotischen KHK-Behandlung der Verdacht auf, die Gabe von Makroliden an Patienten mit manifester Erkrankung der Herzkranzgefäße könnte sogar deren Sterblichkeit erhöhen. Verschiedene kürzlich erschienen epidemiologische Studien bestätigen nun die Hinweise aus kleineren Studien, dass antibiotische Behandlungen mit Makroliden, insbesondere mit Clarithromycin und Azithromycin, kardiovaskuläre Risikopatienten gefährlichen Komplikationen aussetzen.
Im Rahmen der Randomisierten, placebokontrollierten multizentrischen Studie zur Bewertung einer kurzfristigen Clarithromycin-Gabe bei Patienten mit stabiler koronarer Herzkrankheit berichtete eine Forschergruppe der Universität Kopenhagen über eine signifikant gesteigerte Letalität unter Makrolid-Behandlung. In einem doppeltblinden Ansatz und hatten sie randomisiert insgesamt 4.373 Patienten nach ihrer Entlassung aus stationärer Behandlung wegen akuten Myokardinfarkts oder Koronarsyndroms sowie nach Bypass-Operation zwei Wochen lang entweder mit Clarithromycin (2.172 Personen) oder Placebo (2.201 Patienten) behandelt. Im Anschluss verfolgten sie über drei Jahre personenbezogen den Krankheitsverlauf an Hand des dänischen Krankenhaus- und Sterberegisters. Endpunkte des CLARICOR trial waren Gesamtletalität, Myokardinfarkt oder instabile Angina pectoris sowie Letalität aufgrund von Durchblutungsstörungen des Herzens, Myokardinfarkt oder instabile Angina pectoris. Bei der Häufigkeit dieser beiden Endpunkte zeigten beide Gruppen keinen bedeutsamen Unterschied, aber die kardiovaskuläre Letalität war in der mit Clarithromycin behandelten Gruppe signifikant erhöht (5,1 % vs. 3,5 %; p = 0,01). Dieser Unterschied zeigte sich allerdings nicht kurzfristig, sondern erst ab dem zweiten Jahr. Auf der Homepage der angesehenen Medizinerzeitschrift British Medical Journal (BMJ) steht die CLARICOR-Studie von Christian Jespersen und Kollegen in voller Länge kostenfrei zum Download zur Verfügung.
Eine bereits im Mai 2012 publizierte Studie aus Nashville in Tennessee hatte ebenfalls einen Zusammenhang zwischen einer Azithromycin-Therapie und der anschließenden kardiovaskulären Sterblichkeit aufgezeigt. Die Auswertung von mehr als 3 Millionen Medicaid-Patienten hatte gezeigt, dass das Risiko, nach 5-tägiger Behandlung mit diesem Makrolid an einem kardiovaskulären Ereignis zu sterben, mit 85,1 Fällen pro 1 Million zwar insgesamt gering, aber dennoch signifikant höher als in der Kontrollgruppe (29,8 / 1 Million) und im Vergleich zu der mit einem Penicillin behandelten (31,5 / 1 Million). Auch dabei zeigte sich, dass eine Azithromycon-Behandlung vor allem bei Patienten mit vorbestehender KHK das Sterblichkeitsrisiko erhöhte. Die Studie der Nashviller Forscher um Wayne Ray stellt das New England Journal of Medicine allen Interessenten kostenfrei zum Download zur Verfügung: Azithromycin and the Risk of Cardiovascular Death
Im März 2013 publizierte nun das BMJ die Ergebnisse einer Untersuchung über das kardiovaskuläre Risiko einer kurzzeitigen Therapie mit Clarithromycin bei Patienten mit akuter Exazerbation einer chronisch-obstruktiven Lungenerkrankung und mit ambulant erworbener Lungenentzündung. Das britisch-australische Forscherteam wertete dafür die Daten zweier prospektiver multizentrischer Beobachtungsstudien mit insgesamt etwa 3.000 Teilnehmern aus, und zwar der Edinburgh-Pneumonie-Kohortenstudie und der EXODUS-Studie (Exacerbations of Obstructive Lung Disease managed in UK Secondary care). Dabei betrachteten Stuart Schembri und seinen Kollegen einen kombinierten Endpunkt aus Krankenhausaufnahme infolge akuten Koronarsyndroms, dekompensierter Herzinsuffizienz, bedrohlichen Rhythmusstörungen oder plötzlichem Herztod im ersten Jahr nach der Akuttherapie. Ein multivariater Vergleich der Patienten der Verum- mit denen der Kontrollgruppe, die ein anderes Antibiotika erhalten hatten, aber hinsichtlich Alter, Geschlecht, Anamnese, Schweregrad ihrer Erkrankung und Begleittherapie den Patienten entsprachen, die eine Makrolid-Therapie erhalten hatten, zeigten sich interessante Befunde.
Bei Patienten mit chronisch-obstruktiver Lungenerkrankung traten im Verlauf des ersten Jahres insgesamt 268 bedrohliche kardiovaskuläre Ereignisse auf, die unter Clarithromycin signifikant häufiger als in der Kontrollgruppe waren. Ebenso waren akute Koronarereignisse in der Verum-Gruppe häufiger und die kardial bedingte Sterblichkeit höher. Der kombinierte Endpunkt war zwar bei den durchschnittlich jüngeren und gesünderen Pneumonie-Patienten insgesamt seltener, aber auch zeigte sich bei den Clarithromycin-Behandelten eine erhöhte Inzidenz. Das galt nicht nur beim Koronarsyndrom und der kardialen Letalität, sondern eine Subgruppen-Analyse zeigte eine Korrelation zwischen Dauer und Schwere der Herzkrankheit und der Häufigkeit des Auftretens kardiovaskulärer Komplikationen. Zudem ergaben sich Hinweise, dass das Komplikationsrisiko mit der dem Alter der Patienten und der Dauer der Einnahme von Makroliden steigt.
Im Zuge seiner Open-Access-Politik stellt das BMJ den vollständigen Bericht über die Studie Cardiovascular events after clarithromycin use in lower respiratory tract infections: analysis of two prospective cohort studies zum Download zur Verfügung.
Zu etwas anderen Ergebnissen kommt eine im Mai 2013 ebenfalls im New England Journal of Medicine 368 (18): 1704-1712 publizierte Studie auf Grundlage des umfangreichen dänischen Patientenregisters mit Daten von fast 5 Millionen Bürgern zwischen 18 und 64 Jahren. Die Untersuchung bezog Arzneimittelverordnungen, die kardiovaskuläre Letalität sowie mehr als sechzig Daten zu Diagnostik und Therapie ein und wertete sie retrospektiv unter multivariater Adjustierung aus. Die Kopenhagener Forscher analysierten die Sterblichkeit wegen Durchblutungsstörungen des Herzens während und bis 35 Tage nach Gabe von Azithromycin und verglichen mehr als 1,1 Millionen Behandlungsperioden mit der von gleich vielen Kontrollen ohne antibiotische Therapie sowie 7.364.292 Patienten, die während der 13-jährigen Beobachtungszeit teilweise wiederholt Penicillin eingenommen hatten. Dabei konnten sie nachweisen, dass die kardiovaskuläre Letalität während der Behandlungsphasen mit dem Makrolidantibiotikum signifikant höher war als bei Patienten, die kein Antibiotikum erhalten hatten. Ein signifikantes Zusatzrisiko der AM-Therapie gegenüber der Penicillin- Therapie war dabei nicht erkennbar.
Dies scheint auf den ersten Blick im Widerspruch zu den Ergebnissen aus und Tennessee und Großbritannien zu stehen. Bei genauerer Analyse zeigt sich aber, dass die Patienten der dänischen Registerstudie durchschnittlich neun Jahre jünger waren und entsprechend seltener an einer Herzkreislauferkrankung litten. Betrachtet man die Ergebnisse älterer und kränkerer Patienten isoliert, belegt auch die dänische Kohorte eine höhere Letalität nach Azithromycin-Behandlung. Die aktuelle Studienlage lässt nur einen Schluss zu: Je höher das kardiovaskuläre Ausgangsrisko eines Patienten, desto größer ist die Gefährdung durch Makrolidgaben. Also: Finger weg von diesem Antibiotikum bei älteren Koronarpatienten!
Von der dänischen Kohortenstudie mit dem Titel Use of Azithromycin and Death from Cardiovascular Causes steht nur das einigermaßen ausführliche Abstract kostenfrei zum Download zur Verfügung.
Jens Holst, 4.8.13
"Within the coming days" oder wie aus Tagen Jahre werden können: Die "Tamiflu Campaign" 2003/2009 bis 2013 - und (k)ein Ende!?
 Seit 2009 führen die HerausgeberInnen des renommierten Medizinjournals "British Medical Journal (BMJ)" und Wissenschaftler der Influenza-Cochrane-Reviewergruppe eine zähe Auseinandersetzung um die tatsächliche Wirkung des zur Wirkstoffgruppe der Neuraminidasehemmer gehörenden Medikaments Tamiflu des Pharma-Großunternehmens Roche (siehe dazu u.a. den folgenden Tamiflu III-Betrag im forum-gesundheitspolitik).
Seit 2009 führen die HerausgeberInnen des renommierten Medizinjournals "British Medical Journal (BMJ)" und Wissenschaftler der Influenza-Cochrane-Reviewergruppe eine zähe Auseinandersetzung um die tatsächliche Wirkung des zur Wirkstoffgruppe der Neuraminidasehemmer gehörenden Medikaments Tamiflu des Pharma-Großunternehmens Roche (siehe dazu u.a. den folgenden Tamiflu III-Betrag im forum-gesundheitspolitik).
Nachdem die Cochrane-Reviewer in einem ersten Review an der vom Hersteller und in einer einzigen Metaanalyse diverser Einzelstudien durchweg positiv dargestellten Wirkung zweifelten und Zugang zu einer Vielzahl von Roche offensichtlich nicht veröffentlichten Wirkungsstudien forderten, begann eines der spannendsten und lehrreichsten Kapitel in der neueren Gesundheitspolitikgeschichte. Dies verhinderte aber nicht, dass Tamiflu und ein weiteres vergleichbares Mittel zeitweise von vielen Aerzten und Regierungen als präventives und kuratives Wundermittel gegen die Vogel- und zur Pandemie hochgejazzten Schweinegrippe gehalten und millionenfach steuerfinanziert eingelagert wurden und zu Milliardenumsätzen führten.
Dieses Kapitel ist vor allem durch das Nebeneinander von wiederholten Versprechungen Roche's geprägt, die Informationen zur Verfügung zu stellen, und dies gleichzeitig durch fintenreiche Manöver und ohne irgendeinen Täuschungsversuch auszulassen zu verhindern. Nachdem die ForscherInnen und die Oeffentlichkeit bis 2012 zwar von immer mehr unveröffentlichten Untersuchungen und Reports von Roche und anderen erfuhr, aber keinen Zugang zu ihnen erhielten, startete das BMJ eine einmalige so genannte "open data campaign", die das Ziel verfolgte "to achieve appropriate and necessary independent scrutiny of data from clinical trials. Working with others, we seek to highlight the problems caused by lack of access to data, and we welcome any suggestions on how to take things further."
Mit dem erneuten Versprechen, sämtliche ("full") anonymisierten Daten samt den unveröffentlichten Studien im April 2013 zu veröffentlichen, ist möglicherweise nach über vier Jahren die Basis geschaffen, die Wirkungen des zwischenzeitlich zu einem wahren Blockbuster gewordenen Tamiflu unabhängig zu überprüfen.
Wer das reich mit Originalkorrespondenzen zwischen Wissenschaftlern, dem BMJ, der WHO und der Firma Roche sowie einer Reihe von nationalen wie europäischen Aufsichts- und Zulassungsinstitutionen für Arzneimittel sowie frei zugänglichen Aufsätzen illustrierte Lehrstück überblicken und sich in sein Studium vertiefen will, findet den Zugang über die stetig aktualisierte BMJ-Website "Tamiflu campaign". Auf ihr findet sich auch eine interaktive Zeitschiene der pharmakologischen und medizinischen Untersuchungen über die erwünschten und unerwünschten Wirkungen von Tamiflu, die im Moment die Jahre 2003 bis 2013 umfasst. Dort gibt es auch eine Fülle von Links zu wichtigen vor allem im BMJ publizierten Tamiflu-Aufsätze.
Wer nachvollziehen will, warum manche Akteure dieser Debatte auch dem letzten Transparenzversprechen der Firma Roche nicht recht glauben wollen, sollte sich die vier Seiten umfassende Antwort von Peter Doshi auf die letzte Erklärung zur "Roche data transparency policy" vom 1. März 2013 durchlesen. Dort wird u.a. klar, wie eine unabhängige Forschung ŕ la Roche aussieht. Die Firma schlägt in einer Art "samtenem" Junktim vor, die Datensichtung und -bewertung durch eine "Multiparty Group for Advice on Science" begleiten zu lassen, als einem "fair, transparent and independent way of adressing data transparency regarding Tamiflu". Laut Doshi zeigen aber eindeutige und auch per Link zugängliche Dokumente, dass wenigstens drei der vier von Roche ins Auge gefassten Leiter der Gruppe nicht unabhängig sind, sondern bis vor kurzem noch finanzielle Beziehungen zu Roche hatten.
Wer jemals wieder behauptet, mangelnde Transparenz über den Nutzen und den Schaden von Arzneimitteln, die signifikante Nichtveröffentlichung von negativen Studienergebnissen und zahlreiche weitere Methoden Transparenz über Arzneimittel zu verhindern, seien "Ausrutscher" oder das Werk einzelner "schwarzer Schafe", sollte sofort mittels der Internetadresse der "Tamiflu Campaign" und mit dem Beispiel der durchgeplanten Strategien eines der größten Pharmaunternehmen der Welt eines Besseren belehrt werden.
Bernard Braun, 7.4.13
Brustkrebs: Studienergebnisse häufig verfälscht und verzerrt
 Übertreibung des Nutzens und Verschweigen der unerwünschten Wirkungen sind weit verbreitet, so lautet das Fazit einer Analyse von 164 Studien zur Wirksamkeit der Behandlung von Brustkrebs. Die Folge: Ärzte und Patienten gründen Behandlungsentscheidungen auf falsche, schöngefärbte Vorstellungen.
Übertreibung des Nutzens und Verschweigen der unerwünschten Wirkungen sind weit verbreitet, so lautet das Fazit einer Analyse von 164 Studien zur Wirksamkeit der Behandlung von Brustkrebs. Die Folge: Ärzte und Patienten gründen Behandlungsentscheidungen auf falsche, schöngefärbte Vorstellungen.
Ein kanadische Arbeitsgruppe untersuchte 164 randomisierte kontrollierte Studien (RCTs) unter der Frage, ob die Ergebnisse in Fachzeitschriften wahrheitsgemäß oder verfälscht bzw. verzerrt wiedergegeben werden.
In RCTs geht es um die Frage, ob eine neue Therapiemethode, z.B. ein neues Medikament oder eine neue Operationstechnik, besser ist als die bis dahin für am Besten erachtete. Der Begriff "primärer Endpunkt" bezeichnet das Kriterium, an dem der Erfolg bzw. Misserfolg der Intervention gemessen wird, also z.B. die Überlebenszeit. Sekundäre Endpunkte (SE) sind Ergebnisse, die ebenfalls wissenswert sind, aber nicht den Erfolg einer Therapie ausmachen. Übertragen auf ein Fußballmatch ist die Anzahl der Tore der PE, die Anzahl der Ecken ein SE. Würde die nach Toren unterlegene Mannschaft die erzielten bzw. nicht erzielten Tore (PE) verschweigen und stattdessen das für sie günstige Eckenverhältnis (SE) angeben, entstünde ein falsches bzw. verzerrtes Bild davon, welche Mannschaft besser ist.
In die Analyse gingen 164 Studien aus den Jahren 1995 bis 2011 ein. 148 Studien befassten sich mit medikamentösen Therapien, 11 mit Bestrahlungstherapie und 5 mit operativer Behandlung. Zu gleichen Teilen ging es um Therapien zur Verbesserung der Heilungsaussichten (adjuvante Therapie) und um Therapien bei metastasiertem Brustkrebs, wo eine Verbesserung der Überlebenszeit möglich aber eine Heilung nicht zu erwarten ist.
Ein sicheres Erfolgskriterium für eine Krebstherapie ist das Gesamtüberleben (overall survival, OS). Unsicher sind hingegen Kriterien wie progressionsfreies Überleben (progession-free survival, PFS) oder krankheitsfreies Überleben (disease-free survival, DFS), weil z.B. eine längere Zeit ohne feststellbares Tumorwachstum häufig mit nicht verbesserter oder gar verkürzter Überlebenszeit einhergeht. Umso bemerkenswerter ist es, dass in 137 Studien mit PFS bzw. DFS unsichere PE zum Erfolgskriterium ausgewählt wurden und OS, also Gesamtüberleben, nur in 27 Studien (16,5%).
Verzerrungen (Bias) stellten die Forscher im Berichten der PEs in 33% und im Berichten der Toxizität in 67% fest. 92 der 164 Studien hatten ein negatives Ergebnis bezüglich des PE, die neue Therapie war also nicht besser als die herkömmliche Behandlung. In 59% dieser Studien wurde der eigentlich negative PE positiv dargestellt oder verschwiegen und stattdessen ein positiver SE berichtet. Hier wurde also Nutzen suggeriert, wo keiner war.
Die schwere und lebensbedrohliche Folgen der Therapie (Toxizität Grad 3 und 4) wurden nur in einem Drittel der Veröffentlichungen im Abstract angegeben.
30 der Studien waren im Studienregister ClinicalTrials.gov eingetragen. Der Vergleich der hier eingetragenen PE mit den in der Veröffentlichung aufgeführten PE zeigte, dass in 7 Studien der PE verändert wurde (im Sinne von Eckstöße statt Tore). In 130 Studien konnte dieser Vergleich nicht durchgeführt werden, weil sie nicht registriert waren.
Diese Studie ist ein weiterer Beleg für die gravierenden Missstände im Bereich der medizinischen Forschung.
So erscheint es inakzeptabel, dass Studien mit hochwirksamen Medikamenten durchgeführt werden, deren Erfolg an Kriterien gemessen wird, die zweifelsfrei unzulänglich sind. Hier sind die Ethikkommissionen, die Zulassungsbehörden und auch die Fachzeitschriften gefordert. Letztere könnten z.B. die Veröffentlichung derartiger Studien ablehnen.
Verfälschungen und Verzerrungen bei der Veröffentlichung von Studienergebnissen -nach wie vor eher die Regel als die Ausnahme - sind nur verhinderbar durch Transparenz: alle Informationen über eine Studie müssen überprüfbar gemacht werden. Dafür ist nicht nur die Registrierung aller Studien zu fordern sondern auch die Pflicht zur zeitnahen Veröffentlichung der Ergebnisse sowie der Einblick in das Studienprotokoll und die Möglichkeit zur unabhängigen Überprüfung der gewonnenen Daten.
Die Autoren haben folgerichtig ihre eigene Arbeit frei zugänglich gemacht.
Vera-Badillo FE, Shapiro R, Ocana A, Amir E, Tannock IF.
Bias in reporting of end points of efficacy and toxicity in randomized, clinical trials for women with breast cancer. Annals of Oncology 2013 Volltext der Studie
Zur Vertiefung des Themas hier ein Link auf die Website eines wissenschaftlichen Symposiums, das am 10. und 11.10.2012 in Freiburg stattgefunden hat mit dem Thema "ACT now: Accuracy, Completeness, and Transparency in health research reporting". Die Vorträge und Vortragsfolien sind abrufbar.
Ebenfalls zum Thema ein 13-minütiges sehenswertes Video von Ben Goldacre, das sich an die breite Öffentlichkeit wendet. Es wurde im September 2012 veröffentlicht und verzeichnet bislang 572.000 Aufrufe.
Ben Goldacre: What doctors don't know about the drugs they prescribe. Link
David Klemperer, 15.1.13
Schlechte Information der und Kommunikation mit Eltern zum Risiko unerwünschter Wirkungen von Arzneimitteln ihrer Kinder
 Die Behandlung erkrankter Kinder stellt in mancherlei Hinsicht eine besondere Herausforderung für Ärzte und andere Akteure im Gesaundheitswesen dar. Dabei spielen insbesondere bei ganz jungen Kindern Eltern oder andere erwachsene Begleitpersonen sowohl bei der Information über die gesundheitlichen Beschwerden der Kinder als auch bei der Therapietreue der Kinder eine wichtige Rolle. Dazu müssen sie aber umfassend informiert werden.
Die Behandlung erkrankter Kinder stellt in mancherlei Hinsicht eine besondere Herausforderung für Ärzte und andere Akteure im Gesaundheitswesen dar. Dabei spielen insbesondere bei ganz jungen Kindern Eltern oder andere erwachsene Begleitpersonen sowohl bei der Information über die gesundheitlichen Beschwerden der Kinder als auch bei der Therapietreue der Kinder eine wichtige Rolle. Dazu müssen sie aber umfassend informiert werden.
Die jetzt veröffentlichten Ergebnisse einer qualitativen Studie mit Eltern von 44 britischen ambulant und stationär behandelten Kindern, die unerwünschte Wirkungen von verordneten Arzneimitteln ("adverse drug reactions") erlitten hatten, zeigen aber, dass die Information der Eltern behandelter Kinder über die Ursachen und/oder Vermeidungsmöglichkeiten dieser Wirkungen "generally disappointed" waren. Bei den Arzneimitteln handelt es sich z.B. um Antibiotika, schwere Schmerzmittel, Epileptika und Zellgifte.
Insgesamt berichteten die Eltern von einer mageren Kommunikation über die potenziellen Risiken für unerwünschte, schwere Reaktionen nach der Einnahme der Arzneimittel und über die Art der Reaktionen selber. Entweder wurden solche Informationen überhaupt nicht geliefert oder zu völlig unpassenden Gelegenheiten, wie etwa auf dem Weg des Kindes in den Operationssaal.
Die einzige positive Ausnahme stellten nach dieser Studie Informationen zur Wirkweise und den unerwünschten Effekten von Krebsmitteln dar, welche die Eltern als klar und umfassend bewerteten.
Die AutorInnen weisen darauf hin, dass schlechte Information von Eltern deren künftigen Umgang mit Arzneimitteln negativ beeinflusst und u.U. auch Auswirkungen auf das Vertrauen in die Wirkung von Arzneimitteln bei den älter gewordenen Kindern haben kann.
Die möglichen Einwände gegen die geringe Anzahl von Eltern-Kinder-Einheiten und die gewählte qualitative Methode und die zusätzlich möglichen Zweifel an der Übertragbarkeit der Ergebnisse auf die Wirklichkeit der Kommunikation über unerwünschte Arzneimittelwirkungen im deutschen Gesundheitswesen, ließen sich mit relativ geringem Aufwand bestätigen oder widerlegen. Bis dahin spricht manches für ein ähnliches Kommunikations-Verhalten deutscher Ärzte.
Weitere Ergebnisse und eine Reihe von Zitaten aus den Gesprächen mit Eltern können in dem komplett kostenlos erhältlichen Aufsatz "Enhancing Communication about Paediatric Medicines: Lessons from a Qualitative Study of Parents' Experiences of Their Child's Suspected Adverse Drug Reaction." von Arnott J, Hesselgreaves H, Nunn AJ, Peak M, Pirmohamed M, et al. (2012) in der Open Access-Zeitschrift "PLoS ONE" (7(10): e46022) nachgelesen werden.
Bernard Braun, 15.10.12
Fortbildungssponsoring durch die Industrie: Ärzte erkennen das Problem aber nicht die Lösung
 In den USA wird - wie in Deutschland - ein erheblicher Anteil der ärztlichen Fortbildung durch die Industrie finanziert, in den USA 2006 laut Jahresbericht 2009 der Akkreditierunsstelle für Fortbildung zu 60%.
In den USA wird - wie in Deutschland - ein erheblicher Anteil der ärztlichen Fortbildung durch die Industrie finanziert, in den USA 2006 laut Jahresbericht 2009 der Akkreditierunsstelle für Fortbildung zu 60%.
Für die Industrie ist das Sponsoring ärztlicher Fortbildung Teil ihres Marketing mit dem Ziel, die Umsätze ihrer Produkte zu erhöhen. In zahlreichen Untersuchungen ist belegt, dass die Qualität der Informationen leidet, wenn die Industrie direkt oder indirekt an ihrer Erstellung oder Vermittlung beteiligt ist. Darüber berichten wir fortlaufend in der Rubrik "Einflussnahme der Pharma-Industrie".
Angesichts des Wissens um Bias, also die Verzerrung von Informationen, hat das Institute of Medicine in seinem wegweisenden Bericht über Interessenkonflikte in der Medizin (wir berichteten) ein Fortbildungssystem gefordert, das frei von kommerziellem Einfluss ist, das Vertrauen der Öffentlichkeit verdient und hohe Qualität bietet.
In einer kürzlich veröffentlichten Studie wurden die Teilnehmer von 5 Fortbildungsveranstaltungen zu AIDS-Themen zum einen danach befragt, ob die Finanzierung durch die Industrie ihrem Eindruck nach zu Bias führt; zum anderen wurde nach der Bereitschaft gefragt, selbst mehr für Fortbildung zu zahlen oder eine Minderung des Komforts im Kauf zu nehmen, um die Unabhängigkeit zu gewährleisten. 55% der 770 Befragten waren Ärzte, 35% Angehörige von Pflegeberufen oder anderen in der Versorgung von AIDS-Patienten beteiligten Berufsgruppen.
Die Stärke des wahrgenommenen Bias korrelierte mit dem Ausmaß der Industriefinanzierung - je größer der Anteil an der Gesamtfinanzierung desto größer der Bias. Beispielsweise gehen bei 100%iger Industriefinanzierung 86% der Ärzte von einem mäßigen bis starken Bias aus, bei 20% noch 33%; bei unabhängiger Finanzierung sehen 93% keinen oder nur minimalen Bias. Sponsoring durch eine Firma geht mit größerer Bias-Gefahr her als durch 2 oder mehr Firmen.
Ärzte schätzten den Bias durchgehend etwas höher ein als Angehörigen anderer Berufe.
Erhöhte Teilnahmegebühren als ein Weg zur Minderung des Industrieeinflusses - dieser Vorschlag trifft bei den Ärzten auf ein geteiltes Echo: etwas weniger als die Hälfte stimmt dem zu, etwas mehr als die Hälfte nicht. Etwas mehr als die Hälfte hält das Sponsoring der Fortbildung durch die Industrie für essentiell und spricht sich gegen die Abschaffung aus, 83% sprechen sich explizit gegen die Abschaffung aus oder antworten neutral, nur 17% sind explizit für die Elimination des Industriesponsoring.
Auch die Vorschläge für Kostensenkungen spalten die Ärzteschaft: jeweils 50% würden auf kostenloses Essen verzichten bzw. auch weniger attraktive Veranstaltungsorte akzeptieren. Gegen weniger Themen und weniger Vortragende sowie weniger Fortbildung überhaupt sprechen sich jedoch jeweils etwa 90% aus.
Wenig überraschend ist es, dass diejenigen, die den Sponsoring-Bias höher einschätzen einer Erhöhung der Teilnahmegebühren und einer Elimination des Sponsoring eher zustimmen.
Zusammenfassend lässt sich sagen, dass viele Ärzte die Probleme des Sponsoring von Fortbildung durch die Industrie erkennen. Auch gibt es eine gewisse Bereitschaft zu kostensenkenden Maßnahmen und zur Zahlung erhöhter Teilnahmegebühren. Die Zustimmung zur vollständigen Unabhängigkeit durch Elimination des Sponsoring befürwortet in dieser Studie jedoch nur eine Minderheit von 17%.
Vergleichbare Daten liegen für Deutschland bislang leider nicht vor.
Tabas JA, Boscardin C, Jacobsen DM, Steinman MA, Volberding PA, Baron RB. Clinician Attitudes About Commercial Support of Continuing Medical Education: Results of a Detailed Survey. Arch Intern Med 2011;171:840-46
Abstract
Der Report des Institute of Medicine "Conflict of Interest in Medical Research, Education, and Practice" kann seit Kurzem nach einer unkomplizierten Registrierung kostenlos heruntergeladen werden.
Website
David Klemperer, 10.7.11
Pharmavertreter und Medizinstudenten - eine verhängnisvolle Affäre
 Die meisten Medizinstudenten haben von Beginn ihres Studiums an Kontakt zu Pharmavertretern und nehmen gerne Einladungen zu Mahlzeiten und kleine Geschenke an. Dies und mehr fanden amerikanische Forscher in einer systematischen Übersichtarbeit heraus, in sie der Frage nach Kontakten von Medizinstudenten mit Pharmavertretern und ihrer Haltung gegenüber den Marketingpraktiken der Industrie nachgingen. Die Ergebnisse stützen sich auf 32 Studien, zumeist Befragungen, aus den Jahren 1971 bis 2010 mit insgesamt 9.850 Studenten an 76 Kliniken bzw. Lehrkrankenhäusern.
Die meisten Medizinstudenten haben von Beginn ihres Studiums an Kontakt zu Pharmavertretern und nehmen gerne Einladungen zu Mahlzeiten und kleine Geschenke an. Dies und mehr fanden amerikanische Forscher in einer systematischen Übersichtarbeit heraus, in sie der Frage nach Kontakten von Medizinstudenten mit Pharmavertretern und ihrer Haltung gegenüber den Marketingpraktiken der Industrie nachgingen. Die Ergebnisse stützen sich auf 32 Studien, zumeist Befragungen, aus den Jahren 1971 bis 2010 mit insgesamt 9.850 Studenten an 76 Kliniken bzw. Lehrkrankenhäusern.
Die häufigsten Interaktionen sind Industrie-gesponserte Fortbildung, Einladungen zum Essen, Geschenke wie Kugelschreiber und Tassen, Lehrbücher und Fortbildungsmaterialien, Sonderdrucke von Studien, Arzneimittelmuster und "social events", womit Einladungen in Restaurants, Konzerte, Theater und Sportereignisse gemeint sein dürften. Im vorklinischen Teil des Studiums waren die einzelnen Interaktionen teils selten - so gab es keine Einladungen zu feinem Essen - addierten sich aber auf, so dass fast alle Studenten Kontakt zur Industrie hatten. Im Verlauf des Studiums wurden die Kontakte mit jedem Semester häufiger.
Die Haltungen der Studenten bezüglich der Marketing-Praktiken unterschieden sich und waren teils gegensätzlich. Viele hielten Mahlzeiten, kleine Werbegeschenke und Lehrbücher bzw. Informationsmaterialien für akzeptabel, weniger Zustimmung fanden social events und Reisen. Geschenke anzunehmen rechtfertigten sie mit Geldknappheit und damit, dass es die anderen ja auch täten. Die Zustimmungsraten zur Annahme von Geschenken durch Studenten stiegen von der vorklinischen zur klinischen Phase des Studiums an, ebenso wie die Zustimmung zur Annahme von Geschenken durch Ärzte. Die große Mehrheit (85%) meinte hingegen, dass es für Regierungsbeamte unangemessen sei, Geschenke anzunehmen.
Die meisten Studenten (je nach Studie bis zu 92%) gingen davon aus, dass die Informationen der Industrie verzerrt sind. Nicht alle, aber viele Studenten waren trotzdem der Meinung, dass die Informationen nützlich für ihre Ausbildung sind. 2/3 waren der Meinung, gegenüber den Beeinflussungsversuchen der Industrie immun zu sein. Die meisten hielten ihre Mit-Studenten - im Gegensatz zu sich selbst - für beeinflussbar.
Je ausgeprägter die Kontakte zur Industrie waren, desto seltener hielten die Studenten die Kontakte für unangemessen, die Informationsmaterialien für verzerrt und generell die Marketing-Praktiken für negativ.
Deutliche Auswirkungen zeigte die jeweilige Lernumgebung. Manche Fakultäten bzw. Lehrkrankenhäuser beschränken oder unterbinden die Aktivitäten von Pharmavertretern. In diesen Einrichtungen waren die Interaktionen der Studenten mit Pharmavertretern deutlich seltener, ihre Einstellungen kritischer und die Einschätzung der Werbebotschaften skeptischer.
Befragt nach ihrer Einstellung zu Reformen lehnten es die meisten Studenten ab, den Pharmavertretern den Zugang zur Klinik zu verwehren. Die Mehrheit wünscht jedoch mehr Fortbildung in Fragen der Interaktion von Ärzten und Industrie.
Zusammenfassend entsprechen die Ergebnisse dieser Studie über Medizinstudenten dem, was man aus anderen Studien über Ärzte weiß:
• Die Mehrheit zeigt eine unkritische Haltung gegenüber den Marketinganstrengungen der Industrie.
• Die Mehrheit erkennt die Unzuverlässigkeit der Informationen der Industrie und hält sie trotzdem für wertvoll
• Die meisten halten sich für immun gegenüber den Beeinflussungsversuchen der Industrie, seine Kollegen nicht.
An anderer Stelle haben wir Studien referiert, die aufgezeigt haben,
• dass Ärzte in ihrem Verschreibungsverhalten durch das Marketing der Industrie beeinflusst werden mit dem Ergebnis einer schlechteren Arzneimittelversorgung (Link) und
• dass es keine Immunität gegenüber "weapons of influence" wie Reziprozität und Freundschaft gibt Link.
Austad KE, Avorn J, Kesselheim AS. Medical Students' Exposure to and Attitudes about the Pharmaceutical Industry: A Systematic Review. PLoS Med 2011;8(5):e1001037, Volltext kostenlos Link
Studie über Ärzte:
Lieb K, Brandtönies S. Eine Befragung niedergelassener Fachärzte zum Umgang mit Pharmavertretern. Dtsch Arztebl 2010;107(22):392-8. Link
dazu Forum Gesundheitspolitik: Ärzte und Pharmavertreter - eine verhängnisvolle Affäre Link
David Klemperer, 21.6.11
"Wes Brot ich ess', des Nutzen ich preis'": Arzneimittelanzeigen in Fortbildungsmedien für Ärzte fördern Mittel-Empfehlungen
 Die oftmals kostenlos als Mittel zum Transfer wissenschaftlicher Erkenntnisse in die Praxis angebotenen und genutzten Zeitschriften, die sich u.a. mit Werbeanzeigen für Arzneimittel finanzieren, neigen zu einer deutlich unkritischeren Berichterstattung bis hin zu geballten Empfehlungen der beworbenen Mittel als andere und anderweitig finanzierte Fortbildungszeitschriften ohne Werbung.
Die oftmals kostenlos als Mittel zum Transfer wissenschaftlicher Erkenntnisse in die Praxis angebotenen und genutzten Zeitschriften, die sich u.a. mit Werbeanzeigen für Arzneimittel finanzieren, neigen zu einer deutlich unkritischeren Berichterstattung bis hin zu geballten Empfehlungen der beworbenen Mittel als andere und anderweitig finanzierte Fortbildungszeitschriften ohne Werbung.
Dies ist das Ergebnis der systematischen Analyse sämtlicher Ausgaben von 11 derartiger Zeitschriften (darunter die Ärztezeitung, Medical Tribune, Der Hausarzt, Deutsches Ärzteblatt und das Arznei Telegramm) im Jahr 2007 durch eine internationale Forschergruppe um die Marburger Mediziner Becker und Donner-Banzhoff.
In den insgesamt 465 Ausgaben fanden die ForscherInnen 638 Anzeigen für neue ("innovative") Arzneimittel und 497 redaktionelle Beiträge, die sich genau mit diesen Arzneimitteln befassten. In 297 Artikeln wurden klare Empfehlungen für oder gegen den Gebrauch der Arzneimittel gegeben.
Eine inhaltsanalytische Sichtung der redaktionellen Beiträge führten zu eindeutigen Ergebnissen:
• In den Zeitschriften, die von bezahlter Werbung leben, fanden sich 257 Empfehlungs-Artikel. 91,8 % dieser Artikel sprachen sich auf einer Skala von -2 bis +2 maximal für den Gebrauch der entsprechenden Arzneimittel aus. Bei zwei der untersuchten Zeitschriften verdoppelt sich sogar die Wahrscheinlichkeit einer therapeutischen Empfehlung, wenn eine Anzeige geschaltet war.
• In den Zeitschriften, die von Abonnementeinnahmen leben, gab es 34 Empfehlungs-Artikel. Von ihnen empfahlen 8,8 % den Gebrauch der Arzneimittel, 8,8 % waren unentscheiden und 82,3 % sprachen sich mehr oder weniger stark gegen die Nutzung der Arzneimittel aus.
• Nicht mehr verwunderlich ist es dann, wenn praktisch kein Autor solcher redaktionellen Beiträge etwas zu seinen möglichen Interessenkonflikten erwähnt, also sie auch nicht ausschließt. Einige Zeitschriften werben geradezu mit dem engen Nebeneinander und möglichen Miteinander von Anzeigen und Texten.
Wenn man zusätzlich beachtet, dass beispielsweise für die Ärzte in Kanada nachgewiesen ist, dass sie mehr als die Hälfte ihrer Informationen aus kostenlosen Zeitschriften beziehen, wird die Relevanz des Zusammenhangs von Werbeanzeigen und Verordnungsempfehlungen für die Gesundheit und den Geldbeutel der Patienten noch offenkundiger.
Vielleicht sollten Patienten demnächst auch ihren Arzt oder Apotheker nach seinen Informationsquellen fragen und nicht blind darauf vertrauen, dass der sich schon in guten und ja durchaus auch bezahlbaren Fachjournalen informiert!?
Der fünfseitige materialreiche Aufsatz "The association between a journal's source of revenue and the drug recommendations made in the articles it publishes" von Annette Becker, Fatma Dörter, Kirsten Eckhardt, Annika Viniol, Erika Baum, Michael M. Kochen, Joel Lexchin, Karl Wegscheider und Norbert Donner-Banzhoff ist in der Februarausgabe 2011 der kanadischen Fachzeitschrift "Canadian Medical Association Journal (CMAJ)" (Can. Med. Assoc. J., Feb 2011) erschienen und komplett kostenlos erhältlich.
Bernard Braun, 1.3.11
Von Pharmawerbung beeinflusste Ärzte verschreiben häufiger, qualitativ schlechter und teurer
 In einzelnen Studien der letzten Jahre war bereits deutlich geworden, dass Marketing und Werbung von Pharmaunternehmen eigene Zielsetzungen sehr wohl erreicht und das Verordnungsverhalten von Ärzten zu eigenen Gunsten zu beeinflussen vermag. Eine jetzt in der Open-Access-Zeitschrift "PLOS Medicine" veröffentlichte Meta-Analyse unter Einbezug von 58 schon veröffentlichten Studien hat diese Einzelergebnisse noch einmal bestätigt: Mediziner, die auf unterschiedlichen Wegen (Pharma-Referenten, Fortbildungs-Veranstaltungen, Broschüren usw.) häufiger Informationen von Pharma-Unternehmen aufnehmen, zeigen im Rahmen ihrer Medikamentenverordnung ein anderes Verhalten: Sie verschreiben mehr Medikamente, von der Indikation her weniger sinnvolle Arzneien und auch teurere Arzneien.
In einzelnen Studien der letzten Jahre war bereits deutlich geworden, dass Marketing und Werbung von Pharmaunternehmen eigene Zielsetzungen sehr wohl erreicht und das Verordnungsverhalten von Ärzten zu eigenen Gunsten zu beeinflussen vermag. Eine jetzt in der Open-Access-Zeitschrift "PLOS Medicine" veröffentlichte Meta-Analyse unter Einbezug von 58 schon veröffentlichten Studien hat diese Einzelergebnisse noch einmal bestätigt: Mediziner, die auf unterschiedlichen Wegen (Pharma-Referenten, Fortbildungs-Veranstaltungen, Broschüren usw.) häufiger Informationen von Pharma-Unternehmen aufnehmen, zeigen im Rahmen ihrer Medikamentenverordnung ein anderes Verhalten: Sie verschreiben mehr Medikamente, von der Indikation her weniger sinnvolle Arzneien und auch teurere Arzneien.
"Viele Ärzte", so erklärte Joel Lexchin, einer der Autoren in einer Pressemitteilung der Universität York, "behaupten von sich, dass die Informationen von Pharma-Unternehmen sie in ihren Entscheidungen nicht beeinflussen. Unsere Forschungsergebnisse zeigen jedoch ganz klar, dass es einen deutlichen - und zwar negativen - Einfluss gibt."
Etwa ein Viertel ihrer Einnahmen investieren US-Pharmafirmen in Werbung und Marketing für ihre Produkte, im Jahr 2004 waren es knapp 58 Milliarden Dollar. Dass diese Ausgaben sich rechnen, hat ein Bericht der Los Angeles Times gezeigt: Jeder zusätzliche Werbedollar, der für ein Arzneimittel ausgegeben wird, bringt etwa 5 Dollar zusätzlichen Umsatz, für Ausgaben im Bereich des Sponsoring von Bildungsveranstaltungen ist der Ertrag mit 3,56 $ nicht ganz so hoch. (vgl. "In Short, Marketing Works: By Targeting Consumers and Doctors").
In der jetzt durchgeführten Meta-Analyse eines siebenköpfigen australischen Forschungsteams wurde nun noch einmal bestätigt, dass dieser Effekt leider nur zu Gunsten des jeweiligen Pharma-Unternehmens besteht, aber eher zu Ungunsten von Patienten und Krankenkassen. 58 Studien wertete das Team noch einmal aus, Studien, in denen einerseits unterschiedliche Formen der Information durch Pharmafirmen erfasst waren, andererseits bestimmte Aspekte des Verordnungsverhaltens. In einigen Studien wurden mehrere der im Folgenden angeführten Merkmale untersucht. Wesentliche Ergebnisse waren dann:
• Zehn Studien hatten die Qualität des Verschreibungsverhaltens überprüft, und zwar mit unterschiedlichen Methoden, zum Beispiel Befolgung von Therapie-Leitlinien auf der Basis der Diagnose oder durch Vorgabe von klinischen Fallbeispielen mit der Aufforderung, passende Arzneimittel zu benennen. Vier Studien kamen zu dem Ergebnis, dass sich kein Zusammenhang finden lässt zur Intensität der Aufnahme medizinischer Informationen von der Pharma-Industrie, 5 Studien fanden heraus, dass sich das Verschreibungsverhalten dadurch verschlechtert, in einer Studie ergab sich eine Verbesserung.
• Von 51 Studien, die den Zusammenhang von Pharma-Informationen und Menge der verschriebenen Medikamente untersuchten, fand keine Untersuchung eine niedrigere Verordnungsmenge, 13 fanden keinen Zusammenhang, 38 stellten fest, dass mit der Intensität und Häufigkeit von Informationen durch die Pharma-Industrie auch die Menge verordneter Arzneien steigt.
• Damit hängt auch direkt zusammen, dass von 10 Studien, die die verursachten Arzneimittel-Kosten berücksichtigten, 5 Studien höhere Kosten ermittelten, 1 Studie niedrigere Ausgaben und 4 Studien keinen Zusammenhang fanden.
Die Wissenschaftler betonen, dass ihre Ergebnisse zwar einen eindeutigen Trend benennen. Da es sich bei den Studien aber nicht um randomisierte Kontrollstudien handelt (mit entsprechenden Kontrollgruppen von Ärzten) könne man nicht ausschließen, dass die Werbebotschaften der Pharmaindustrie in Einzelfällen doch einen positiven Effekt haben. Die Studie ist kostenlos im Volltext verfügbar: Geoffrey K. Spurling et al: Information from Pharmaceutical Companies and the Quality, Quantity, and Cost of Physicians' Prescribing: A Systematic Review
In einer 2008 in Deutschland durchgeführten Befragung von Fachärzten für Neurologie/Psychiatrie, Allgemeinmedizin und Kardiologie (den Facharztgruppen mit den höchsten Kosten für Arzneimittelverordnungen pro Arzt) hatte sich das paradoxe Ergebnis gezeigt, dass Ärzte zwar einen Einfluss der Werbung wahrnehmen. Aber dies nur bei Kollegen, nicht bei sich selbst. Drei von vier Ärzten gehen zunächst einmal davon aus, dass Pharmavertreter sie darin beeinflussen wollen, welche Medikamente sie verschreiben. Jedoch über 90% halten sich für völlig oder weitgehend immun gegenüber den Beeinflussungsversuchen: 9% der Befragten glauben, überhaupt nicht beeinflussbar zu sein, weitere 83% geben an, nur selten oder gelegentlich beeinflusst zu werden. Ihre Kollegen betrachten die Ärzte andererseits jedoch als beeinflussungsgefährdet: 21% glauben, dass diese den Beeinflussungsversuchen der Pharmavertreter häufig oder immer erliegen. (Ärzte und Pharmavertreter - eine verhängnisvolle Affäre) Diese deutsche Befragung bestätigt damit Befunde einer US-Studie aus dem Jahr 2007 (Physicians and Drug Representatives: Exploring the Dynamics of the Relationship
Kritische Worte kommen zu diesem Thema vom Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen. In seinem Gutachten 2005: "Koordination und Qualität im Gesundheitswesen" kommt der Rat unter der Überschrift "Detailing" auch zu der Feststellung, dass die Einflussnahme der Pharmaindustrie (durch Pharma-Referenten) auf das Verschreibungsverhalten der Ärzte durchaus erfolgreich und nachhaltig ist. Dort heißt es: "Je häufiger Ärzte Vertriebsagenten sehen,
• desto eher sind sie geneigt, Arzneimittel in Fällen einzusetzen, in denen eine nichtmedikamentöse Therapie die beste Option ist,
• desto häufiger vertreten sie Ansichten, die eher den Angaben aus der Werbung als denen in wissenschaftlichen Publikationen entsprechen,
• desto wahrscheinlicher ist es, dass sie Antibiotika unangemessen verschreiben,
• desto unwahrscheinlicher ist es, dass sie Generika206 rezeptieren und
• desto wahrscheinlicher verordnen sie teure Medikamente auch dann, wenn vergleichbar wirksame, aber billigere verfügbar sind.
Ärzte sind sich zwar der werbenden, verzerrenden Darstellung der produktbezogenen Informationen bewusst. Sie leugnen jedoch - trotz gegenteiliger empirischer Befunde - häufig, dass diese ihr Verhalten beeinflussen. Sie glauben vielfach an ihre persönliche Immunität gegenüber den Marketingmaßnahmen der Industrie. Allerdings korreliert die Zahl entgegengenommener Werbegeschenke empirisch positiv mit der Wahrscheinlichkeit einer solchen Einstellung." (SVR: Koordination und Qualität im Gesundheitswesen, Seite 650)
Gerd Marstedt, 15.11.10
Auf niedrigem Niveau weiter fallend: Die öffentliche Reputation der Pharmaindustrie in den USA im Jahr 2009.
 Über die Art und Weise wie viele Pharmahersteller in der Öffentlichkeit agieren berichten mittlerweile eine Vielzahl von Medien - darunter auch das Forum-Gesundheitspolitik - regelmäßig. Dies gilt auch und vor allem für die Transparenz über ihre Methoden auch nutzlose, gesundheitsgefährdende oder überteuerte Arzneimittel auf den Markt zu bringen und dort so lange wie profitabel zu halten.
Über die Art und Weise wie viele Pharmahersteller in der Öffentlichkeit agieren berichten mittlerweile eine Vielzahl von Medien - darunter auch das Forum-Gesundheitspolitik - regelmäßig. Dies gilt auch und vor allem für die Transparenz über ihre Methoden auch nutzlose, gesundheitsgefährdende oder überteuerte Arzneimittel auf den Markt zu bringen und dort so lange wie profitabel zu halten.
Wie jetzt der aktuelle, elfte "Annual Reputation Quotient" des Meinungsforschungsinstituts "Harris interactive" für das Jahr 2009 zeigt, wirkt sich das Verhalten der Arzneimittelhersteller zumindest in den USA auch immer stärker auf das Ansehen der Branche und ihrer größten Vertreter aus.
Im RQ wurden 29.963 US-BürgerInnen nach ihrer Bewertung von 20 Attributen mit jeweils mehreren Unterpunkten gefragt, die als Komponenten von Reputation angesehen werden: vision & leadership, social responsibility, emotional appeal, products & services, workplace environment und financial performance. Aus den Antworten wird ein sogenannter RQ-Score gebildet. Der maximale Wert des Scores kann 100 Punkte betragen. Die Befragten müssen zuerst angeben, welche Unternehmen ihnen im Zusammenhang mit Reputation überhaupt einfallen und dann für diese die Reputationsfragen beantworten.
Die wichtigsten Ergebnisse im Jahr 2009 lauteten:
• Unter den 60 Unternehmen mit dem höchsten Reputationswert gibt es ein einziges Pharmaunternehmen, die Firma Pfizer. Mit 69 Punkten liegt sie auf Platz 40 der Rangliste, an deren Spitze mit jeweils über 80 Punkten Firmen wie Google oder Intel liegen.
• Die gesamte Branche erreicht 2009 29 Punkte. Noch weniger Reputationspunkte erreichen nur noch Fluggesellschaften, Versicherungs- und Finanzdienstleister (16) oder das fast ewige Schlusslicht, die Tabakindustrie mit 11 Punkten. Im Vergleich mit 2008 ist die Pharmaindustrie die einzige Branche, deren Reputation sinkt, und zwar um 2 Punkte.
Auch wenn selbst diese Resonanz in der Öffentlichkeit die Pharmaindustrie wenig beeindrucken dürfte, kann ihre geringe Reputation der interessierten Öffentlichkeit nicht völlig egal sein. Möglicherweise ist damit nämlich auch ein Verfall des Vertrauens in die Produkte der Branche verknüpft ist, die nützlich sind und bei denen es aber auch auf eine maximale Therapietreue ankommt. Die offensichtlich weitverbreiteten negativen Assoziationen, wenn es um Pharmahersteller und ihre Produkte geht, können diese beeinträchtigen.
Wer mehr über die Methode des RQ und die weiteren Ergebnisse wissen will, kann sich die knapp 30 Seiten umfassende Zusammenfassung des "Annual RQ. 2009 Summary Report. A survey of the U.S. General pubic using the reputation quo-tient" kostenlos herunterladen.
Dass es auch in Deutschland erhebliche Vertrauensdefizite gegenüber der Pharma-Industrie gibt, hatte eine repräsentative Bevölkerungsumfrage im Jahr 2009 gezeigt: Arzneimittel-Information: Deutsche haben ähnliche Vorbehalte gegenüber der Pharma-Industrie wie US-Bürger
Bernard Braun, 8.11.10
Industriegesponserte Studien sind einträglicher - Interessenkonflikte bei Herausgebern von Fachzeitschriften
 Fachzeitschriften können von der Veröffentlichung von Studien über den Anstieg des Impact Factor und über die Einnahmen aus Sonderdrucken profitieren. Diese Faktoren können die Entscheidung des Herausgebers über die Annahme oder die Ablehnung der Veröffentlichung einer Studie beeinflussen und stellen somit einen Interessenkonflikt dar.
Fachzeitschriften können von der Veröffentlichung von Studien über den Anstieg des Impact Factor und über die Einnahmen aus Sonderdrucken profitieren. Diese Faktoren können die Entscheidung des Herausgebers über die Annahme oder die Ablehnung der Veröffentlichung einer Studie beeinflussen und stellen somit einen Interessenkonflikt dar.
Medizinisches Wissen und Handeln gründet auf den Ergebnissen von Studien. Wichtigster Ort für die Veröffentlichung von Studien sind Fachzeitschriften - auch in Zeiten des Internet. Der Herausgeber einer Fachzeitschrift trifft die letzte Entscheidung darüber, ob eine eingereichte Studie angenommen oder abgelehnt wird. Diese Entscheidung sollte der Herausgeber im Idealfall ausschließlich aufgrund der Relevanz und Qualität der Studie treffen.
Die Autoren untersuchten die in den Zeiträumen 1995-1996 und 2005-2006 veröffentlichten randomisierten kontrollierten Studien in sechs renommierten medizinischen Journalen (Annals of Internal Medicine, Archives of Internal Medicine,
British Medical Journal / BMJ, Journal oft he American Medical Association / JAMA, The Lancet, New England Journal of Medicine /NEJM). Für diese Studien wurde die Finanzierungsquelle ermittelt und die Anzahl der Arbeiten, in denen die Studien zitiert wurden. Die Anzahl der zitierenden Arbeiten geht in den sog. Impact Factor ein, der als ein Maß für die Bedeutung einer Fachzeitschrift gilt - auch wenn dieses Maß fragwürdig ist (siehe z.B. Beitrag in Wikipedia).
Der Anteil der Arbeiten, die allein von der Industrie finanziert wurde betrug im Zeitraum 2005-2006
• 7% im BMJ,
• 19% in den Annals of Internal Medicine
• 15% in den Archives of Internal Medicine
• 26% im JAMA
• 22% im Lancet
• 32% im NEJM.
Die durchschnittliche Zahl der zitierenden Arbeiten liegt bei Industrie-finanzierten Studien allgemein höher. So wurden Industrie-finanzierte Studien aus dem NEJM im Durchschnitt 82,2 Mal zitiert, hingegen Studien ohne Industrieunterstützung 47,3 Mal.
Erfolgreiche Studien streuen Firmen gerne weltweit in Form von Sonderdrucken, die sie von den Verlagen für Beträge bis über 1 Mio. Dollar kaufen, wie Richard Smith, der frühere Herausgeber des BMJ mitteilte. Die Autoren befragten die Herausgeber der sechs Fachzeitschriften per Email, welchen Anteil ihrer Einnahmen Anzeigen, Sonderdrucke und Industrie-gesponserte Beilagen in den Jahren 2005-2006 ausmachten.
Antworten erhielten sie nur vom BMJ und vom Lancet - JAMA, NEJM sowie die Archives bzw. Annals of Internal Medicine verweigerten die Informationen.
Das BMJ erzielte 16% seiner Einnahmen aus Anzeigen und 3% aus den 967.930 verkauften Sonderdrucken. Der Lancet erzielte 1% seiner Einnahmen aus Anzeigen und 41% aus 11.514.137 Sonderdrucken. Aufgrund öffentlich zugänglicher Daten berechneten die Autoren für das NEJM den Einnahmenanteil aus Anzeigen auf 23% sowie für die Archives und das JAMA den Anteil aus Anzeigen auf 53% und aus Sonderdrucken auf 12%.
Diese Studie bestätigt deutlich, worauf Richard Smith schon 2005 (und früher) hingewiesen hat: mit der Annahme oder Ablehnung einer Industrie-gesponserten Studie entscheidet ein Herausgeber sowohl über den Impact Factor seines Journals als auch über die Einnahme oder Nicht-Einnahme von sechs- bis siebenstelligen Dollarbeträgen.
Deutlicher kann ein Interessenkonflikt nicht sein. Für den Umgang mit diesen Interessenkonflikten bestehen bislang keine anerkannten Regeln. In einem begleitenden Editorial weist Harvey Marcovitch auf die langjährigen und intensiven Bemühungen der Herausgeber im Umgang mit Interessenkonflikten von Autoren hin. Als Paradox bezeichnet er den Umstand, dass ausgerechnet Fachzeitschriften, die an diesem Aspekt wissenschaftlicher Integrität Pionierarbeit geleistet haben (insbesondere JAMA und NEJM), Offenheit und Transparenz verweigern, wenn es um ihre eigenen Interessenkonflikte geht.
Marcia Angell, bis 2001 Herausgeberin des NEJM, hat im Jahr 2009 festgestellt: "It is simply no longer possible to believe much of the clinical research that is published, or to rely on the judgment of trusted physicians or authoritative medical guidelines. I take no pleasure in this conclusion, which I reached slowly and reluctantly over my two decades as an editor of TheNew England Journal of Medicine."
Entschiedene Schritte scheinen erforderlich, damit die medizinischen Fachzeitschriften ihre Glaubwürdigkeit wiedererlangen. Verzerrte Studienergebnisse führen zur Überschätzung des Nutzens und Unterschätzung des Schadens von Arzneimitteln - dies gefährdet Menschenleben, wie es sich zuletzt am Beispiel des Diabetes-Medikaments Avandia (Rosiglitazon) gezeigt hat (wir berichteten).
Lundh A, Barbateskovic M, Hrobjartsson A, Götzsche PC. Conflicts of Interest at Medical Journals: The Influence of Industry-Supported Randomised Trials on Journal Impact Factors and Revenue. A Cohort Study. PLoS Med 2010;7(10):e100035 Link zum Volltext
Richard Smith (2005). Medical journals are an extension of the marketing arm of pharmaceutical companies. PLoS Med 2005;2(5):e138. Link zum Volltext
Marcia Angell. Drug companies and doctors: A story of corruption. New York Review of Books 2009. Link zum Volltext
David Klemperer, 7.11.10
Ärzte und Pharmavertreter - eine verhängnisvolle Affäre
 Drei von vier Ärzten gehen davon aus, dass Pharmavertreter sie darin beeinflussen wollen, welche Medikamente sie verschreiben. Über 90% halten sich für völlig oder weitgehend immun gegenüber den Beeinflussungsversuchen - 9% der Befragten glauben, überhaupt nicht beeinflussbar zu sein, weitere 83% geben an, nur selten oder gelegentlich beeinflusst zu werden. Ihre Kollegen betrachten die Ärzte jedoch als beeinflussungsgefährdet: 21% glauben, dass diese den Beeinflussungsversuchen der Pharmavertreter häufig oder immer erliegen.
Drei von vier Ärzten gehen davon aus, dass Pharmavertreter sie darin beeinflussen wollen, welche Medikamente sie verschreiben. Über 90% halten sich für völlig oder weitgehend immun gegenüber den Beeinflussungsversuchen - 9% der Befragten glauben, überhaupt nicht beeinflussbar zu sein, weitere 83% geben an, nur selten oder gelegentlich beeinflusst zu werden. Ihre Kollegen betrachten die Ärzte jedoch als beeinflussungsgefährdet: 21% glauben, dass diese den Beeinflussungsversuchen der Pharmavertreter häufig oder immer erliegen.
Zu diesen und weiteren Ergebnissen gelangen Klaus Lieb und Simone Brandtönies in einer heute im Deutschen Ärzteblatt erschienen Studie. Die Ergebnisse beruhen auf einer Befragung von Fachärzten für Neurologie/Psychiatrie, Allgemeinmedizin und Kardiologie - den Facharztgruppen mit den höchsten Kosten für Arzneimittelverordnungen pro Arzt. Die Befragung wurde 2008 durchgeführt und bezieht sich auf das Jahr 2007.
Diese deutsche Studie bestätigt die Ergebnisse angloamerikanischer Studien: Ärzte meinen von sich selbst, nicht beeinflussbar zu sein, sehen das Problem aber bei ihren Kollegen. Nicht bekannt ist den Befragten offensichtlich, dass die Beeinflussung unbewusst erfolgt ("Marketing für Medikamente wirkt - selbst in subtiler Dosis").
Der Kontakt zwischen Industrie und Ärzten mittels der Vertreter funktioniert bestens. 77% der Befragten lassen sich mindestens 1x pro Woche besuchen, fast jeder 5. erhält täglich Besuch.
Fast die Hälfte der Befragten fühlt sich häufig oder immer adäquat und korrekt von den Pharmavertretern informiert, lediglich 15% selten oder nie. Dies erstaunt, denn bezüglich der Objektivität von Informationsquellen erhalten Pharmavertreter mit 4 die schlechteste (Schul-)Note. Pharmafinanzierten Fortbildungen geben Ärzte die Note 3, unabhängigen Fortbildungen 1,9 und Fachbüchern als am besten bewertete Quelle 1,8.
Die Mehrheit nimmt regelmäßig Geschenke an, und zwar im Durchschnitt pro Jahr: Arzneimuster 66 x, Schreibwaren 34 x, Kalender 9 x. Lediglich 4% nehmen keinerlei Geschenke an.
Durchschnittlich nahmen die Ärzte an 6,3 unabhängigen und 5,2 pharmafinanzierten Fortbildungen teil. Bei mehr als 2/3 der pharmafinanzierten Fortbildungen gab es kostenloses Essen, bei etwa einem Viertel kostenlose Übernachtung und Übernahme der Reisekosten.
43% führten 2007 mindestens eine Anwendungsbeobachtung durch, jeder 5. mehr als drei. Anwendungsbeobachtungen sind Studien, die anerkanntermaßen mehr dem Marketing als dem Wissensgewinn dienen ("Einflussnahme der Pharma-Industrie auf Medikamentenverschreibungen"".
Fazit der Autoren: "Eine kritischere Haltung der Ärzte gegenüber den Einflussversuchen der pharmazeutischen Unternehmen und die aktive Förderung alternativer Informationsangebote könnten zu mehr Unabhängigkeit und zu einer rationaleren und möglicherweise günstigeren Arzneimitteltherapie führen."
Diese Studie erweitert das Wissen um die Beeinflussung der Ärzte durch die Industrie. Erst kürzlich hatte das Deutsche Ärzteblatt eine Studie über die Beeinflussung der Ärzte durch manipulierte Studien veröffentlicht (wir berichteten).
Die unkritische Haltung vieler Ärzte mag auf den ersten Blick verwundern. Dahinter steht ein hochsystematisches und wissenschaftlich begründetes Vorgehen der Industrie. Sie lässt ihre Vertreter Beziehungen zu den Ärzten aufbauen, die von diesen als freundschaftlich wahrgenommen werden und wenden durch kleine und größere Geschenke die Reziprozitätsregel an, derzufolge man sich für Gefälligkeiten, Geschenke, Einladungen und dergleichen zu revanchieren hat (s.a. "Warum uneingeschränkte Transparenz in Interessenregistern und Ablehnung jedes Vorteils ein Muss für die ärztliche Profession ist").
Ein Aufsatz und ein Buch geben tiefe Einblicke in die Vorgehensweisen der Pharmavertreter:
Fugh-Berman A, Ahari S. Following the Script: How Drug Reps Make Friends and Influence Doctors. PLoS Medicine 2007;4(4):e150}
Williams J. Insider's Guide to the World of Pharmaceutical Sales, 9th Edition. 9th ed: Principle Publications, 2008. Dieses Buch wurde vor kurzem im Deutschen Ärzteblatt besprochen. Downnload
Die Ergebnisse der Überzeugungsbemühungen der pharmazeutischen Industrie sind nirgendwo besser dokumentiert als in den Umsatzzahlen.
So darf es sich die Industrie als "Erfolg" anrechnen, dass sich unter den 15 umsatzstärksten Medikamenten in Deutschland im Jahr 2007 nur 2 befinden, die nach Bewertung des Pharma-unabhängigen arznei-telegramm als Mittel der Wahl für das jeweilige Krankheitsbild darstellen. Unter den übrigen 13 sind 6 Varianten ohne besonderen Stellenwert (Scheininnovationen / Me-too-Präparate), 5 Medikament mit umstrittenem Therapieprinzip sowie 2 Medikamente die als Mittel der Reserve gelten.
Viele Ärzte verlieren offensichtlich unter dem Einfluss der Pharmavertreter die Fähigkeit zur medizinisch rationalen Verschreibung von Arzneimitteln.
Einen wahren Triumph des Marketings stellt der von der Firma Pfizer vertriebene Blutfettsenker LIPITOR® (in Deutschland SORTIS®) dar, das mit 13,3 Mrd. Dollar im Jahr 2009 weltweit umsatzstärkste Medikament (Quelle: IMS Health). Die Substanz Atorvastatin weist keinerlei Vorteile auf im Vergleich zur Standardsubstanz Simvastatin, ist jedoch in Deutschland um den Faktor 3 bis 4 teurer.
Wie Pfizer Patienten in den USA Lipitor® durch Werbung schmackhaft macht, zeigt diese Website www.lipitor.com ebenso wie die in den USA zulässige Direktwerbung im Fernsehen. Auf www.youtube.com wird man bei Eingabe von Lipitor fündig, hier ein Beispiel und hier noch eins.
Lieb K, Brandtönies S. Eine Befragung niedergelassener Fachärzte zum Umgang mit Pharmavertretern. Dtsch Arztebl 2010;107(22):392-8. Download
David Klemperer, 4.6.10
Unabhängige Arzneimittelforschung in Italien
 Die Erforschung von Arzneimitteln erfolgt überwiegend durch die pharmazeutische Industrie. Die Forschungsfragen der Industrie stehen weitgehend im Zusammenhang Gewinnerwartungen (siehe Beitrag im Forum).
Die Erforschung von Arzneimitteln erfolgt überwiegend durch die pharmazeutische Industrie. Die Forschungsfragen der Industrie stehen weitgehend im Zusammenhang Gewinnerwartungen (siehe Beitrag im Forum).
Öffentliche Förderung für nicht-kommerzielle Fragestellungen erfolgt bisher nicht annähernd im erforderlichen Umfang. Italien zeigt, dass es auch anders geht. Dort wurde die unabhängige Arzneimittelforschung im Jahr 2004 gesetzlich geregelt. Die Federführung hat die Arzneimittelbehörde Agenzia Italiana del Farmaco (AIFA) erhalten.
Das im Jahr 2005 gestartete unabhängige Arzneimittelforschungsprogramm (Website des Programms) wird das Programm durch einen Beitrag der pharmazeutischen Industrie finanziert. Alle Firmen zahlen 5% ihrer jährlichen Ausgaben für Werbung in einen nationalen Fonds. Zugrunde gelegt werden Werbemaßnahmen wie Geschenke, Anzeigen, Werbematerialien, Seminare, Kongresse, nicht jedoch die Gehälter der Pharmavertreter. Auf diese Weise flossen in den ersten drei Jahren (2005 bis 2007) jeweils etwa 45 Mio. Euro in den Fonds. Die Hälfte des Betrages dient der unabhängigen Forschung, mit der anderen Hälfte werden Arzneimittel zur Behandlung seltener Krankheiten (orphan drugs) finanziert.
Es erfolgt eine jährliche Ausschreibung für drei Bereiche:
•Arzneimittel für seltene Krankheiten
•vergleichende Studien (Head-to-head-Studien) - z.B. Untersuchung des Nutzen-Schaden-Profils von Arzneimitteln im direkten Vergleich in randomisierten kontrollierten Studien
•Angemessenheit des Gebrauchs, Pharmakovigilanz und Outcome-Forschung - Post Marketing Studien, Patientenedukation, systematische Übersichtsarbeiten (seit 2007)
Folgende Bedingungen gelten für die Förderung:
•Die Forscher müssen vollständige Kontrolle über das Studiendesign und die Durchführung der Studie haben (z.B. Studienprotokoll, Datenanalyse, Berichten der Ergebnisse).
•Die Ergebnisse müssen vollständig veröffentlicht werden.
•Die Studie darf nicht Teil des Zulassungsverfahrens sein.
Von 2005 bis 2007 wurden 1217 Anträge gestellt. Die Auswahl trifft eine international besetzte Kommission.
Letztlich wurden 151 Studien mit insgesamt 78 Mio. Euro gefördert:
•Experimentelle klinische Studien (114; 75%)
•Beobachtungsstudien (19, 13%)
•Edukative Interventionen (13, 9%)
•Systematische Übersichtsarbeiten (5; 3% - seit 2007)
Im frei zugänglichen Volltext des Aufsatzes werden eine Reihe geförderter Studien beschrieben.
Ihre Erfahrungen zusammenfassend stellen die Autoren fest, dass Geld eine notwendige aber nicht hinreichende Bedingung für unabhängige, an patientenrelevanten Fragestellungen ausgerichtete Forschung ist. Dies zeige sich in der geringen Zahl von Anträgen in einigen Fachgebieten - erwähnt werden hier Orthopädie und Anästhesie - und der teil unzureichenden Qualität von Anträgen. Erforderlich sei es, die unabhängige Arzneimittelforschung quantitativ und qualitativ zu verbessern. Gemeinschaftliche Anstrengungen auf europäischer Ebene seien wünschenswert.
Das Büro für Technikfolgenagschätzung hat die Rahmenbedingungen für unabhängige Arzneimittelforschung in einem Bericht für den Bundestag aufgearbeitet, der im Moment vom Bundestag bewertet wird und dann veröffentlicht werden soll.
Italian Medicines Agency Research & Development Working Group. Feasibility and challenges of independent research on drugs: the Italian Medicines Agency (AIFA) experience. Eur J Clin Invest 2010;40(1):69-6 Download Volltext
Biomedizinische Forschung überwiegend von finanziellen Gewinnerwartungen motiviert. Beitrag im Forum Gesundheitspolitik vom 12.2.2010 über die Studie von Dorsey et al. Funding of US Biomedical Research, 2003-2008. JAMA 2010;303(2):137-1. Abstract der Studie
Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag (TAB).
Klinische Forschungen in Deutschland unter besonderer Berücksichtigung nichtkommerzieller Studien. Website
David Klemperer, 13.5.10
Transparenz ist notwendig, damit die Industrie nicht auch in den nächsten drei Jahrzehnten manipuliert
 Die Versuchung durch Manipulation Studienergebnisse zu schönen, scheint übermächtig zu sein. Dies ist nachvollziehbar - vom Ausgang einer Arzneimittelstudie kann es abhängen, ob die untersuchte Substanz Milliardenumsätze erzielt oder auf dem Müllhaufen landet.
Die Versuchung durch Manipulation Studienergebnisse zu schönen, scheint übermächtig zu sein. Dies ist nachvollziehbar - vom Ausgang einer Arzneimittelstudie kann es abhängen, ob die untersuchte Substanz Milliardenumsätze erzielt oder auf dem Müllhaufen landet.
Eine kürzlich im Deutschen Ärzteblatt veröffentlichte systematische Übersichtsarbeit von Gisela Schott und weiteren Mitgliedern der Arzneimittelkommission der Deutsche Ärzteschaft belegt, dass die Industrie auch in der jüngeren Vergangenheit nicht widerstehen konnte. Erfasst und zusammengefasst wurden Studien von November 2002 bis Dezember 2009. Die Autoren knüpfen an die gleichartige systematische Übersichtsarbeit von Bekelman et al., die den Zeitraum von 1980 bis 2002 untersuchte und zu vergleichbaren Ergebnissen gelangte.
Somit ist festzustellen, dass seit 1980 bis heute Arzneimittelstudien, die von der Industrie finanziert werden oder bei denen ein Autor finanzielle Interessenkonflikte hat, durch Manipulationen häufiger zu positiven Ergebnisse gelangen, als anderweitig finanzierte Studien. Erwähnenswert ist der Sachverhalt, dass die Studie von Schott et al. von der Bundesärztekammer finanziert wurde.
In einem Editorial ("Arzneimittelforschung: Marketing vor Evidenz, Umsatz vor Sicherheit") im Deutschen Ärzteblatt stellt der Autor dieses Beitrags fest, dass sich die Arzneimittelforschung in einer Schieflage befinde. Pharmazeutische Firmen ließen Ärzte und Patienten häufig im Unklaren über die wahren Wirkungen ihrer Produkte - die Wissensgrundlage und Patienten Behandlungsentscheidungen treffen sei häufig verfälscht. Große pharmazeutische Firmen hätten in zahlreichen, durch interne Dokumente und Unterlagen gut dokumentierten Fällen die Evidenz verbogen, bis sie für das Marketing tauglich war.
Die Methoden, mit denen Studien manipuliert werden können, sind bekannt. In unserer Rubrik "Einflussnahme der Pharmaindustrie" berichten wir fortlaufend darüber. In jeder Phase der Untersuchung kann manipulativ auf das Ergebnis Einfluss genommen werden. Die Ergebnisse sind u.a. abhängig von der Fragestellung, der Studienpopulation, der Art und der Dosierung der Vergleichssubstanz, der Studiendauer. Häufig werden die Erfolgskriterien im Nachhinein verändert. Studien mit unpassenden Ergebnissen werden gar nicht veröffentlicht oder unpassende Ergebnisse innerhalb von Studien nicht veröffentlicht oder als positiv uminterpretiert. Der Zynismus, mit dem manche Industrievertreter hier vorgehen, ist durch die zwangsweise Veröffentlichung interner Dokumente im Rahmen von Gerichtsverfahren gut dokumentiert. Als Lektüre sei hier die Arbeit von Spielmans und Parry empfohlen.
Bislang müssen die Unterlagen, die zur Beurteilung einer Studie notwendig sind, nicht veröffentlicht werden. Dies ist eine notwendige Voraussetzung für Manipulationen. Studienregister sind zwar ein wichtiges Mittel gegen die Nicht-Veröffentlichung von Studien. Weitergehende Informationen, die erst eine umfassende Beurteilung einer Studie erlauben, sind im Studienplan und im Studienprotokoll enthalten. Deren frühzeitige Veröffentlichung - noch vor Beginn der Studie - würde die Betrugsmöglichkeiten entscheidend mindern. Uneingeschränkte Transparenz ist daher - das probate Gegenmittel und die an die Politik zu stellende Forderung. Darüber hinaus ist eine vermehrte öffentliche Studienfinanzierung erforderlich, schon allein weil die Industrie viele wichtige Fragen nicht untersucht. Hier ein Bericht über das italienische Modell der unabhängigen Studienfinanzierung.
Deutsches Ärzteblatt
Systematische Übersichtsarbeit zur Finanzierung von Arzneimittelstudien durch pharmazeutische Unternehmen
23.4.2010 Teil 1
Qualitative systematische Literaturübersicht zum Einfluss auf Studienergebnisse, -protokoll und -qualität
30.4.2010 Teil 2
Qualitative systematische Literaturübersicht zum Einfluss auf Autorschaft, Zugang zu Studiendaten sowie auf Studienregistrierung und Publikation
23.4.2010
Editorial. Arzneimittelforschung: Marketing vor Evidenz, Umsatz vor Sicherheit
Reaktionen auf die Studie von Schott et al. und das Editorial im Blog sozmad
Bekelman JE, Li Y, Gross CP. Scope and Impact of Financial Conflicts of Interest in Biomedical Research: A Systematic Review. Journal of the American Medical Association 2003;289(4):454-65. Download
Spielmans G, Parry P. From Evidence-based Medicine to Marketing-based Medicine: Evidence from Internal Industry Documents. Journal of Bioethical Inquiry 2010;7(1):13-29. Download, Beitrag im Forum Gesundheitspolitik.
David Klemperer, 11.5.10
Therapietreue - vorrangiges Ziel von Gesundheitsreformen
 Mit einem bedenkenswerten Leitartikel wendete die medizinische Fachzeitung New England Journal of Medicine - NEJM das Augenmerk auf ein Thema, das in der gesundheits- und reformpolitischen Debatte allenfalls eine untergeordnete Rolle spielt. Mangelhafte Therapietreue gilt unter Fachleuten als eins der großen Hindernisse auf dem Weg zu besseren Ergebnissen vor allem bei der zunehmenden Zahl chronisch kranker Menschen. Doch in der gesundheitspolitischen Debatte dominieren Fragen der Finanzierbarkeit und Versuche, die Nachfrage nach Gesundheitsleistungen einzudämmen, anstatt Bedarf mit nachweislichem Nutzen zu befriedigen. Der Aufhänger zu diesem Leitartikel ist denn auch - unschwer zu erkennen - die aktuelle Debatte über eine Reform des Gesundheitswesens in den USA, aber grundsätzlich lassen sich ihre Einschätzungen auch auf andere Industrieländer übertragen.
Mit einem bedenkenswerten Leitartikel wendete die medizinische Fachzeitung New England Journal of Medicine - NEJM das Augenmerk auf ein Thema, das in der gesundheits- und reformpolitischen Debatte allenfalls eine untergeordnete Rolle spielt. Mangelhafte Therapietreue gilt unter Fachleuten als eins der großen Hindernisse auf dem Weg zu besseren Ergebnissen vor allem bei der zunehmenden Zahl chronisch kranker Menschen. Doch in der gesundheitspolitischen Debatte dominieren Fragen der Finanzierbarkeit und Versuche, die Nachfrage nach Gesundheitsleistungen einzudämmen, anstatt Bedarf mit nachweislichem Nutzen zu befriedigen. Der Aufhänger zu diesem Leitartikel ist denn auch - unschwer zu erkennen - die aktuelle Debatte über eine Reform des Gesundheitswesens in den USA, aber grundsätzlich lassen sich ihre Einschätzungen auch auf andere Industrieländer übertragen.
Die Autoren David Cutler und Wendy Everett aus Harvard verweisen in ihrem Editorial auf einschlägige Forschungsergebnisse aus anerkannten Medizinerjournals, darunter ein bereits vor fünf Jahren erschienenes Review über zur Frage der Arzneimittel-Adherence, das ebenfalls im NEJM erschienen war und von dem für Nicht-Abonnenten nur das Extract kostenfrei zur Verfügung steht. Darim kamen Cutler und Everett zu der Erkenntnis: "Poor adherence to medication regimens is common, contributing to substantial worsening of disease, death, and increased health care costs. Practitioners should always look for poor adherence and can enhance adherence by emphasizing the value of a patient's regimen, making the regimen simple, and customizing the regimen to the patient's lifestyle. Asking patients nonjudgmentally about medication-taking behavior is a practical strategy for identifying poor adherence."
Für die Bedeutung der Therapietreue für den Gesundheitszustand und die Komplikationsrate bei chronischen Erkrankungen ist eine Untersuchung von besonderer Relevanz, die David Cutler gemeinsam mit Genia Long, Ernst Berndt, Jimmy Royer, Andrée-Anne Fournier, Alicia Sasser und Pierre Cremieux bereits 2007 in der us-amerikanischen Zeitschrift Health Affairs publiziert hatte. Durch den Vergleich von Survey-Daten ohne effiziente Blutdrucktherapie mit aktuellen Daten aus einer Längsschnittskohortenstudie ermittelten sie in einem dreistufigen Verfahren die Auswirkung des Blutdrucks auf die beiden Endpunkte Tod und kardiovaskuläre Ereignisse. Zunächst verglichen sie unter Berücksichtigung wesentlicher gesundheitsrelevanter Faktoren wie Body-Maß-Index, Alter, Geschlecht, Ethnie, Ernährungsgewohnheiten und dem Vorliegen von Stoffwechselerkrankungen die Daten aus dem National Health Examination Survey (NHES) 1959-62 mit denen des National Health and Nutrition Examination Survey (NHANES) 1999-2000, um den Blutdruck ohne effiziente Therapie zu abzuschätzen. Aus Längsschnittsdaten der Framingham-Heart Study ermittelten die Forscher die Auswirkungen effizienter Blutdruckbehandlung auf die Lebenserwartung, das Schlaganfall- und Herzinfarktrisiko sowie stationäre Behandlungen. Und schließlich rechneten sie die behandlungsbedingten Verbesserungen der Gesamtlebenserwartung auf der Grundlage von Literaturangaben in geldwerte Kosten um verglichen diese mit den Durchschnittsausgaben für Antihypertensiva.
Aufgrund ihrer Hochrechnungen kommen die Autoren zu der Einschätzung, dass im Jahr 2001 in den USA ohne antihypertensive Behandlung der durchschnittliche systolische und diastolische Blutdruck bei über 40-Jährigen 10 bzw. 13 % höher gelegen hätte und insgesamt etwa 86.000 zusätzliche vorzeitige Todesfälle aus kardiovaskulärer Ursache aufgetreten wären (37.295 bis 62.473 bei Männern und 25.876 bis 46.553 bei Frauen). Des Weiteren ermittelten die Forscher, dass im Verlauf des Jahres 2002 ohne effektive Blutdruckbehandlung zusätzlich 572.000 Patienten wegen Schlaganfällen (162.000 Männer, 410.000 Frauen) und 261.000 wegen Herzinfarkten (87.000 Männer, 174.000 Frauen) in stationäre Behandlung gekommen wären. Dies entspricht einer Senkung der Schlaganfall bedingten Krankenhausaufnahmen um 38 % und der Myokardinfarkt bedingten stationären Behandlungen um 25 % im Vergleich zu Hochrechnungen unter den Bedingungen unterlassener Hochdruckbehandlung.
Unter der Annahme, dass alle HypertonikerInnen wirksame Medikamente in richtiger Dosierung und Häufigkeit einnähmen, wären im gleichen Zeitraum in den USA weitere 89.000 vorzeitige kardiovaskuläre Todesfälle zu vermeiden gewesen. Konsequente antihypertensive Behandlung reduzierte die Gesamtsterblichkeit bei über 40-jährigen US-AmerikanerInnen um 4 % und die kardiovaskuläre Mortalität sogar um 9 %; die durchschnittliche Lebenserwartung für die Gesamtbevölkerung wäre ohne Blutdrucktherapie bei Männern 0,5 und bei Frauen 0,4 Jahre niedriger ausgefallen. Unter der Prämisse, dass ein zusätzliches gesundes Lebensjahr eines US-Bügers einen Wert von 90.000 Dollar hat, ergibt dies abzüglich der Behandlungskosten bei Männern einen "Gewinn" von 5.117 US-$ und bei Frauen von 3.454 US$. Die Kosten-Nutzen-Relation liegt demnach für Männer bei 10 zu 1 und für Frauen bei 6 zu 1. Bezieht man die vermiedenen stationären und anderen medizinischen Behandlungen auf Grund der geringeren Häufigkeit von Schlaganfällen und Herzinfarkten bei effektiv behandelten HypertonikerInnen in die Kalkulation ein, die sich für 2002 auf 10,7 bzw. 5,8 Milliarden US$ belaufen, fällt die Kosten-Nutzen-Analyse effektiver Blutdruckbehandlung noch positiver aus. Hier steht der Beitrag von David Cutler und Kollegen The value of antihypertensive drugs: a perspective on medical innovation aus Health Affairs kostenfrei zum Download zur Verfügung.
Doch nicht nur objektivierbare Verbesserungen klinischer Verläufe und geringere Sterblichkeit untermauern die große Bedeutung der Therapietreue vor allem bei chronisch Kranken. David Mosen, Julie Schmittdiel, Judith Hibbard, David Sobel, Carol Remmers, und Jim Bellows (2007) untersuchten die Auswirkungen von patientenseitigen Aktivierungsmaßnahmen (Patient Activating Measures -PAM) auf Therapieprozess und Adherence auf der einen sowie klinischem Verlauf und Patientenzufriedenheit auf der anderen Seite. Dieses federführend von der Professorin für Gesundheitspolitik an der Universität Oregon, Judith Hibbard, entwickelte 22- bzw. 13-teilige Messinstrument dient der Erfassung des Wissens, der Fähigkeiten und der Zuverlässigkeit des Selbstmanagements von Patienten. Nach Untersuchungen ihrer Arbeitsgruppe weist dieses Instrument geeignete psychometrische Eigenschaften auf, die eine Anwendung auf individueller Patientenebene zur Anpassung von Interventionen und Erfassung von Veränderungen erlauben. Zwei Artikel zu Patient Activating Measures erschienen unter anderem 2004 und 2005in Health Services Research); hier finden Sie die Abstracts der Beiträge Development of the Patient Activation Measure (PAM): Conceptualizing and Measuring Activation in Patients and Consumers und Development and Testing of a Short Form of the Patient Activation Measure.
Die Patientenbefragung mit 61,2-prozentigem Rücklauf zeigte, dass Patienten mit hohem Aktivierungsniveau nicht nur signifikant häufiger Verhaltensweisen im Sinne eines Selbstmanagements, sondern auch eine bessere Therapietreue an den Tag legten. Bei PatientInnen mit hohem PAM-Score lag die Adherence - definiert als maximal eine ausgelassene Tagesdosis pro Woche - bei 93.5 % und damit deutlich über den Vergleichswerten von Personen, die weniger auf Aktivierungsmaßnahmen reagierten. Die Zufriedenheit mit der Gesundheitsversorgung war bei "aktivierbaren" PatientInnen mit 69,3 % dreimal so hoch wie bei solchen mit dem niedrigsten PAM-Score 22,5" und der Anteil mit hoher subjektiver Lebensqualität mit 78,4 % mehr als doppelt so groß wie unter den schwer aktivierbaren Patienten (38,0 %). Damit waren die Wahrscheinlichkeit hoher Patientenzufriedenheit bei Personen mit hohem PAM-Wert zehn Mal und die hoher Lebensqualitätswerte 5 Mal so hoch wie bei Patienten mit niedrigem Aktivierungsniveau. Außerdem schätzten Personen mit hohem PAM-Wert ihre physische und mentale Leistungsfähigkeit signifikant höher ein.
Auf der Grundlage der vorliegenden Erkenntnisse ziehen Cutler und Everett vier Schlussfolgerungen, die auch für das deutsche und wohl die allermeisten anderen Gesundheitssysteme zutreffend sind, die Gesundheitsreformen aber regelmäßig entweder außer Acht lassen oder gar konterkarieren: Erstens gehört der Abbau finanzieller Zugangsbarrieren und insbesondere von Zuzahlungen zu den unabdingbaren Maßnahmen zur Verbesserung der Adherence; anderer herum können finanzielle Anreize oder Belohnungen sogar die Therapiereue fördern. Zweitens ist es erforderlich, die Möglichkeiten der Informationstechnologie im Gesundheitswesen vorrangig zur Verbesserung der Therapietreue anzuwenden, und zwar durch bessere Datenvernetzung und möglicherweise elektronische Erinnerungssysteme. Bemerkenswerterweise geht Cutler an dritter Stelle auf ein Thema ein, dessen Zusammenhang zur Adherence in manchen Augen überraschend erscheinen mag und in Teilen der niedergelassenen Ärzteschaft in Deutschland sicherlich auf Widerspruch stoßen wird, nämlich den Einfluss der Bezahlung der Behandler: Honorierungssysteme, die Leistungserbringer nicht ausschließlich nach erbrachten Leistungen, sondern auch entsprechend den Behandlungsergebnissen bezahlen und koordinierte Behandlungswege fördern, können entscheidend zur Verbesserung der Therapietreue beitragen; allerdings sollten die Performance-Indikatoren auch explizite Adherence-Ziele beinhalten. Und viertens empfiehlt David Cutler auf individueller Patientenseite die systematische Erfassung von Faktoren wie Depression oder Selbstmanagement-Problemen, um bei PatientInnen mit höherer Tendenz zur Nicht-Einhaltung von Therapievereinbarungen gezielte Maßnahmen zur Adherence-Verbesserung anzuwenden. "… these findings suggest that improved adherence will require changes in health care delivery, particularly in the area of primary care, along with continued investment in information-technology systems and new health plan designs that focus on achieving improved health outcomes."
Den Leitartikel Thinking Outside the Pillbox - Medication Adherence as a Priority for Health Care Reform aus dem New England Journal of Medicine 362 (17), S. 1533-1555, können Sie hier kostenfrei herunterladen.
Jens Holst, 11.5.10
Lehrstück "Rosiglitazone und Herzinfarktrisiko" zum Zweiten - Assoziation von finanziellen Interessenskonflikten und Bewertung.
 Über das lange vom Hersteller GlaxoSmithKline (GSK) totgeschwiegene aber schließlich doch öffentlich gewordene gesundheitliche Risiko (Herzinfarkt) des zur Behandlung von Diabeteskranken eingesetzten Wirkstoffs Rosiglitazone wurde hier bereits ausführlich berichtet. Wie dieses Verschweigen oder auch die Umdeutung von Wirklichkeiten abläuft und wer neben dem Hersteller mit welchen Methoden der Verbreitung der Wahrheit aktiv im Wege steht, dokumentiert jetzt ein systematischer Querschnitts-Review über mögliche Zusammenhänge zwischen finanziellen Interessen von publizierenden Wissenschaftlern und ihrer Position zu der Assoziation des Risikos eines Herzinfarkts und der Einnahme von Rosiglitazone im renommierten "British Medical Journal (BMJ)".
Über das lange vom Hersteller GlaxoSmithKline (GSK) totgeschwiegene aber schließlich doch öffentlich gewordene gesundheitliche Risiko (Herzinfarkt) des zur Behandlung von Diabeteskranken eingesetzten Wirkstoffs Rosiglitazone wurde hier bereits ausführlich berichtet. Wie dieses Verschweigen oder auch die Umdeutung von Wirklichkeiten abläuft und wer neben dem Hersteller mit welchen Methoden der Verbreitung der Wahrheit aktiv im Wege steht, dokumentiert jetzt ein systematischer Querschnitts-Review über mögliche Zusammenhänge zwischen finanziellen Interessen von publizierenden Wissenschaftlern und ihrer Position zu der Assoziation des Risikos eines Herzinfarkts und der Einnahme von Rosiglitazone im renommierten "British Medical Journal (BMJ)".
Die 202 Artikel, die sich bis zum April 2009 mit diesem Zusammenhang befassten, wurden danach klassifiziert, ob sie ausdrücklich und entschieden kein Risiko sahen (17% con 180 einzelnen AutorInnen), sich neutral verhielten (47% von den 180) oder dieses Risiko eindeutig benannten (36% von den 180). Jedem Aufsatz wurden alle veröffentlichten Kenntnisse über finanzielle Interessen der AutorInnen hinzugefügt, die sie selber in diesem und vorherigen Aufsätzen angegeben hatten. Die Reviewer, welche die Aufsätze klassifizierten wussten nichts von den AutorInnen oder ihren finanziellen Interessen.
Die Ergebnisse waren eindeutig und unerfreulich:
• Zunächst gab es lediglich in 53% der Aufsätze (108 Autoren) eine Erklärung über mögliche Interessenkonflikte. Nach der bisherigen Erkenntnisse über Interessenkonflikte müsste eigentlich jeder Autor daran interessiert sein, den Verdacht, etwas zu verschweigen, durch derartige Angaben zu entkräften - sofern dies möglich ist!!
• 90 Autoren oder 45% aller AutorInnen hatten nach ihren eigenen Angaben einen finanziellen Konflikt, d.h. z.B. von der Firma GSK oder einer anderen Pharmafirma Geld erhalten. 69% gaben dies bei dem speziellen Aufsatz an und beim Rest konnte dies nur durch weitere Recherchen in Erfahrung gebracht werden. Dies bedeutet, dass nur 18 AutorInnen, die Angaben machten, positiv sagten, sie hätten keine finanziellen Konflikte. Etwas spitzer formuliert könnte man aber auch sagen, dass nur rund 9% aller zum Thema Rosiglitazone publizierenden AutorInnen nach ihren eigenen Angaben ausdrücklich keine finanziellen Konflikte haben, die sich möglicherweise auf ihre Ergebnisse und Bewertungen auswirken könnten.
• Die Chance (Wahrscheinlichkeit), dass AutorInnen kein Risiko eines Herzinfarkts "feststellten" oder erwarteten war bei denjenigen von ihnen, die finanzielle Interessenkonflikte durch Beziehungen zu einem Hersteller von blutzuckersenkenden Arzneimitteln angaben, 3,4fach so hoch wie bei Autoren, die diese Konflikte nicht angaben. Hatten die Verfasser finanziellen Kontakt zu einem Hersteller des Wirkstoffs Rosiglitazone war die Chance eines "favourable view" auf die Wirkung sogar 4,3fach höher. Auch die Chance, die Arzneimittel mit diesem Wirkstoff sogar ausdrücklich zu empfehlen, war bei den AutorInnen mit finanziellen Konflikten der genannten Art um knapp das 4,7fache erhöht. Diese Tendenz verstärkte sich sogar noch in Meinungsartikeln (6,29fache) und in Artikeln, die sich gezielt auf die Kontroverse konzentrierten (6,5fache). Selbst als die us-amerikanische "Food and Drug Administration (FDA)" die ersten Sicherheitswarnungen zu Rosiglitazone veröffentlichte, sahen AutorInnen mit finanziellen Konflikten Rosiglitazone um das 3- bis 4fache positiver als ihre KollegInnen ohne derartige Konflikte.
• Wenn der Analyse nicht Autoren, sondern Aufsätze zugrundegelegt wurden, waren 86% der Artikel, die kein Risiko sahen, von AutorInnen geschrieben, die einen finanziellen Kontakt oder Konflikt mit GSK angegeben hatten. Dies war nur bei den AutorInnen von 18% aller Aufsätze der Fall, in denen das genannte Risiko für gesichert hielten.
Die Methodik des Reviews erlaubt zwar nicht, von einem kausalen Zusammenhang von finanziellen Interessen und Konflikten und der Bewertung des Nebenwirkungsrisikos von Rosiglitazone zu sprechen. Trotzdem ist den Verfassern zuzustimmen, dass sowohl der Anteil der AutorInnen, die keinerlei Angaben zu möglichen Interessenskonflikten machen, drastisch gesenkt werden muss als auch eine formelle Datenbasis für Interessenskonflikte geschaffen werden sollte. Nicht jedem Interessierten ist schließlich eine aufwändige Recherche in PubMed, Scopus oder Google zuzumuten.
Vielleicht ist es auch notwendig, deutlicher als bisher der Seriosität und Interessenkonfliktfreiheit von Ergebnissen aus Veröffentlichungen zu misstrauen, wenn keine Angabe zu möglichen Interessenkonflikten gemacht werden!?
Der Aufsatz "Association between industry affiliation and position on cardiovascular risk with rosiglitazone: cross sectional systematic review von
Amy T Wang, Christopher P McCoy, Mohammad Hassan Murad und Victor M Montori ist am 18.3.2010 online im "British Medical Journal" (BMJ 2010;340:c1344) veröffentlicht worden und komplett kostenlos erhältlich.
Bernard Braun, 20.4.10
Interne Dokumente der Pharma-Industrie: Marketing vor Wissenschaft
 Forschung sei die beste Medizin, propagiert der vfa (Wirtschaftsverband der forschenden Pharma-Unternehmen in Deutschland). Erkenntnisse aus internen Dokumenten der Industrie, die im Rahmen von Strafverfahren gegen pharmazeutische Unternehmen in den USA öffentlich geworden geben diesem Werbeslogan eine fast zynische Note.
Forschung sei die beste Medizin, propagiert der vfa (Wirtschaftsverband der forschenden Pharma-Unternehmen in Deutschland). Erkenntnisse aus internen Dokumenten der Industrie, die im Rahmen von Strafverfahren gegen pharmazeutische Unternehmen in den USA öffentlich geworden geben diesem Werbeslogan eine fast zynische Note.
Glen Spielmans und Peter Parry haben interne Dokumente der Firmen AstraZeneca, Pfizer, Smith Kline Beecham (heute GlaxoSmithKline) und Eli Lilly untersucht, die sich auf Studien zu Arzneimitteln gegen Depressionen und Psychosen und ihre Vermarktung beziehen. In den dargestellten Beispielen nutzen die pharmazeutischen Unternehmen die wissenschaftlichen Daten fĂĽr das Marketing, indem sie die Daten aus Studien marketinggerecht selektieren und interpretieren, ĂĽber Publikationsfirmen in die entsprechende Form bringen lassen und in hochrangigen Fachzeitschriften platzieren.
Ein Beispiel ist die antipsychotische Substanz Quetiapin, die von AstraZeneca als Seroquel® vermarktet wird. Unter der Standardsubstanz Haloperidol war bei Patienten mit Psychose in der Vorgeschichte, die zu Beginn der Studie symptomfrei waren, nach einem Jahr die Bewertung der psychotischen Symptome günstiger und das Risiko für erneute Psychosen geringer als unter Quetiapin. In den entscheidenden Endpunkten schnitt Haldol somit besser ab als Quetiapin. Einige Maße der kognitiven Funktion waren jedoch unter Quietapin günstiger. In einer Veröffentlichung stellte die Autoren die Verbesserung der kognitiven Funktion in den Mittelpunkt und ließen die antipsychotischen Endpunkte unter den Tisch fallen.
Ein weiteres Beispiel ist das Antidepressivum Paroxetin (Paxil®) der Firma GlaxoSmithKline, das für die Behandlung der Depression bei Jugendlichen als wirksam und gut verträglich beworben wurde. Tatsächlich hatten aber Studien für 2 primäre und 6 sekundäre Endpunkte negative Ergebnisse erbracht, d.h. die Substanz wirkte für keinen der 8 Parameter besser als Plazebo. In der veröffentlichten Studie berichteten die Autoren von 8 Ergebnismaßen, von denen 4 günstig dargestellt wurden - all diese Ergebnismaße waren jedoch im Studienprotokoll nicht erwähnt - ein klassischer Fall von "data fishing". Gravierende unerwünschte Wirkungen, wie vermehrte Suizidgedanken, vermehrte vorsätzliche Selbstschädigung sowie feindseliges Verhalten wurden nicht erwähnt. Somit hat GlaxoSmithKline eine Substanz ohne positive Effekte mit gravierenden negativen Effekten in einer Veröffentlichung in einer namhaften Fachzeitschrift als effektiv und gut verträglich bezeichnet.
Weitere Beispiele und Zitate belegen, dass große pharmazeutische Firmen den Anschein der evidenzbasierten Medizin in verfälschender Form für das Marketing ihrer Arzneimittel einsetzen. Dafür nutzen sie die großen Fachzeitschriften, deren Informationen viele Aerzte am meisten Vertrauen schenken.
Schon die wegweisende Studie von Turner et al. hatte offengelegt, dass das Verfälschen und Unterdrücken von Daten eine unter pharmazeutischen Firmen verbreitete Praxis ist und nicht etwa die Verfehlung weniger schwarzer Schafe: für jedes der 12 untersuchten Antidepressiva hat das jeweilige Unternehmen Daten geschönt oder unterdrückt, wenn sie nicht in das Marketingkonzept passten (wir berichteten).
Die Studie von Spielmans und Parry ist im Volltext abrufbar:
Spielmans, G. and P. Parry (2010). "From Evidence-based Medicine to Marketing-based Medicine: Evidence from Internal Industry Documents." Journal of Bioethical Inquiry. Download
Einige der internen Dokumente der Industrie sowie Powerpoint-Präsentationen dazu auf folgender Website:
HealthyScepticism
David Klemperer, 14.3.10
"An aspirin per day keeps ..." oder Lehrstück über den fragwürdigen Beitrag von Bayer Healthcare zur Gefäß-Primärprävention!
 "Heute wird Aspirin … fast allen Patienten gegeben, die bereits einen Herzinfarkt oder Schlaganfall hatten. Darüber hinaus wird Aspirin bei Patienten mit Durchblutungsstörungen an den Herzkranzgefäßen, nach Herzoperationen und bei Patienten, die erste Symptome von Mangeldurchblutungen im Gehirn hatten, eingesetzt. Viele Ärzte empfehlen auch anderen Patienten die Einnahme von Aspirin protect. Fragen Sie bitte Ihren Arzt oder Apotheker, ob eine regelmäßige Einnahme … für Sie sinnvoll ist." (aktuell vertriebene Praxisbroschüre "Rund ums Herz. Aspirin protect" der Firma Bayer Healthcare)
"Heute wird Aspirin … fast allen Patienten gegeben, die bereits einen Herzinfarkt oder Schlaganfall hatten. Darüber hinaus wird Aspirin bei Patienten mit Durchblutungsstörungen an den Herzkranzgefäßen, nach Herzoperationen und bei Patienten, die erste Symptome von Mangeldurchblutungen im Gehirn hatten, eingesetzt. Viele Ärzte empfehlen auch anderen Patienten die Einnahme von Aspirin protect. Fragen Sie bitte Ihren Arzt oder Apotheker, ob eine regelmäßige Einnahme … für Sie sinnvoll ist." (aktuell vertriebene Praxisbroschüre "Rund ums Herz. Aspirin protect" der Firma Bayer Healthcare)
Und wenn ein Arzt oder Apotheker sagen, dies sei sinnvoll, dann folgen viele herz-/kreislaufgesunde Menschen der Devise "an aspirin per day keeps conditions away" und die Firma "Bayer Healthcare" kann im Ernstfall immer sagen, sie habe niemals direkt eine tägliche Einnahme für Menschen ohne Vorerkrankung empfohlen oder gar einen primärpräventiven Nutzen versprochen.
Ist Bayer Healthcare also ein "ehrenwerter" Hersteller? Oder spricht dagegen nicht das Verschweigen der zahlreichen seit Mitte der 1990er Jahren immer wieder und zuletzt Mitte 2009 bestätigten Erkenntnisse über den vor allem bei der Primärprävention von schweren Herzkreislauf- oder anderen Gefäßerkrankungen geringen oder sogar mit unterschiedlich starken unerwünschten Effekten erkauften Nutzen von Aspirin in der zitierten, gezielt an Patienten gerichteten Broschüre?
Eine kleine aber relevante Auswahl der hier gemeinten und fast durchweg in renommierten peer-reviewten Fachzeitschriften erschienenen studienbasierten Erkenntnisse kann bei der Beantwortung hilfreich sein und zeigt u.a.:
• Personen, die ohne eine Herzerkrankungs-Vorgeschichte Aspirin mit primärpräventivem Ziel einnahmen, erhöhten nach einer Studie aus dem Jahr 2000 ("Consumption of NSAIDs and the development of congestive heart failure in elderly patients: an underrecognized public health problem" von Page J, Henry D. in der Fachzeitschrift "Archives of Internal Medicine" (2000;160:777-784) ihr Risiko für eine Herzgefäßerkrankung um 60%. Diejenigen Personen, die spezifisch vorerkrankt waren, erhöhten mit der Aspirineinnahme ihr Risiko einer Herzdurchblutungsstörung um das 10,5fache. Gesamtbewertung: "Assuming these relationships are causal, NSAIDs were responsible for approximately 19% of hospital admissions with CHF."
• Selbst wenn in der 2002 im "Archive for Internal Medicine" (2002;162:265-270) veröffentlichten und kostenlos erhältlichen "Rotterdam Study" ("Association of Nonsteroidal Anti-inflammatory Drugs With First Occurrence of Heart Failure and With Relapsing Heart Failure. The Rotterdam Study" von Johan Feenstra, Eibert R. Heerdink, Diederick E. Grobbee und Bruno H. Ch. Stricker kein Anstieg der Inzidenz von gefäßbedingtem Herzversagen nach Einnahme von Aspirin und pharmakologisch ähnlichen Wirkstoffen festgestellt werden konnte, trug das mit der regelmäßigen Einnahme solcher Arzneimittel assoziierte erheblich erhöhte Risiko von bereits am Herzen erkrankten Personen, einen Rückfall zu bekommen, nicht dazu bei, diese Wirkstoffe für hilfreich oder uneingeschränkt unschädlich erklären zu können.
• Auch das Risiko an anderen Krankheiten zu erkranken, war unter den Aspirin-EinnehmerInnen zum Teil erhöht. Das Risiko für Brustkrebs erhöhte sich beispielsweise nach der in der Fachzeitschrift "Journal of the National Cancer Institute (2005 97(11): 805-812) veröffentlichten Studie aus dem Jahr 2005 ("Nonsteroidal Anti-Inflammatory Drug Use and Breast Cancer Risk by Stage and Hormone Receptor Status" von Sarah F. Marshall, Leslie Bernstein, Hoda Anton-Culver, Dennis Deapen, Pamela L. Horn-Ross, Harvey Mohrenweiser, David Peel, Rich Pinder, David M. Purdie, Peggy Reynolds, Dan Stram, Dee West, William E. Wright, Argyrios Ziogas und Ronald K. Ross um 50%. Selbst wenn die AutorInnen einschränkend feststellen, hier handle es sich um keinen nachweisbar kausalen Zusammenhang, kann daraus nicht der Schluss gezogen werden, Aspirin wäre völlig harmlos und es sei überhaupt keine Zurückhaltung oder weitere Forschung angebracht.
• Bereits 1998 stellte ein im Medizinjournal "JAMA" (1998;280: 1930-1935) veröffentlichter Review mit Metaanalysen mehrerer RCTs ("Aspirin and Risk of Hemorrhagic Stroke: A Meta-analysis of Randomized Controlled Trials" von Jiang He; Paul K. Whelton; Brian V. und Michael J. Klag ein um 84% höheres Schlaganfallrisiko bei Personen fest, die täglich Aspirin einnahmen.
• 1998 quantifizierten die Verfasser einer Studie die schweren, unerwünschten Nebenwirkungen und das zusätzliche Mortalitätsrisiko der Einnahme so genannter nichtsteroidaler Antirheumatika (NSAR) und nichtsteroidale Antiphlogistika (NSAP) bzw. NSAID (non steroidal anti inflammatory drugs), zu deren häufigstem Wirkstoff Aspirin gehört, so: "Conservative calculations estimate that approximately 107,000 patients are hospitalized annually for nonsteroidal anti-inflammatory drug (NSAID)-related gastrointestinal (GI) complications and at least 16,500 NSAID-related deaths occur each year among arthritis patients alone." (Singh Gurkirpal [1998]: "Recent Considerations in Nonsteroidal Anti-Inflammatory Drug Gastropathy" in: The American Journal of Medicine, July 27, 1998: 31S). Über den Aufsatz gibt es kostenlos nur das Abstract.
• Ein Jahr später charakterisierten andere WissenschaftlerInnen zusammen mit Singh im "New England Journal of Medicine (NEJM)" (17. Juni 1999, Vol. 340, No. 24: 1888-1889) dieselben Nebenwirkungen der regelmäßigen Einnahme von Aspirin als eine "geräuschlose Epidemie". 75% der Menschen, die regelmäßig Aspirin einnehmen, kennen nach derselben Studie nicht die Gefahren des Gebrauchs dieses Schmerzmittels - und wahrscheinlich auch der anderer Analgetika. Zum Geschehen selber fassten sie ihre Ergebnisse so zusammen: "It has been estimated conservatively that 16,500 NSAID-related deaths occur among patients with rheumatoid arthritis or osteoarthritis every year in the United States. This figure is similar to the number of deaths from the acquired immunodeficiency syndrome and considerably greater than the number of deaths from multiple myeloma, asthma, cervical cancer, or Hodgkin's disease. If deaths from gastrointestinal toxic effects from NSAIDs were tabulated separately in the National Vital Statistics reports, these effects would constitute the 15th most common cause of death in the United States. … Furthermore the mortality statistics do not include deaths ascribed to the use of over-the-counter NSAIDS." (Wolfe M., Lichtenstein D.und Singh Gurkirpal [1999]: "Gastrointestinal Toxicity of Nonsteroidal Anti-inflammatory Drugs. Dass es sich dabei nur um die empirischen Effekte der verordneten Arzneimittel mit Wirkstoffen wie Acetylsalicylsäure (ASS) handelt, ist angesichts der Tatsache, dass weltweit der überwiegende Anteil der ASS-haltige Arzneimittel frei in der Apotheke gekauft wird, von hoher Brisanz. Von dem Aufsatz gibt es kostenlos leider nur einen Kurztext.
• 2005 veröffentlicht das private und bis in die jüngste Zeit hinein auch für das "Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)" gutachtende "Institut für evidenzbasierte Medizin" in Köln (dass es wegen dieser Unteraufträge an das u.a. der Frau von IQWIG-Leiter Sawicki gehörende Institut Debatten gab, ändert nichts an seiner fachlichen Qualität), also praktisch in Rufweite zum Bayer-Stammwerk in Leverkusen und in deutscher Sprache die kostenlos erhältliche, 27 Seiten umfassende Review-Studie "Acetylsalicylsäure in der Primärprophylaxe kardiovaskulärer Erkrankungen". Die Verfasser, Andreas Waltering, Lars Hemkens und Christiane Florack, untersuchen dazu die zum damaligen Zeitpunkt größten und qualitativ hochwertigen veröffentlichten Studien: British Male Doctors trial, Physicians´ Health Study, Thrombosis Prevention Trial, Hypertension Optimal Treatment Trial, Primary Prevention Project und Women s Health Study. Die im Einzelnen ebenfalls lesenswerten Ergebnisse fassen die Autoren u.a. so zusammen: "Die Primärprävention kardiovaskulärer Erkrankungen mittels Acetylsalicylsäure führt zu keiner Senkung der kardiovaskulären Mortalität oder der Gesamtmortalität. … Unter Therapie mit Acetylsalicylsäure treten signifikant häufiger schwere, vor allem gastrointestinale, Blutungsereignisse auf. Es muss von ca. 0,7 zusätzlichen ernsten Ereignissen pro 1000 Patientenjahre ausgegangen werden, … Eindeutige Subgruppen bezüglich kardiovaskulärer Risikofaktoren, die einen besonderen Nutzen durch eine Primärprophylaxe haben, lassen sich bis dato nicht identifizieren. Auch die Definition einer Risikoschwelle, ab der ein Patient in stärkerem Maße von einer Primärprophylaxe profitieren würde, ist anhand der vorliegenden Studien nicht möglich. Lediglich für Frauen im Alter von 65 Jahren scheint ein Nutzen auch bezüglich der Reduktion kardialer Ereignisse zu bestehen."
• Der 2008 im "European Journal of Heart Failure" (2008 10 (11): 1102-110) veröffentlichte Aufsatz "Non-steroidal anti-inflammatory drugs and cardiac failure: meta-analyses of observational studies and randomised controlled trials" von Paul A Scott, Gabrielle H. Kingsley und David L Scott, kommt nach der Analyse bzw. Metaanalyse der Ergebnisse von 5 Fall-Kontrollstudien, zwei Kohortenstudien, sechs placebo-kontrollierten Studien und sechs randomisierten kontrollierten Studien u.a. zu folgender Bewertung: "Observational studies and RCTs all show that NSAIDs (darunter wieder sehr häufig Aspirin bzw. sein Wirkstoff) increase the risk of cardiac failure. … Pre-existing cardiac failure increases risk." Auch wenn die Erhöhung des absoluten Risikos nicht so groß ist, empfehlen die ForscherInnen uneingeschränkt mehr Vorsicht bei der Einnahme derartiger Wirkstoffe.
Und am aktuellsten kam die international besetzte Wissenschaftlergruppe von Collins et al. in ihrem 2009 im britischen Fachjournal "The Lancet" (30. Mai 2009; 373 [9678]: 1849-60) veröffentlichten Aufsatz "Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials." auf der Basis von Metaanalysen mit Daten von sechs primärpräventiven und 16 sekundärpräventiven Studien mit Tausenden von Teilnehmern zu folgenden Schlussfolgerungen:
• Niedrige, regelmäßig und über lange Zeit eingenommene Dosen von Aspirin haben für viele Personen mit spezifischen Gefäßverschlusserkrankungen einen eindeutigen und bedeutenden sekundärpräventiven Nettonutzen. Die Einnahme kann spezifische Erkrankungs- bzw. Wiedererkrankungsrisiken maximal um ein Fünftel reduzieren.
• Auch in den primärpräventiven Studien wurde nach Collins et al. die Häufigkeit aller ernsthaften Gefäss-Erkrankungsereignisse unter den EinnehmerInnen von Aspirin hochsignifikant um 12% reduziert (jährlich 0,51% in der Aspirin- und 0,57% in der Kontrollgruppe; p=0,0001). Hierbei spielte aber die Verminderung der Häufigkeit nichttödlicher Herzinfarkte um rund 20% die größte Rolle.
• Der Nettoeffekt der Aspirineinnahme auf das Risiko, einen Schlaganfall zu erleiden, war so gering, dass es keinen statistisch signifikanten Unterschied zwischen Aspirin- und Kontrollgruppe gab.
• Die Sterblichkeit durch Gefäßerkrankungen unterschied sich zwischen beiden Gruppen ebenfalls nicht signifikant (0,10% versus 0,19% pro Jahr; p=0,7).
• Dem Allem steht das statistisch signifikant höhere Risiko schwerer Magen-Darm-Blutungen oder anderer Blutungen außerhalb des Schädels bei den meisten Angehörigen der Aspiringruppe gegenüber.
Sobald aber, wie bei der primärpräventiven regelmäßigen Einnahme von Aspirin, dem geringen oder gar fehlenden Nutzen eine deutliche Zunahme solch schwerer und wiederum folgenreicher Ereignisse wie innerer Blutungen gegenüber steht, muss dies sorgfältig gegeneinander abgewogen werden. Für Collins et al. kommt dabei zurückhaltend formuliert ein "uncertain net value" heraus, der gegen eine primärpräventive Einnahme spräche.
Angesichts dieser langjährigen Fülle von oftmals hochwertigen Reviews und Metaanalysen von RCTs über die unerwünschten und gefährlichen Folgen insbesondere der primärpräventiven Einnahme von Aspirin und verwandter Wirkstoffe durch herz-/kreislaufgesunde Personen ist das Verschanzen der Firma Bayer Healthcare hinter den "viele(n) Ärzte(n)", die genau dies angeblich auch empfehlen, kein Kavaliersdelikt mehr.
Dies umso weniger als die Firma im Ausland bereits mehrmals negative Erfahrungen mit Werbekampagnen gemacht hat, in denen sie die Wirkung von Aspirin aktiv übertrieben oder durch Verschweigen wichtiger Details den Eindruck erweckte, Aspirin sei ein "Wunder-" und Prophylaxemittel. Dies wurde ihr u.a. im Jahr 2000 in den USA und Mitte 2009 in Brasilien durch Regierungseinrichtungen verboten.
Obwohl eine ihr öffentlich "verordnete" Informationskampagne über die Risiken einer Dauereinnahme von Aspirin für Gesunde die Firma in den USA Millionen US-Dollar gekostet hat, hindert dies Bayer nicht daran, erneut und aktuell ein "Informations"-Angebot wie die Bayer/Aspirin-Website www.WonderDrug.com zu betreiben.
Auf ihr verschweigt oder verharmlost Bayer unter dem Motto "Expect Wonders" ("erwarte Wunder") erneut fast durchweg die bekannten spezifischen Nebenwirkungen des Präparats. So folgt der Ankündigung "Aspirin for the Heart. Aspirin has many uses and has been known as the miracle drug that works wonders" eine lange Aufzählung von tatsächlichen oder möglicherweise positiven Wirkungen bei allen möglichen Durchblutungserkrankungen. Der Sachstand zu den Grenzen und Risiken des Präparats wird keineswegs ergänzt, sondern lediglich mit dem Satz angedeutet: "Aspirin is not appropriate for everyone, so be sure to talk to your doctor before you begin an aspirin regimen." Und wenn der Arzt dann, warum auch immer, eine "Empfehlung" z.B. für den primärpräventiven Gebrauch gibt, schließt sich der profitable aber für Patienten riskante Kreis.
Ein wichtiger Nachtrag: Wohlwissend, dass der Aspirinwirkstoff ASS zu inneren Blutungen führt, verweist Bayer beruhigend auf sein Produkt "Aspirin protect", das es seit den 1990er Jahren auf dem Markt gibt. Diese Tabletten, so die Patientenbroschüre "lösen sich nicht im Magen, sondern erst im Dünndarm auf" und schonten damit wahrscheinlich die empfindliche Magenschleimhaut. Weniger zutreffend und vor allem nicht unumstritten ist der daraus gezogene Schluss "Aspirin protect" sei "auf Dauer gut verträglich" und könne also sorgenfrei eingenommen werden.
Ohne dies hier und vor allem mangels neuerer und hochwertiger Studien entscheiden zu können, sei der Hinweis erlaubt, dass das Nebenwirkungspotenzial von "Aspirin protect" seit Mitte der 1990er Jahre unterschiedlich bis offen kontrovers beurteilt wird:
• Eine 1996 in der Fachzeitschrift "Lancet" veröffentlichte Multicenter-Fallkontrollstudie "Risk of aspirin-associated major upper-gastrointestinal bleeding with enteric-coated or buffered product" von Kelly et. al. (348: 1413-1416) (komplett kostenlos erhältlich wenn man sich als Nutzer kostenlos und unaufwändig einträgt) kommen nach einer Zusammenfassung der Ergebnisse im "Deutschen Ärzteblatt" (94, Heft 43 vom 24. Oktober 1997, A-2834) zu dem unerwartet kritischen Ergebnis, dass "die als wesentlich nebenwirkungsärmer propagierten dünndarmlöslichen oder gepufferten Aspirinpräparationen nicht besser abschneiden als normales Aspirin, aber um das bis zu 20fache teurer sind." Verordnende Ärzte sollten sich also in Sachen Blutungen "nicht in einer falschen Sicherheit wiegen".
• Anders stellt dies ein im März 1998 wiederum im "Deutschen Ärzteblatt" (95, Heft 10, 6. März, A-551) redaktioneller Beitrag dar. Danach handle es sich nach Ansicht des Mathematikers Joachim Braun aus Königswinter bei den Ergebnissen von Kelly et al. um "statistische Artefakte". Außerdem belegten klinische Beobachtungsstudien "positive klinische Erfahrungen" mit Aspirin protect.
• 2006 veröffentlicht der Berliner Kliniker Harald Darius in der "Pharmazeutischen Zeitung" vom 22. August ausführlich Ergebnisse einer zweijährigen prospektiven Beobachtungsstudie, deren Kern bereits in der Überschrift verdeutlicht wird: "Anwendungsbeobachtung dokumentiert gute Verträglichkeit".
• Angesichts dieser gegensätzlichen Erkenntnissen aus mehr oder weniger aufwändig angelegten aber durchweg methodisch schwachen Fallkontroll- oder Kohortenstudien, gilt u.E. nachwievor eine 2001 im unabhängigen "arznei-telegramm" (Jg. 32, Nr.8: 81) gezogene Zwischenbilanz der Forschung: "Randomisierte Therapiestudien, die eine Senkung des Risikos peptischer Geschwüre, Blutungen oder Perforationen durch Aspirin protect insbesondere auch bei gefährdeten Patienten belegen, gibt es nicht. Nach Fallkontroll- und Kohortenstudien ist die Zubereitung nicht weniger riskant als übliche, bis zu 70% billigere ASS-Tabletten."
Wie man trotz dieses mittlerweile in so unterschiedlichen Publikationen wie dem "Arzneimittel-Kursbuch" der Stiftung Warentest oder einer Information zur "Optimierung der Pharmakotherapie" der Kassenärztlichen Vereinigung Westfallen-Lippe aus dem Jahr 2007 veröffentlichten Erkenntnis-Zwischenstands undifferenziert und Zuversicht verbreitend ein "auf Dauer gut verträglich" versprechen kann, ist wohl nur mit dem ökonomischen Interesse der Firma Bayer Healthcare zu erklären.
Bernard Braun, 6.2.10
Arzneimittel-Information: Deutsche haben ähnliche Vorbehalte gegenüber der Pharma-Industrie wie US-Bürger
 In einer Vielzahl von Studien wurden Arzneimittel-Informationen und insbesondere der Beipackzettel von Patienten als unverständlich und teilweise sogar angsteinflößend bewertet. Vor diesem Hintergrund will die EU-Kommission der pharmazeutischen Industrie erlauben, Informationen über verschreibungspflichtige Medikamente zu veröffentlichen. In einer repräsentativen Bevölkerungsumfrage hat sich jetzt allerdings gezeigt, dass die Bevölkerung diesem Vorhaben zumindest skeptisch gegenüber steht. Deutlich wurde darüber hinaus: Ähnlich wie in US-amerikanischen Umfragen ist auch in Deutschland das Vertrauen in die Pharma-Industrie nicht besonders hoch.
In einer Vielzahl von Studien wurden Arzneimittel-Informationen und insbesondere der Beipackzettel von Patienten als unverständlich und teilweise sogar angsteinflößend bewertet. Vor diesem Hintergrund will die EU-Kommission der pharmazeutischen Industrie erlauben, Informationen über verschreibungspflichtige Medikamente zu veröffentlichen. In einer repräsentativen Bevölkerungsumfrage hat sich jetzt allerdings gezeigt, dass die Bevölkerung diesem Vorhaben zumindest skeptisch gegenüber steht. Deutlich wurde darüber hinaus: Ähnlich wie in US-amerikanischen Umfragen ist auch in Deutschland das Vertrauen in die Pharma-Industrie nicht besonders hoch.
Der Bedarf an besseren Arzneimittel-Informationen ist groß. in der jetzt veröffentlichten Befragung des "Gesundheitsmonitor" der Bertelsmann-Stiftung zeigt sich: Verbesserungen beim gängigen und gewohnten Informationsmedium des Beipackzettels würden am häufigsten begrüßt: 98 Prozent halten dies für sehr wichtig oder wichtig. Ähnlich hohe Zustimmungsraten finden sich auch für andere Vorschläge wie "Arzneimittel-Tests einer unabhängigen Einrichtung wie Stiftung Warentest" (88%) oder eine vom Arzt ausgedruckte Arzneimittelinformation, in der persönliche Aspekte (Begleiterkrankungen, Lebensstil, Art der Informationswünsche usw.) berücksichtigt sind (81%). Auch der Vorschlag einer telefonischen Auskunftsstelle findet eine knappe Mehrheit.
Bei der Frage, wer diese Informationen bereit stellen solle, zeigt sich dann eine "markante Hierarchie der Vertrauenswürdigkeit". Nahezu uneingeschränktes Vertrauen (97%) genießt der eigene Arzt. Immerhin 75 Prozent schenken der Stiftung Warentest und den Verbraucherschutzorganisationen Vertrauen und knapp 50 Prozent Selbsthilfegruppen und Patientenorganisationen. Skepsis herrscht bei den meisten Befragten gegenüber Pharma-Unternehmen: Nur jeder vierte Befragte (26%) geht davon aus, dass Hersteller von Arzneimitteln zuverlässige und glaubwürdige Arzneimittel-Informationen bereitstellen könnten.
Von daher herrscht eine deutliche Skepsis vor, was die Objektivität solcher Arzneimittel-Informationen anbetrifft, die von Pharma-Unternehmen kommen. 78 Prozent der Befragten stellen dies in Frage, 32 Prozent davon sehr stark. Über drei Viertel der Bevölkerung sind der Meinung, dass Pharma-Unternehmen interessengebunden handelten und daher nicht objektiv und neutral über ihre Produkte berichteten. Die Befragten fühlen sich andererseits jedoch autark genug, um diese Interessenbindung zu durchschauen. Die allermeisten (86%) stimmen der Ansicht zu "Mündige Patienten sollten selbst entscheiden, wo und bei wem sie sich informieren."
Die Glaubwürdigkeit von Arzneimittel-Informationen hängt entscheidend von der Glaubwürdigkeit der Verfasser ab, so dass die Frage nahe liegt, wie es um das Image von pharmazeutischen Unternehmen in Deutschland bestellt ist. Diese Fragestellung ist durch den Gesundheitsmonitor jetzt erstmals in einer repräsentativen Bevölkerungsumfrage aufgegriffen worden. Dabei zeigt sich auch eine überraschend hohe Übereinstimmung der Urteile aus USA und Deutschland (vgl. Abbildung) 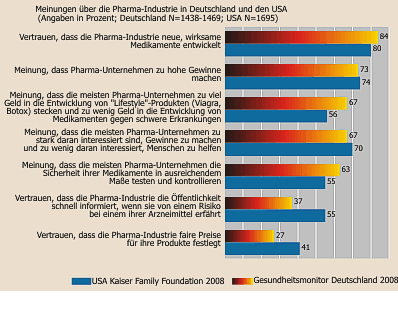
Das Image der pharmazeutischen Industrie hat einige positive Facetten, weist aber auch einige "hässliche Seiten" auf - hierzulande ähnlich wie jenseits des Atlantiks. Positiv hervorgehoben wird beispielsweise der innovative Beitrag der Pharma-Branche, die Entwicklung neuer und therapeutisch hilfreicher Medikamente. Diesen optimistischen Urteilen stehen jedoch verschiedene negative Bewertungen gegenüber. Dies betrifft die Höhe der Unternehmensgewinne, die Fairness der Preise oder auch die Schwerpunkte der Unternehmenspolitik. So meinen rund zwei Drittel, pharmazeutische Unternehmen seien zu stark daran interessiert, Gewinne zu machen und zu wenig daran interessiert, Menschen zu helfen. Genau so viele stimmen der Aussage zu "Die meisten Pharma-Unternehmen stecken zu viel Geld in die Entwicklung von "Lifestyle"-Produkten (Viagra, Botox) und zu wenig Geld in die Entwicklung von Medikamenten gegen schwere Erkrankungen".
Bemühungen zur Verbesserung der Arzneimittelinformation, so bilanzieren die Wissenschaftler, sind zweifellos sinnvoll. Es dürfe jedoch bezweifelt werden, dass der von der EU angestrebte Weg einer Aufhebung des Werbe- bzw. Informationsverbots für rezeptpflichtige Arzneimittel ein sinnvoller Beitrag ist. Auch Patienten und Verbraucher stellen in Frage, dass die Pharma-Unternehmen objektiv und neutral über ihre Produkte informieren würden. Das Image dieser Branche, so hat sich gezeigt, weist in Deutschland in ähnlicher Weise wie in den USA viele Negativfacetten auf. Nach Ansicht der Forscher gibt es andererseits schon sehr viel versprechende Möglichkeiten einer an Patienteninteressen orientierten Arzneimittel-Information. Diese Vorschläge werden abschließend kurz vorgestellt, etwa die von Computern erstellte und individualisierte Informationsbroschüre, die nach der Sprechstunde dem Patienten ausgehändigt wird oder die in einer US-Studie unlängst entwickelte "Drug Facts Box", ein "Kasten mit Arzneimittel-Fakten".
Die Studie ist hier kostenlos erhältlich: Gerd Marstedt, David Klemperer: Lesen Sie den Beipackzettel? Patientenwünsche zur Arzneimittelinformation (Gesundheitsmonitor, Newsletter 2/2009)
Gerd Marstedt, 4.8.09
Vorsicht vor Hinweisen auf "Studien"! Häufige Diskrepanz zwischen Werbeaussagen und "Studien"-Ergebnissen in Arzneimittelanzeigen
 Auch Arzneimittelhersteller wissen, dass PatientInnen wie ÄrztInnen Aussagen zu ihren Produkten eher glauben, wenn sie mit Hinweisen auf wissenschaftliche Studien versehen sind, welche die Wirksamkeit der Produkte nachweisen sollen. Wem hier angesichts der zahlreichen nachgewiesenen Manipulationen oder Fälschungen von Arzneimittelstudien durch die Pharmaindustrie der Gedanke an Falschinformationen durch den Kopf geht, ist nicht voreingenommen, sondern liegt ziemlich richtig. Dies trifft auch für die zu, die der Wirkkraft allgemein gehaltener und wenig sanktionierter gesetzlicher Verpflichtungen zum seriösen und wahrheitsgemäßen Marketing skeptisch gegenüber stehen. Konkret geht es um die Schweiz, in der 2002 explizite gesetzliche Bestimmungen für korrektes Marketingverhalten eingeführt wurde.
Auch Arzneimittelhersteller wissen, dass PatientInnen wie ÄrztInnen Aussagen zu ihren Produkten eher glauben, wenn sie mit Hinweisen auf wissenschaftliche Studien versehen sind, welche die Wirksamkeit der Produkte nachweisen sollen. Wem hier angesichts der zahlreichen nachgewiesenen Manipulationen oder Fälschungen von Arzneimittelstudien durch die Pharmaindustrie der Gedanke an Falschinformationen durch den Kopf geht, ist nicht voreingenommen, sondern liegt ziemlich richtig. Dies trifft auch für die zu, die der Wirkkraft allgemein gehaltener und wenig sanktionierter gesetzlicher Verpflichtungen zum seriösen und wahrheitsgemäßen Marketing skeptisch gegenüber stehen. Konkret geht es um die Schweiz, in der 2002 explizite gesetzliche Bestimmungen für korrektes Marketingverhalten eingeführt wurde.
Die mehrfache Skepsis stützt sich auf das Ergebnis einer Untersuchung von 577 Arzneimittelanzeigen für Arzneimittel gegen Schmerzen, Magen-Darm-Erkrankungen und psychische Erkrankungen, die 2005 in sechs großen schweizerischen medizinischen Fachzeitschriften erschienen sind. Der Anteil dieser Anzeigen an allen Arzneimittelanzeigen belief sich immerhin auf 28% (n=2.068), was gegen den möglichen Einwand spricht, bei den Ergebnissen handle es sich um absolute Randphänomene. In allen Anzeigen wurde mehr oder weniger umfangreich auf vorhandene wissenschaftliche Studien und Publikationen verwiesen, die die Werbeaussage stützen sollten.
Das Ergebnis sieht deutlich anders aus:
• In 56% (n=323) der 577 Anzeigen fand sich mindestens ein Literatur- oder Studienhinweis. Nachdem doppelte Anzeigen und Anzeigen mit letztlich völlig uninformativen Verweisen (trotzdem wurde aber zum Teil der Anschein erweckt, die Werbeaussage sei wissenschaftlich abgesichert) aussortiert wurden, blieben noch 29 Anzeigen mit 78 ausdrücklich durch Verweise abgesicherte Sachbehauptungen für die weitere Untersuchung übrig.
• In weniger als der Hälfte der Anzeigen bzw. der 78 Sachbehauptungen, nämlich 47% (n=37), stimmte die Werbeaussage mit den Inhalten der erwähnten Studien überein.
• Bei 21% der werblichen Sachbehauptungen (n=16) war die Aussage eindeutig falsch bzw. wurden die Leser unter der Annahme, dass die Verfasser die Literatur auf die sie verweisen gelesen haben, bewusst falsch informiert.
• Bei 32% (n=25) fördert der Vergleich von Werbeaussage und angegebener Literatur "einige Zweifel" an der Richtigkeit des Anzeigenversprechens. Dies lag hauptsächlich daran, dass in der Anzeige nur auf das Abstract der Studie verwiesen wurde bzw. nur die Zusammenfassung zitiert wurde. Dabei fielen dann auch Hinweise auf mögliche Verzerrungen oder extrem schwache Unterschiede zwischen dem untersuchten Arzneimittel und Kontrollpräparaten unter den Tisch. Außerdem wurde nur unzureichend über die Methodik der Studie berichtet, denn neben (methodisch fundierten) randomisierten Kontrollstudien finden sich auch einfache und wesentlich beweisschwächere Beobachtungs- oder Praxisstudien.
• Nach allem bisher Gesagten kann es nicht verwundern, dass Referenzstudien, in denen von den beteiligten Wissenschaftlern Interessenskonflikte genannt wurden oder die von Pharmaherstellern finanziert wurden, wesentlich häufiger die Werbeaussage unterstützten als Studien ohne diese beiden Charakteristika (RR 1.52, 95% CI 1.07-2.17 and RR 1.50, 95% CI 0.98-2.28).
Die Schweizer Autoren lassen in der Zusammenfassung ihrer Ergebnisse an praktischer Deutlichkeit nichts zu wünschen übrig: "Following the introduction of new regulations for drug advertisement in Switzerland, 53% of all assessed pharmaceutical claims published in major medical journals are not supported by the cited referenced studies or based on potentially biased study information. In light of the discrepancy between the new legislation and the endorsement of these regulations, physicians should not trust drug advertisement claims even when they seem to refer to scientific studies."
Die neunseitige Studie "Accuracy of drug advertisements in medical journals under new law regulating the marketing of pharmaceutical products in Switzerland" von Macarena Gonzalez Santiago, Heiner C Bucher und Alain J Nordmann, alles Mitarbeiter des "Instituts für klinische Epidemiologie und Biostatistik Basel (BICE)" in Basel, ist bereits 2008 in der Zeitschrift "BMC Medical Informatics and Decision Making 2008, 8:61 doi:10.1186/1472-6947-8-61" erschienen und komplett kostenlos erhältlich.
Geradezu mustergültig ist bei dem Aufsatz über die Studie die lückenlose Dokumentation der Begutachtung des zuerst eingereichten Textes durch namentlich genannte Fachgutachter, der zustimmenden oder ablehnenden Kommentare der Forscher bis hin zu der dann veröffentlichten Variante.
Auch diese so genannte "Pre-publication history" erhält man komplett und kostenlos auf einer Website.
Bernard Braun, 30.6.09
Arzneimittelhersteller behindert die bestmögliche Behandlung von Patienten mit Depression
 Mehr als andere findet das Pharmaunternehmen Pfizer immer mal wieder den Weg in die Öffentlichkeit, und meistens sprechen die Schlagzeilen nicht für das US-Unternehmen. Im jüngsten Fall geht es um das Antidepressivum Reboxetin mit dem Handelsnamen Edronax®. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) mit Sitz in Köln wirft dem Pharmahersteller vor, Informationen und Daten über die Wirkung dieses Medikaments zu verschweigen. Nach Angaben des IQWIG, das im Auftrag des gemeinsamen Bundesausschusse (g-BA) vom 22. Februar 2005 die Wirksamkeit dreier neuer Antidepressiva bewerten sollte, weigerte sich Pfizer trotz wiederholter Bitte, eine vollständige Aufstellung sämtlicher veröffentlichter und unveröffentlichter Studien zu Reboxetin zur Verfügung zu stellen. Nach Recherchen des IQWIG erfolgte die Testung dieses in Deutschland zugelassenen Arzneimittels in mindestens 16 Studien an etwa 4600 PatientInnen, die an Depressionen leiden. Allerdings fehlen von 9 dieser 16 Studien Schlüsselinformationen zur Beurteilung von Reboxetin, und dem IQWIG stehen bisher nur Daten von ca. 1.600 ProbandInnen zur Verfügung.
Mehr als andere findet das Pharmaunternehmen Pfizer immer mal wieder den Weg in die Öffentlichkeit, und meistens sprechen die Schlagzeilen nicht für das US-Unternehmen. Im jüngsten Fall geht es um das Antidepressivum Reboxetin mit dem Handelsnamen Edronax®. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) mit Sitz in Köln wirft dem Pharmahersteller vor, Informationen und Daten über die Wirkung dieses Medikaments zu verschweigen. Nach Angaben des IQWIG, das im Auftrag des gemeinsamen Bundesausschusse (g-BA) vom 22. Februar 2005 die Wirksamkeit dreier neuer Antidepressiva bewerten sollte, weigerte sich Pfizer trotz wiederholter Bitte, eine vollständige Aufstellung sämtlicher veröffentlichter und unveröffentlichter Studien zu Reboxetin zur Verfügung zu stellen. Nach Recherchen des IQWIG erfolgte die Testung dieses in Deutschland zugelassenen Arzneimittels in mindestens 16 Studien an etwa 4600 PatientInnen, die an Depressionen leiden. Allerdings fehlen von 9 dieser 16 Studien Schlüsselinformationen zur Beurteilung von Reboxetin, und dem IQWIG stehen bisher nur Daten von ca. 1.600 ProbandInnen zur Verfügung.
Ohne Einbeziehung der unveröffentlichten Daten ist keine zuverlässige Einschätzung der Studienlage möglich und es besteht die große Gefahr, den Nutzen und Schaden des Medikaments falsch einzuschätzen. Pfizer hat dem IQWiG keinerlei Begründung für die Weigerung genannt, die Studien offen zu legen. "Durch das Verschweigen von Studiendaten nimmt der Hersteller Patienten und Ärzten die Möglichkeit, sich informiert zwischen verschiedenen Therapieoptionen zu entscheiden", sagt Peter Sawicki, Leiter des IQWiG, und kritisiert die Behinderung Arbeit seines und anderer unabhängiger Institutionen. Das IQWIG, dessen Ziel es ist, verlässliche Aussagen über Vor- und Nachteile von Arzneimitteln zu treffen, sieht aufgrund dieser Situation vorläufig keinen Hinweis auf einen Nutzen einer Behandlung mit Reboxetin.
Zu diesem Fall wandte sich das IQWIG mit dem Vorwurf Pfizer hält Studien unter Verschluss mit einer Pressemitteilung an die Öffentlichkeit. Von dem Instituts-Vorbericht über die Nutzenbewertung einer Behandlung mit Bupropion, Mirtazapin oder Reboxetin bei der Behandlung der akuten Phase der Depression, bei der Erhaltungstherapie (Rückfallprävention) und bei der Rezidivprophylaxe ist auch eine vorab veröffentlichte Kurzfassung im Netz verfügbar. Die Auseinandersetzung zwischen dem IQWIG und Pfizer stieß in der deutschen Fach- und Laienpresse auf großes Interesse. So berichten das Deutsche Ärzteblatt und die Berliner Zeitung ausführlich und an prominenter Stelle über den Vorfall.
Dieses jüngste Beispiel ist allem Anschein nach ein weiterer Beleg für den lange bekannten Publikations-Bias in der medizinischen und pharmakologischen Fachliteratur. Insbesondere so genannte negative Studien, die nicht die erwünschte Wirksamkeit oder Überlegenheit eines Arzneimittels belegen können, haben erheblich größere Hürden zu überwinden, um in renommierten Journals zu erscheinen. Da eine Veröffentlichung vielfach erst mit großer Verzögerung oder gar nicht erfolgt, erhalten ÄrztInnen und PatientInnen ein geschöntes Bild. Immer wieder zeigt sich, dass publizierte Literatur die Wirkungen von Medikamenten zu überschätzen pflegt, und für einige Wirkstoffe ist sogar jedweder Nutzen fraglich.
Auch der 112. Ärztetag vom 19.-22. Mai 2009 in Mainz machte sich die Forderung nach industrie-unabhängiger Forschung zu eigen, wie das Deutsche Ärzteblatt in seiner Ausgabe vom 29.5.2009 berichtet. Dankenswerterweise stellt der in dieser Sache engagierte Verein Demokratischer Ärztinnen und Ärzte (vdää) auf seiner Homepage auch einen einschlägigen Untersuchungsbericht der Arzneimittelkommission der Deutschen Ärzteschaft zum Der Einfluss der pharmazeutischen Industrie auf die wissenschaftlichen Ergebnisse und die Publikation von Arzneimittelstudien kostenlos zum Download zur Verfügung. Darin kommt der federführende Autor, der Mainzer Ordinarius Professor Klaus Lieb, zu einem ernüchternden Fazit: "Zurzeit besteht also die inakzeptable Situation, dass Publikationen von Studienergebnissen, bei denen die pharmazeutische Industrie beteiligt war, den Leser den therapeutischen Nutzen eines Arzneimittels überschätzen lassen. Diese Fehleinschätzung beschränkt sich nicht auf den einzelnen Arzt, da auch Leitlinien, z. B. von medizinischen Fachgesellschaften, auf der Basis von veröffentlichten Studienergebnissen erarbeitet werden und die verzerrte Wahrnehmung der Wirksamkeit und Unbedenklichkeit eines Arzneimittels zu fehlerhaften Empfehlungen führen kann. Dies wirkt sich auf die Versorgung des einzelnen Patienten und über eine verzerrte Einschätzung von Kosten und Nutzen auf das gesamte Gesundheitswesen aus."
Die Ursache dieser verbreiteten Problematik liegt zu einem nicht unerheblichen Teil daran, dass heutzutage die meisten medizinisch-pharmazeutische Studien nicht in unabhängigen Institutionen, sondern auf Veranlassung und vor allem mit Finanzierung der Hersteller möglich sind. Eine im New England Journal of Medicine (NEJM) veröffentlichte, Untersuchung über die selektive Publikation von Studienergebnissen über Antidepressiva bestätigt insbesondere für Industrie-gesponserte Untersuchungen einen unübersehbaren Hang zur Veröffentlichung positiver, also erwarteter Studienergebnisse. Bei der Beurteilung der Ursachen führen die Autoren mehrere Gründe an, bei den Konsequenzen ist ihr Fazit aber eindeutig: "We cannot determine whether the bias observed resulted from a failure to submit manuscripts on the part of authors and sponsors, from decisions by journal editors and reviewers not to publish, or both. Selective reporting of clinical trial results may have adverse consequences for researchers, study participants, health care professionals, and patients." Löblicherweise steht die sehr lesenswerte Studie Selective Publication of Antidepressant Trials and Its Influence on Apparent Efficacy kostenlos als Volltext auf der Website des NEJM zum Download zur Verfügung.
Erschwerend kommen wirtschaftliche Verflechtungen wichtiger Verlagshäuser mit interessierten Kreisen der Gesundheitswirtschaft hinzu. Eine erkleckliche Zahl wissenschaftlicher Veröffentlichungen stammt aus der Feder von Marketingfirmen. Das Forum Gesundheitspolitik hatte bereits Anfang Oktober 2007 auf das Thema des Ghost Management" der Pharmaindustrie hingewiesen. In ihrer Ausgabe vom 5. Mai macht die Fachzeitschrift Annals of Internal Medicine auf die vielfach unzureichende Qualität von Presseinformationen wissenschaftlicher Institutionen aufmerksam. Erwähnenswert und aufschlussreich ist in diesem Zusammenhang auch eine Untersuchung über die Öffentlichkeitsarbeit wissenschaftlicher Institutionen, die oftmals von ebenso unübersehbarem wie unkritischen Eigeninteresse geleitet ist und an Objektivität zu wünschen übrig lässt. Der Artikel Press Releases by Academic Medical Centers: Not So Academic, der als Volltext kostenfrei im Internet zur Verfügung steht, verweist auf die unzureichende Qualität und Verständlichkeit der Verlautbarungen von Wissenschaftlern. Ihre Fazit ist ernüchternd: "Press releases issued by 20 academic medical centers frequently promoted preliminary research or inherently limited human studies without providing basic details or cautions needed to judge the meaning, relevance, or validity of the science."
Nicht nur die pharmazeutische Industrie versucht sich üblicherweise durch Selbstverpflichtungen von allzu starkem gesellschaftlichem Druck zu befreien. So hatte auch das IQWiG bereits 2005 mit dem Verband forschender Arzneimittelhersteller (VFA) eine grundsätzliche Einigung zur Übergabe aller zur Bewertung erforderlichen Daten vereinbart und die internationalen Verbände der pharmazeutischen Industrie hatten sich im Januar 2005 zur Offenlegung von Informationen zu klinischen Studien verpflichtet. Nicht nur das jüngste Beispiel von Pfizer und seinem Antidepressivum Reboxetin zeigt, dass freiwillige Lösungen nicht ausreichen. Auch andere Firmen lehnten es in den letzten Jahren wiederholt ab, dem IQWIG Studienunterlagen zur Verfügung zu stellen, die es für die Nutzenbewertung von Arzneimitteln benötigte. Diese Daten sind zudem vielfach gar nicht in den Studienregistern enthalten, deren Aufbau in den letzten Jahren den Überblick über laufende Untersuchungen erleichtern und das Verschweigen erschweren sollte.
Der Fall Pfizer ist ebenso wie viele andere im Übrigen auch eine Angelegenheit für VerbraucherschützerInnen und PatientenvertreterInnen. Mit dem Verschweigen und Vorenthalten von Studiendaten und -ergebnissen verstoßen die Hersteller nämlich auch gegen Absprachen mit den StudienteilnehmerInnen. Schließlich stellen sich die ProbandInnen freiwillig und uneigennützig mit dem Ziel zur Verfügung, durch ihre Teilnahme und die Veröffentlichung der Ergebnisse anderen Erkrankten zu helfen.
Hier finden die LeserInnen des Forum Gesundheitspolitik den ausführlichen Vorbericht des IQWIG.
Jens Holst, 12.6.09
Marketing für Medikamente wirkt - selbst in subtiler Dosis
 Als starke Marke etablierte Produkte sind stärker im Bewusstsein verankert und den Käufern gegenwärtiger als konkurrierende Produkte. Bei der Wahl zwischen zwei oder mehr Produkten kann sich dies unbewusst auf die Kaufentscheidung auswirken. In einer amerikanischen Studie wurde jetzt untersucht, ob sich dieses Prinzip auf den Medikamentenbereich übertragen lässt.
Als starke Marke etablierte Produkte sind stärker im Bewusstsein verankert und den Käufern gegenwärtiger als konkurrierende Produkte. Bei der Wahl zwischen zwei oder mehr Produkten kann sich dies unbewusst auf die Kaufentscheidung auswirken. In einer amerikanischen Studie wurde jetzt untersucht, ob sich dieses Prinzip auf den Medikamentenbereich übertragen lässt.
Die Hypothesen der Forscher lauteten:
1. Medizinstudenten, die einem Objekt ausgesetzt sind, das Werbung für eine Marke trägt, zeigen eine positivere Haltung gegenüber dem Produkt durch die Bahnung positiver Assoziationen als Medizinstudenten einer Vergleichsgruppe.
2. Die restriktive Politik einer Universität in Bezug auf pharmazeutisches Marketing mindert diesen Effekt durch die erhöhte Sensibilität für die Beeinflussungstaktiken.
Zur Beantwortung dieser Frage führten die Forscher eine randomisierte kontrollierte Studie durch. 352 Medizinstudenten im 3. und 4 Studienjahr aus zwei Universitäten wurden nach dem Zufallsprinzip in zwei Gruppen eingeteilt. Eine der Universitäten (University of Pennsylvania School of Medicine) verfolgt einen restriktiven Umgang mit Pharmavertretern. Geschenke, Mahlzeiten und Medikamentenmuster sind verboten. Die andere Universität (University of Miami Miller School of Medicine) lässt diese Marketingbemühungen zu.
Die Studenten kannten den eigentlichen Zweck der Studie nicht, sie wussten nur, dass es um klinische Entscheidungsfindung ging.
Alle Studenten mussten einige schriftliche Angaben auf einem Notizbogen machen und anschließend den Implicit Association Test (s.u.) am Computer durchführen. Die Exposition bestand darin, dass auf dem Notizbogen einer der beiden Gruppen der Name und das Logo des Blutfettsenker Lipitor® (in Deutschland Sortis®, Substanz: Atorvastatin) angebracht war, ebenso auf dem Klemmbrett, auf dem der Notizbogen befestigt war. In der Kontrollgruppe waren Klemmbrett und Notizpapier neutral.
In dem Test ging es um den Vergleich von Lipitor® mit dem Konkurrenzprodukt Zocor® (Substanz: Simvastatin) einem medizinisch zumindest gleichwertigen Blutfettsenker.
Der Implicit Association Test (IAT) misst unbewusste Haltungen und Bewertungen. Der IAT ist in der psychologischen Forschung und im Marketing weit verbreitet. Aufgabe des Probanden ist es, Objekten Merkmale zuzuordnen, ohne dabei Bedenkzeit zu haben. Der Vergleich der Reaktionszeiten bei der Zuordnung von Merkmalen zu zwei zu vergleichenden Objekten erlaubt Rückschlüsse über die implizite Haltung des Probanden. Beispiele für den IAT finden sich auf einer Website der Harvard University.
Die explizite Haltung der Studenten wurde mit einem Fragebogen erfasst, auf dem sie Lipitor® und Zocor® nach mehreren Dimensionen bewerteten
Die Tests zeigten, dass alle Studenten Lipitor® positiver bewerteten als Zocor®, also auch die Studenten der Kontrollgruppe. Unterschiede ergaben sich zwischen den beiden Universitäten. In Miami (wenig restriktiv bezüglich Pharma-Marketing) zeigten die exponierten Studenten eine stärkere Bevorzugung von Lipitor als die Kontrollen. In Penn (restriktiv bezüglich Pharma-Marketing ) hingegen zeigten die exponierten Studenten eine geringere Bevorzugung als die Kontrollstudenten.
Die Studie zeigt, dass bereits eine subtile Werbung für ein Medikament wirksam ist. In einem Umfeld, dass die gängigen Methoden des Pharmamarketings zulässt, wird die positive Bewertung eines Medikaments verstärkt. Sind Geschenke und gesponserte Mahlzeiten verboten, kehrt sich der Effekt um - die positive Bewertung wird abgeschwächt.
Die Rahmenbedingungen wirken sich offensichtlich stark darauf aus, wie Studenten das Marketing der Industrie einschätzen. In Miami (nicht restriktiv) halten 86% der Studenten Industrie-gesponserte Veranstaltungen für hilfreich und fortbildend, in Penn (restriktiv) 52%. In Miami verneinen 67%, dass Geschenke sie bei der Verschreibung von Medikamenten zugunsten des Produkts der schenkenden Firma beeinflussen könnten, in Penn 29%.
Diese Studie bestätigt und erweitert das vorhandene Wissen darum, wie Ärzte von der Industrie beeinflusst werden. Das Besondere an dieser Studie ist die Untersuchung einer eher schwachen Exposition (Anblick des Namens und Logos eines Medikaments) und der Nachweis der Auswirkung auf die implizite, also eher unbewusste Bewertung. Weiterhin ist hervorzuheben, dass die Auswirkung der Exposition gegensätzlich war, je nach Umfeld. Ein Pharmamarketing-freundliches Umfeld verbessert und ein kritisches Umfeld verschlechtert die Bewertung eines Medikaments.
Fazit aus dieser Studie sollte sein, werbende Einflüsse auf Ärzte so weit wie möglich zu unterbinden, damit sie ihren Patienten die besten und nicht die am stärksten beworbenen Medikamente verordnen. Ein Blick auf die umsatzstärksten Medikamente in Deutschland zeigt, dass Ärzte häufig stark beworbene Medikamente verordnen, auch wenn gleichwertige, teils sogar überlegene Medikamente zur Verfügung stehen, die stets preiswerter sind. Unter den 15 umsatzstärksten Medikamenten befinden sich 6 Präparate, die als Variante ohne besonderen Stellenwert und 5 Präparate, die als umstrittene Mittel bewertet werden.
GRANDE, D., FROSCH, D. L., PERKINS, A. W. & KAHN, B. E. (2009) Effect of Exposure to Small Pharmaceutical Promotional Items on Treatment Preferences. Arch Intern Med, 169, 887-893. Abstract der Studie
ARZNEI-TELEGRAMM (2008) 1997 und 2007 im Vergleich - die umsatzstärksten Arzneimittel. Arznei-telegramm, 39, 65-66. Tabelle
David Klemperer, 14.5.09
Bessere Medikamenteninformationen für Laien - die Drug Facts Box
 Eine neue Studie zeigt, dass es möglich ist, Laien ein realistisches Bild über die erwünschten und unerwünschten Wirkungen von Medikamenten zu vermitteln. Die Studie stammt aus den USA, in der die Direktwerbung für verschreibungspflichtige Medikamente seit 1997 erlaubt ist - wir berichteten mehrfach in der Rubrik "Einflussnahme der Pharma-Industrie".
Eine neue Studie zeigt, dass es möglich ist, Laien ein realistisches Bild über die erwünschten und unerwünschten Wirkungen von Medikamenten zu vermitteln. Die Studie stammt aus den USA, in der die Direktwerbung für verschreibungspflichtige Medikamente seit 1997 erlaubt ist - wir berichteten mehrfach in der Rubrik "Einflussnahme der Pharma-Industrie".
Die Vorgaben der Food and Drug Administration stellen bislang nicht sicher, dass die Anzeigen grundlegende Informationen über den möglichen Nutzen und Schaden eines Medikaments enthalten. Hier setzen Lisa Schwartz und Kollegen mit der sog. Drug Facts Box ("Medikamenten-Tatsachen-Box") an. Dabei handelt es sich um eine zusammenfassende schriftliche Information über ein Medikament im Umfang einer Seite. Darin werden zum einen Basisinformationen wie Indikation und Kontraindikation verbal beschrieben. Zum anderen werden quantitative Informationen zu erwünschten und unterwünschten Wirkungen in einer dreispaltigen Tabelle in Form des absoluten Risikos vermittelt.
Eine vorherige Studie an nicht-repräsentativ ausgewählten Teilnehmern hatte eine hohe Verständlichkeit sowohl für den Textteil als auch für die numerische Tabelle ergeben. (vgl.: Lisa M. Schwartz et al: The Drug Facts Box: Providing Consumers with Simple Tabular Data on Drug Benefit and Harm Medical Decision Making 27;5:655-662). Hervorzuheben sind die positiven Effekte auf alle Bildungsschichten - auch die Gruppe mit der niedrigsten Bildung profitierte deutlich von der Intervention.
Eine neue Studie untersuchte die Wirksamkeit der Drug Facts Box an einer repräsentativen Bevölkerungsstichprobe Englisch sprechender Erwachsener im Alter von 35 bis 70 Jahren. Die Wirksamkeit wurde anhand der Entscheidung für oder gegen ein Medikament sowie an einem genauen Verständnis der erwünschten und unerwünschten Wirkungen gemessen.
Die Gesamtstudie ist in zwei randomisierte kontrollierte Studien aufgeteilt. In einer der Teilstudien ("Symptomstudie") ging es um zwei Medikamente zur Symptomlinderung, einen sog. H2-Blocker und einen Protonenpumpenhemmer gegen Sodbrennen, in der anderen ("Präventionsstudie") um zwei präventiv wirkende Medikamente, ein sog. Statin zur Blutfettsenkung und Clodipogrel zur Blutverdünnung.
Nach telefonischer Kontaktaufnahme erhielten die Probanden per Post zwei Anzeigen, einen Fragebogen und einen Freiumschlag. Die Kontrollgruppe erhielt ein Blatt mit der Anzeige auf der Vorderseite und den behördlich vorgeschriebenen Informationen auf der Rückseite. Die Interventionsgruppe erhielt ebenfalls die Anzeige, auf der Rückseite jedoch die Drug Facts Box. Auf Seite 1 dieses Downloads ist die Anzeige für Statine zu sehen, auf Seite 2 die behördlich geforderten Informationen und auf Seite 3 die Drug Facts Box.
Zusammenfassend ergab die Studie, dass die Drug Facts Box im Vergleich zur Standardinformation das Wissen um die erwünschten und unerwünschten Wirkungen der Medikamente deutlich verbessert, überhöhte Erwartungen an den Nutzen werden korrigiert, ebenso aber auch unzutreffend hohe Einschätzungen bezüglich möglicher Schäden. Auch entschieden sich sehr viel mehr Probanden für das bessere der zwei Medikamente gegen Sodbrennen.
Im Folgenden einige Ergebnisse im Einzelnen.
Gebrauchstauglichkeit und Verständlichkeit der Drug Facts Box
In der Symptomstudie bewerteten 68% die Informationen als leicht auffindbar, in der Präventionsstudie 71%. Die Informationen seien leicht zu verstehen, bejahten 52% bzw. 69%. 79% in beiden Gruppen fanden die Faktenbox sehr wichtig.
Entscheidung für das bessere von zwei Medikamenten
In der Drug Facts Box-Gruppe kamen 80% zu dem zutreffenden Ergebnis, dass Protonenpumpenhemmer gegen Sodbrennen sehr viel effektiver sind als H2-Blocker, in der Kontrollgruppe 38%.
Verständnis der unerwünschten Wirkungen
Die Drug Facts Box führt zu eine geringeren Bewertung der unerwünschten Wirkungen. 92% der Drug Facts Box-Gruppe schätzten die unerwünschten Wirkungen des H2-Blockers als gering ein, in der Kontrollgruppe nur 42%. Beim Protonenpumpenhemmer lauten die Zahlen 85% in der Interventionsgruppe und 37% in der Kontrollgruppe.
In der Präventionsstudie beantworteten 51% die Fragen nach der Art der unerwünschten Wirkungen korrekt, in der Kontrollgruppe 16%. Die unerwünschten Wirkungen wurden auch hier von der Interventionsgruppe geringer eingeschätzt.
Verständnis des Nutzens
Bei H2-Blockern gaben 16% der Drug Facts Box-Gruppe an, der Nutzen sei sehr hoch, in der Kontrollgruppe 46%. Den Protonenpumpenhemmer bewerteten 73% der Drug Facts Box-Gruppe als sehr wirksam, aber nur 53% in der Kontrollgruppe. Die Drug Facts Box-Gruppe hat somit die bessere Wirksamkeit der Protonenpumpenhemmer im Vergleich zu den H2-Blockern besser verstanden.
In der Präventionsstudie gaben in der Drug Facts Box-Gruppe 72% den zutreffenden Wert für die absolute Risikoreduktion durch Statine an, in der Kontrollgruppe 9%. Für Clodipogrel lauten die Zahlen 74% bzw. 7%. In der Kontrollgruppe überschätzen bei dem Statin 65% und bei Clodipogrel 53% den Nutzen um den Faktor 10 oder mehr.
Die Drug Facts Box führt zu einer etwas zurückhaltenderen Gesamtbeurteilung. 72% in der Drug Facts Box-Gruppe schätzen die erwünschten Wirkungen des Statins höher als die unerwünschten, in der Kontrollgruppe sind es 86%; die entsprechenden Zahlen für Clodipogrel lauten 49% und 59%.
Kostenloser Volltext der Studie: Schwartz LM, Woloshin S, Welch HG (2009). Communicating Drug Benefits and Harms With a Drug Facts Box: Two Randomized Trials (Ann Intern Med 2009;150:563-4)
David Klemperer, 24.4.09
Desinformation mit gesundheitlichem Risiko durch "sponsored links" der Pharmaindustrie in Suchergebnissen zur Krankheitsbehandlung
 Ein wichtiges Argument gegen die Ausdehnung von mehr Direktwerbung der Pharmafirmen für Patienten und die Forderung nach unabhängigen Informationsangeboten war und ist das Risiko von lückenhafter oder fehlerhafter Information durch die vorrangig an einem hohen Umsatz und Gewinn interessierten Hersteller. Dem widerspricht die Pharmaindustrie im Allgemeinen vehement, räumt die gelegentliche Existenz "schwarzer Schafe" ein, die aber dank brancheneigener Ethikcodes Einzelfälle blieben oder schnell verschwänden.
Ein wichtiges Argument gegen die Ausdehnung von mehr Direktwerbung der Pharmafirmen für Patienten und die Forderung nach unabhängigen Informationsangeboten war und ist das Risiko von lückenhafter oder fehlerhafter Information durch die vorrangig an einem hohen Umsatz und Gewinn interessierten Hersteller. Dem widerspricht die Pharmaindustrie im Allgemeinen vehement, räumt die gelegentliche Existenz "schwarzer Schafe" ein, die aber dank brancheneigener Ethikcodes Einzelfälle blieben oder schnell verschwänden.
Dass genau dieser Selbstreinigungsprozess selbst bei klaren inhaltlichen staatlichen Vorschriften nicht immer funktioniert und dann, wenn man ihnen die nötigen Freiheiten lässt, auch gleich bei einer ganzen Herde großer Schafe und "Leithammel" nicht, zeigen amtliche Briefe der US-"Food and Drug Administration (FDA)" an 14 der größten us-amerikanischen und internationalen Pharmaunternehmen am US-Markt.
In allen Fällen geht es darum, dass die Firmen in den USA für eine Reihe ihrer Präparate im Internet kurze Werbebeiträge bzw. so genannte "sponsored links" veröffentlichen können, auf die Informationssuchende stoßen, wenn sie mit einer Suchmaschine nach Informationen zu einer Erkrankung suchen. Wenn die Ratsuchenden dann den "short internet ad" gelesen haben, können sie von dort auch meist auf die Produkt-Webseiten gelangen.
Nach Ansicht der FDA, welche die Werbeauftritte der Pharmafirmen systematisch überwacht und überprüft, sind diese so genannten "sponsored links" geeignet Patienten irrezuführen, weil sie in den inkriminierten Fällen keinerlei Informationen über die möglichen und im Detail auch durch amtliche Warnhinweise erhärteten gesundheitlichen Risiken der beworbenen Medikamente enthielten(vor den Risiken von 19 der 48 der Medikamente, deren Auftritt als "sponsored link" von der FDA untersucht wurden, hatte die FDA mit ihrem härtesten Instrument gegen unerwünschte Nebenwirkungen gewarnt, einer "black box"-Warnung).
Eine genaue Auflistung darüber wann, wo und bei welchem Produkt derartige Desinformationen festgestellt wurden, erhielten u.a. die Firmen Biogen Idec, Sanofi Aventis, GlaxoSmithKline, Johnson & Johnson, Novartis, Merck, Eli Lilly, Roche Holding und natürlich auch Pharmafirmen mit deutscher Mutter wie Bayer Healthcare Pharmaceuticals und Boehringer-Ingelheim Pharmaceuticals - kurz so ziemlich alle bedeutenden Arzneimittelhersteller dieser Welt.
An Auszügen aus drei der Briefe lassen sich einige der von den FDA-Kontrolleuren monierten Vorgehensweisen der Industrie genauer erkennen:
• In dem hier zur Veranschaulichung des Charakters dieser Briefe etwas ausführlicher zitierte FDA-Brief an die Firma Sanofi Aventis geht es um Plavix, ein so genanntes Block-Buster-Präparat dieses Weltkonzerns, dessen Wirkstoff Clopidogrel die Blutgerinnung und damit eine gefährliche Blutverklumpung hemmt: "As part of its routine monitoring and surveillance program, the Division of Drug Marketing, Advertising, and Communications (DDMAC) of the U.S. Food and Drug Administration (FDA) has reviewed three sponsored links [US.CLO.08.02.035 (BMS#264US08PM115), US.CLO.08.02.036 (BMS#264US08PM116), US.CLO.08.02.037 (BMS#264US08PM117)] for PLAVIX (clopidogrel bisulfate) Tablets (Plavix) submitted by sanofi-aventis U.S. LLC (Sanofi) under cover of Form FDA- 2253. The sponsored links cited in this letter are misleading because they make representations and/or suggestions about the efficacy of PLAVIX, but fail to communicate any risk information associated with the use of this drug. The links also fail to use the required established name. Thus, the sponsored links misbrand the drug in violation of the Federal Food, Drug, and Cosmetic Act (the Act) and FDA implementing regulations. See 21 U.S.C. 352(a) & (n), 321(n); 21 CFR 201.10(g)(1), 202.1(b)(1), (e)(3)(i) & (e)(6)(i)." Und: "These sponsored links make representations and/or suggestions about the efficacy of PLAVIX, but fail to communicate any risk information. For promotional materials to be truthful and non-misleading, they must contain risk information in each part as necessary to qualify any claims made about the drug. By omitting the most serious and frequently occurring risks associated with PLAVIX, the sponsored links misleadingly suggest that PLAVIX is safer than has been demonstrated."
• Die Firma GlaxoSmithKline verstieß gleich bei einer Fülle ihrer führenden Mittel gegen FDA-Vorschriften, nämlich bei "AVANDIA (rosiglitazone maleate) Tablets (Avandia), AVANDAMET (rosiglitazone maleate and metformin hydrochloride) Tablets (Avandamet), AVANDARYL (rosiglitazone maleate and glimepiride) Tablets (Avandaryl), AVODART (dutasteride) Soft Gelatin Tablets (Avodart), COREG CR (carvedilol phosphate) Extended-release Capsules (Coreg CR), and TYKERB (lapatinib) Tablets (Tykerb)."
• In ihrem Brief an GlaxoSmithKline ging die FDA auch auf das mögliche entlastende Argument ein, es stünde ja jedem Leser einer Google- oder Yahoo-Recherche frei, auf den verlinkten Produktseiten in den dort umfänglich dokumentierten Unterlagen die ganze Wahrheit über diese Mittel zu erfahren und verwirft eine solche Argumentation von vornherein: "We note that these sponsored links contain a link to the products' websites. However, this is insufficient to mitigate the misleading omission of risk information from these promotional materials."
• Auch die Firma Bayer verstieß nach Ansicht der FDA klar gegen die Gebote einer verantwortungsvollen Informationspolitik und zwar bei ihren weit verbreiteten Mitteln Levitra, Yaz und Mirena, die u.a. bei erektiler Dysfunktion und als Antibabypille wirken sollen. Die problematischen Informationsmängel stellt die FDA bei einem der Mittel, der Antibabypille YAZ, folgendermaßen im Detail dar: "Inadequate Communication of Indication/Overstatement of Efficacy. The sponsored link for YAZ provides a very brief statement about what the drug is for; however, this statement is incomplete and misleading, suggesting that YAZ is useful in a broader range of conditions or patients than has been demonstrated by substantial evidence or substantial clinical experience. Specifically, the sponsored link for YAZ misleadingly broadens the indication for YAZ by implying that all patients with moderate acne are candidates for YAZ therapy ("YAZ® Prevents Pregnancy, May Help Moderate Acne and PMDD"), when this is not the case. Rather, YAZ's indication is limited to the treatment of moderate acne vulgaris in women at least 14 years of age who have achieved menarche, and it should be used for the treatment of acne only if the patient desires an oral contraceptive for birth control."
Die Briefe sind sämtlich, zusammen mit vielen anderen aus den früheren Jahren stammenden, oft ähnlich interessanten und nur selten geschwärzten Briefen, vom CDER Freedom of Electronic Information Office auf der Website der FDA "Warning Letters and Untitled Letters to Pharmaceutical Companies" faksimiliert veröffentlicht und frei zugänglich.
Da die Briefe zum Teil kurze Antwortfristen enthalten (9.4.2009) und auch darauf hinweisen, dass die FDA nicht sämtliche "sponsored links" der Firmen untersucht habe, die Firmen dies aber nachholen sollen, gibt es erste Antworten. So nimmt die Sprecherin der Firma Biogen Idec die Vorwürfe "very seriously" und verspricht mit der FDA zu kooperieren. Selbst wenn sich alle anderen Empfänger ähnlich äußern, bleibt die Frage, warum es erst solch massiver Interventionen bedarf, um die Firmen von Mindeststandards einer seriösen Arzneimittelinformation oder der Nutzung solider Informationen gegenüber Patienten zu überzeugen.
Bernard Braun, 6.4.09
US-Studie bei Darmkrebs-Patienten zeigt: Der "informierte" Patient verlangt besonders teure Medikamente
 Die endgültige Entscheidung über die Zulassung direkter Informationen für Patienten über rezeptpflichtige Medikamente ist noch nicht gefallen, auch wenn die EU-Kommissare im Dezember 2008 dazu einen Richtlinien-Vorschlag verabschiedet haben. (vgl. EU-Parlament muss über Werbung für rezeptpflichtige Arzneimittel entscheiden) Insbesondere Günter Verheugen, für Unternehmens- und Industriepolitik zuständiger Vizepräsident der EU-Kommission, hatte sich für eine Erlaubnis stark gemacht, um die Wettbewerbsfähigkeit der europäischen Pharmaindustrie zu fördern. Eine Studie aus den USA, wo Direktwerbung auch für rezeptpflichtige Medikamente erlaubt ist, hat nun gezeigt, dass diese Art der Information möglicherweise eine Stärkung der Pharma-Umsätze bewirkt. Aber sie kann auch dazu führen, dass Patienten nach den teuersten Arzneimittel verlangen und sie auch verschrieben bekommen, obwohl diese nicht unbedingt optimal für ihre Therapie sind. Eine stärkere Wettbewerbsfähigkeit der Pharma-Industrie in der EU würde dann zugleich eine finanzielle Schwächung der nationalen Gesundheitssysteme mit sich bringen.
Die endgültige Entscheidung über die Zulassung direkter Informationen für Patienten über rezeptpflichtige Medikamente ist noch nicht gefallen, auch wenn die EU-Kommissare im Dezember 2008 dazu einen Richtlinien-Vorschlag verabschiedet haben. (vgl. EU-Parlament muss über Werbung für rezeptpflichtige Arzneimittel entscheiden) Insbesondere Günter Verheugen, für Unternehmens- und Industriepolitik zuständiger Vizepräsident der EU-Kommission, hatte sich für eine Erlaubnis stark gemacht, um die Wettbewerbsfähigkeit der europäischen Pharmaindustrie zu fördern. Eine Studie aus den USA, wo Direktwerbung auch für rezeptpflichtige Medikamente erlaubt ist, hat nun gezeigt, dass diese Art der Information möglicherweise eine Stärkung der Pharma-Umsätze bewirkt. Aber sie kann auch dazu führen, dass Patienten nach den teuersten Arzneimittel verlangen und sie auch verschrieben bekommen, obwohl diese nicht unbedingt optimal für ihre Therapie sind. Eine stärkere Wettbewerbsfähigkeit der Pharma-Industrie in der EU würde dann zugleich eine finanzielle Schwächung der nationalen Gesundheitssysteme mit sich bringen.
Was hat das Forschungsteam aus Boston und Philadelphia herausgefunden? In einem Satz zusammengefasst heißt die Erkenntnis ihrer Studie, die jetzt in der Zeitschrift "Cancer" online vorab veröffentlicht wurde: Patienten mit Darmkrebs, die sich besonders gut und umfassend über ihre Krankheit informieren, nehmen sehr viel häufiger als andere, gesundheitlich weniger interessierte Darmkrebs-Patienten solche Medikamente ein, die zwar überdurchschnittlich teuer sind, aber für ihre spezifische Art der Erkrankung nicht unbedingt die beste Therapie darstellen.
Die Wissenschaftler hatten insgesamt 633 Patienten mit Darmkrebs näher untersucht und nach ihren Informationsgewohnheiten zu gesundheitlichen Fragen und ihrer Erkrankung befragt. Je nachdem, wie viele verschiedene Informationsquellen sie benutzt hatten (Ärzte, Internet, Selbsthilfegruppen, Zeitschriften usw.) wurde ihr Suchverhalten als stark oder schwach ausgeprägt eingestuft. Darüber hinaus wurden sie befragt, ob sie schon von bestimmten Medikamenten gehört hätten oder diese sogar einnehmen würden. Dabei handelte es sich um zwei Medikamente (Wirkstoff Bevacizumab, US-Handelsname "Avastin" und Wirkstoff Cetuximab, US-Handelsname "Erbitux") die nach den Leitlinien der amerikanischen Zulassungsbehörde U.S. Food and Drug Administration für Darmkrebserkrankungen im fortgeschrittenen Stadium empfohlen werden, für Tumore in einem frühen Stadium jedoch nicht die Arzneimittel erster Wahl sind. Zwar sind sie gesundheitlich nicht unbedingt problematisch, aber ihre Kosten liegen weit über dem Durchschnitt anderer Medikamente.
In der Analyse der erfragten Daten fanden die Wissenschaftler dann heraus: Patienten, die besonders detailliert über ihre Krankheit informiert sind, also viele Informations-Quellen genutzt haben, kennen die beiden teuren Medikamente 2,8mal so oft wie andere Patienten und nehmen sie 3,3mal so oft ein. Die beiden Medikamente werden empfohlen in fortgeschrittenem Stadium der Erkrankung, wenn sich Metastasen auch außerhalb des Darms gebildet haben. Bei der großen Mehrheit der Untersuchungsgruppe (84%) war dies allerdings nicht der Fall. Würde man nur Bevacizumab zur Therapie von Darmkrebs verwenden, so schreiben die Wissenschaftler in ihrem Artikel, so würde dies allein jährliche Kosten in Höhe von 1,5 Milliarden US-Dollar verursachen, die im Gesundheitssystem für andere Aufgaben verloren gehen.
Die Forscher beschäftigen sich in der Diskussion ihrer Befunde nicht mit der Frage der Direktwerbung für rezeptpflichtige Medikamente ("direct to consumer advertising" DTCA), die außer in den USA derzeit nur in Neuseeland erlaubt ist. Deutlich wird jedoch auch so aus ihrer Studie: Die an Patienten gerichtete Arzneimittelwerbung oder Arzneimittelinformation für rezeptpflichtige Medikamente durch Pharma-Unternehmen bringt ein Umsatzplus nicht unbedingt für die besten, sondern für die teuersten und gewinnträchtigsten Produkte.
Abstract der Studie: Stacy W. Gray u.a.: Colon cancer patient information seeking and the adoption of targeted therapy for on-label and off-label indications (Cancer, Early Online: 23 Feb 2009, doi 10.1002/cncr.24186)
Gerd Marstedt, 24.2.09
EU-Parlament muss über Werbung für rezeptpflichtige Arzneimittel entscheiden
 Am 10. Dezember 2008 verabschiedeten die EU-Kommissare einen Richtlinien-Vorschlag zum so genannten Arzneimittelpaket. Auch wenn das Werbeverbot für rezeptpflichtige Arzneimittel formell erhalten bleibt, wird es systematisch durchlöchert: Arzneimittelhersteller sollen künftig auf allgemein zugänglichen Internetseiten oder in Printmedien Informationen zu Gesundheit, Krankheit und rezeptpflichtigen Arzneimitteln verbreiten dürfen.
Am 10. Dezember 2008 verabschiedeten die EU-Kommissare einen Richtlinien-Vorschlag zum so genannten Arzneimittelpaket. Auch wenn das Werbeverbot für rezeptpflichtige Arzneimittel formell erhalten bleibt, wird es systematisch durchlöchert: Arzneimittelhersteller sollen künftig auf allgemein zugänglichen Internetseiten oder in Printmedien Informationen zu Gesundheit, Krankheit und rezeptpflichtigen Arzneimitteln verbreiten dürfen.
Für die Vorschläge hatte sich vor allem Günter Verheugen, der für Unternehmens- und Industriepolitik zuständige Vizepräsident der EU-Kommission, stark gemacht. Er möchte die Wettbewerbsfähigkeit der europäischen Pharmaindustrie fördern. In einer Pressemitteilung der Europäischen Kommission vom 10.12.2008 heißt es dazu: "Wir wollen die EU wieder zu dem machen, was sie schon einmal war, nämlich zur Apotheke der Welt." Dabei soll eine Erweiterung der Spielräume bei der Arzneimittelinformation und eine damit verbundene angebliche Harmonisierung der europäischen Gesetzgebung der Pharmaindustrie helfen.
Im Vorfeld hatte es massive Kritik von VerbraucherInnen und Fachleuten gegeben. Auch der EU-Kommissarin für Gesundheit und Verbraucherschutz Androulla Vasilliou gingen die Vorschläge zu weit. Sie konnte immerhin durchsetzen, dass Radio- und TV-Beiträge sowie Internet-TV tabu bleiben. Doch das reicht bei weitem nicht aus, denn andere Schutzklauseln werden durch vage formulierte Ausnahmeregeln wieder durchlöchert. Der Verbraucherschutz bleibt auf der Strecke.
Künftig sollen Pharmafirmen auf Grundlage des Beipackzettels und vorliegender Fachinformationen den VerbraucherInnen selbst zusammengestelltes Informationsmaterial präsentieren dürfen. Was als verbesserte Aufklärungsmöglichkeit daher kommt, reißt das Tor zur geschönten bis irreführenden Darstellung weit auf. Bereits jetzt sind Beipackzettel und Fachinformation für Laien für europäisch zugelassene Arzneimittel frei zugänglich auf der Homepage der European Medicines Agency.
Bisher sieht die neue EU-Richtlinie eine Überwachung des erweiterten direkten Zugang der Hersteller zu VerbraucherInnen vor. Diese Vorabkontrolle der Information durch die Behörden soll nun eine freiwillige Selbstkontrolle der Industrie ersetzen können, nachzulesen auf der Website des EU-Kommissariats für Unternehmen und Industrie. Über die Art der Kontrolle sollen wiederum die Mitgliedsstaaten selbst entscheiden können - dem vorgegeben Ziel der Harmonisierung dürfte das kaum dienlich sein.
Das Gleiche gilt für die Frage der möglichen Platzierung von Laienwerbung, die in Zukunft in Zeitungen und Zeitschriften erlaubt sein soll. Die Entscheidung über die genaue Form, in der Pharma-Hersteller ihre Produkte den nicht medizinisch oder pharmakologisch vorgebildeten KundInnen anbieten können, soll aber bei den Mitgliedsstaaten liegen. Auch hier keine Spur der vielzitierten europäischen Harmonisierung.
Grundsätzlich problematisch bleibt eine klare Abgrenzung von Arzneimittelinformation von Werbung. Jede Botschaft eines Herstellers mag einen Informationsanteil enthalten, aber hinter jeder Produktinformation steckt auch immer eine verkaufsfördernde Absicht, sprich Werbung. So ist es nicht verwunderlich, dass die Kommission hier entscheidende Fragen offen und Klarheit vermissen lässt. PatientInnen brauchen unabhängige, verständliche und vergleichende Gesundheitsinformationen, um eine Entscheidung für oder gegen eine Behandlung treffen zu können. Aber gerade vergleichende Arzneimittelinformation - bzw. -werbung - ist nach der jetzigen Gesetzesvorlage verboten.
Der Gesetzesvorschlag hat mit der Verabschiedung durch die EU-Kommissare seinen parlamentarischen Prozess begonnen und sowohl der EU-Ministerrat als auch das Europäische Parlament werden sich mit der Thematik befassen müssen. Entscheidende Vorbesprechungen gibt es dieser Tage im EU-Ausschuss für Umweltfragen, Volksgesundheit und Lebensmittelsicherheit (ENVI), wo am ehesten Chancen bestehen, mit den Bedenken von VerbraucherInnen und Fachleuten auf offene Ohren zu stoßen. Die Buko Pharma-Kampagne bietet eine Plattform, um die Ablehnung der zunehmenden Freigabe von Laienwerbung für Medikamente zu bündeln und Druck insbesondere auf deutsche (EU)-PolitikerInnen auszuüben, damit sie sich für wirklichen und zuverlässigen mehr Verbraucherschutz einsetzen. Sie hat Stellungnahmen wichtiger Verbraucher- und Fachorganisationen zusammengetragen und eröffnet auf dieser Website auch die Möglichkeit, sich an ihrer Unterschriftenaktion zu beteiligen und damit die Überzeugung zum Ausdruck zu bringen, dass Verbraucherschutz Vorrang vor wirtschaftlichen Interessen haben muss.
Jens Holst, 19.2.09
Patienteninformation im Pharmainteresse: Das EU-Vorhaben zur Werbung für rezeptflichtigte Arzneimittel
 Wiederholt hat die EU-Kommission versucht, das lästige Wettbewerbshindernis des Laienwerbeverbots für rezeptpflichtige Arzneimittel aus den Angeln zu heben. Bisher ist die allgemein zugängliche Bewerbung von allen Medikamenten, die ausschließlich mit ärztlicher Verschreibung erhältlich sind, nur in den USA und in Neuseeland zulässig. In den Ländern der Europäischen Union ist Laienwerbung bisher untersagt, doch nun zeigt die Kommission erneut Initiative zur Überwindung des Werbeverbots. Die EU will der Pharmaindustrie erlauben, den BürgerInnen "Informationen" zu Gesundheit, Krankheit und rezeptpflichtigen Arzneimitteln anzubieten. Dafür machen sich Pharmahersteller seit Jahren stark.
Wiederholt hat die EU-Kommission versucht, das lästige Wettbewerbshindernis des Laienwerbeverbots für rezeptpflichtige Arzneimittel aus den Angeln zu heben. Bisher ist die allgemein zugängliche Bewerbung von allen Medikamenten, die ausschließlich mit ärztlicher Verschreibung erhältlich sind, nur in den USA und in Neuseeland zulässig. In den Ländern der Europäischen Union ist Laienwerbung bisher untersagt, doch nun zeigt die Kommission erneut Initiative zur Überwindung des Werbeverbots. Die EU will der Pharmaindustrie erlauben, den BürgerInnen "Informationen" zu Gesundheit, Krankheit und rezeptpflichtigen Arzneimitteln anzubieten. Dafür machen sich Pharmahersteller seit Jahren stark.
Der vorgelegte Gesetzesvorschlag LEGAL PROPOSAL ON INFORMATION TO PATIENTS der EU-Komission gibt zwar vor, das Werbeverbot grundsätzlich nicht aufheben zu wollen, strebt aber eine Reihe von Erleichterungen für Pharmahersteller an, über ihre Produkte - einschließlich der rezeptpflichtigen Mittel - zu "informieren". Damit wollen sich viele EU-BürgerInnen und Organisationen allerdings nicht abfinden. Ein breites Bündnis von Patienten- und Ärzteorganisationen fordert einen Stopp für die EU-Vorschläge. Stattdessen soll der Zugang zu industrie- unabhängiger Information nachhaltig verbessert werden. Gemeinsam mit der Ärzteorganisation IPPNW Deutschland, der BundesArbeitsGemeinschaft der PatientInnenstellen- und initiativen (BAGP) sowie der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) hat die BUKO Pharma-Kampagne eine Stellungnahme zur heiklen Frage der Arzneimittelwerbung vorgelegt. Die zentrale Forderung lautet: Beibehaltung des Verbots von Verbraucherinformationen zu rezeptpflichtigen Arzneimitteln durch die Hersteller. Zudem müsse die Kommission ebenso wie die Mitgliedsstaaten stärker jeden Verstoß gegen geltendes EU- bzw. nationales Recht kontrollieren und ahnden. Denn schon jetzt nutzt die Pharmaindustrie viele Kommunikationskanäle um einseitige "Informationen" zu Gesundheit, Krankheiten und Arzneimittel zu streuen. Gleichzeitig müsse sichergestellt sein, dass unabhängige Einrichtungen ohne unmittelbare ökonomische Interessen an der Produktvermarktung vergleichende Information über Arzneimittel durch zur Verfügung stellen können.
In diesem Sinne haben sich mittlerweile viele Organisationen in verschiedenen Mitgliedsstaaten kritisch mit der neuerlichen Initiative der EU-Kommission geäußert und ihre Bedenken vorgebracht. Die BUKO Pharma-Kampagne hat auf ihrer Webseite eine Sammlung von Links zu kritischen Einwänden und Gegenargumenten so renommierter Organisationen wie der British Medical Association (BMA) und der Association Internationale de la Mutualité (AIM) zusammengetragen.
Hier finden Sie den EU "Gesetzesvorschlag zur Patienteninformation"
Jens Holst, 6.5.2008
Pro und Kontra Direktwerbung für verschreibungspflichtige Medikamente: die Industrie beherrscht die Berichterstattung in den amerikanischen Nachrichtenmedien
 Werbung für verschreibungspflichtige Medikamente, die sich direkt an den Patienten richtet (direct to consumer advertising, DTCA) ist weltweit nur in den USA und in Neu Seeland erlaubt. In den USA hatte die Food and Drug Administration im Jahr 1997 durch Neufassung der Bestimmung über den Umfang der Pflichtinformationen einen Boom in der Fernsehwerbung für Medikamente ausgelöst. Durch Minderung der Informationsanforderungen wurde die Medikamentenwerbung TV-tauglich gemacht.
Werbung für verschreibungspflichtige Medikamente, die sich direkt an den Patienten richtet (direct to consumer advertising, DTCA) ist weltweit nur in den USA und in Neu Seeland erlaubt. In den USA hatte die Food and Drug Administration im Jahr 1997 durch Neufassung der Bestimmung über den Umfang der Pflichtinformationen einen Boom in der Fernsehwerbung für Medikamente ausgelöst. Durch Minderung der Informationsanforderungen wurde die Medikamentenwerbung TV-tauglich gemacht.
In einer im Januar 2008 veröffentlichten Studie " News media coverage of direct-to-consumer pharmaceutical advertising" untersuchen die Soziologin Heather Hartley und die Kommunikationswissenschaftlerin Cynthia-Lou Coleman die Berichterstattung zu den Kontroversen um DTCA in amerikanischen Tageszeitungen. Dabei ging es um die Frage, welcher der Akteure (Pharmazeutische Industrie, Wissenschaftler bzw. universitäre Forschungseinrichtungen, Gesundheitsbehörden, Kostenträger, Leistungserbringer und Konsumentenverbände) in den Zeitungen die meiste Präsenz hat.
Die Wissenschaftler gehen davon aus, dass die Medien sozusagen die Bühne darstellen, auf der unterschiedliche Interessengruppen ihre Kämpfe um Macht und Einfluss austragen. Der Zugang zu den Medien ermöglicht es, ein Problem aus der eigenen Perspektive darzustellen (framing) und damit auf die öffentliche Wahrnehmung von Problemen und Problemlösungen einzuwirken.
Acht amerikanische Tageszeitungen wurden für den Zeitraum August 1997 bis Juli 2003 untersucht auf alle Meldungen und Berichte, die sich mit Pro und Kontra von DTCA befassten.
145 Artikel mit 436 Quellen wurden gefunden und analysiert bezüglich der folgenden Fragen:
1. Wie oft erscheinen Akteure als Quelle in der Berichterstattung über DTCA (Prävalenz)?
2. Wie wirksam sind die Quellen (gemessen als Wahrscheinlichkeit, direkt zitiert zu werden, als Anzahl der Wörter pro Zitat und als erste Quelle im Artikel)
3. Wie sind die Anteile von Befürwortern und Gegnern von DTCA verteilt (relative Prävalenz)?
Insgesamt machte die die Pharmazeutische Industrie 20 Prozent der Quellen aus, als erste Quelle wurde sie in 12 Prozent aufgeführt. Wissenschaftler bzw. universitäre Forschungseinrichtungen waren mit 15 Prozent die zweithäufigste Quelle, unter den Erstquellen führten sie mit 19 Prozent. Die Konsumentenseite machte 9 Prozent der Quellen aus und 7 Prozent der Erstquellen.
Aufgrund dieser und zusätzliche Auswertungen kommen die Autoren zum Ergebnis, dass die Industrie unter allen Akteuren die besten Möglichkeiten hat, ihre Sicht der Dinge in den Medien darzustellen. Skeptiker und Gegner der DTCA kommen weniger zu Wort, insbesondere die Konsumenten und Leistungserbringer sind kaum präsent.
Abstract der Studie
Der Volltext kostet 15 $.
Eine besondere Aktualität hat die Studie durch die aktuellen Bestrebungen der Europäischen Kommission, der Pharmazeutischen Industrie zu erlauben, über ihre Produkte in Radio und Fernsehen zu "informieren" (Public Consultation. Legal proposal on information to patients vom 2. Feburar 2008). Sollte dies umgesetzt werden und sollten die Ergebnisse auf Europa übertragbar sein, würde es schwierig werden, Kritik in den Nachrichtenmedien anzubringen.
David Klemperer, 10.3.2008
"Trau nicht allein den Journals !" - Wie selbst wüste Vorurteile gegenüber der Arzneimittel-Information noch übertroffen werden
 So jedenfalls lässt sich das zusammenfassen, was der Psychiater Erick Turner und Mitarbeiter der Oregon Health & Science University in Portland im US-Staat Oregon herausbekamen, als sie eine Reihe von in Fachzeitschriften publizierten Aufsätzen über Studien zur Wirksamkeit von Antidepressiva mit den internen und umfassenderen Unterlagen der US-amerikanischen Arzneimittelzulassungsbehörde "Federal Drug Administration (FDA)" über Antidepressiva-Studien verglichen.
So jedenfalls lässt sich das zusammenfassen, was der Psychiater Erick Turner und Mitarbeiter der Oregon Health & Science University in Portland im US-Staat Oregon herausbekamen, als sie eine Reihe von in Fachzeitschriften publizierten Aufsätzen über Studien zur Wirksamkeit von Antidepressiva mit den internen und umfassenderen Unterlagen der US-amerikanischen Arzneimittelzulassungsbehörde "Federal Drug Administration (FDA)" über Antidepressiva-Studien verglichen.
Dies ist in den USA durch den "Freedom of Information Act" möglich, der staatliche Behörden verpflichtet, interne Akten offenzulegen. Dabei handelte es sich um alle FDA-Unterlagen zu 12 Antidepressiva, deren Zulassung Hersteller zwischen 1974 und 2004 beantragt hatten.
Beim Vergleich ergaben sich was Anzahl und Wirkungsaussage anlangt erhebliche Abweichungen zwischen den Fachzeitschriftenpublikationen und den insgesamt in den Zulassungsakten von den Herstellern eingereichten und gesammelten Studien:
• Von den insgesamt bei der FDA registrierten Studien zu diesen Arzneimitteln wurden 31% nicht veröffentlicht und damit die Ergebnisse bei 3.449 TeilnehmerInnen.
• Es gab insgesamt 38 Studien, die ein positives Ergebnis des Einsatzes von Antidepressiva enthielten. Von ihnen wurden 37 publiziert.
• Anders sah es bei den insgesamt 36 Studien aus, die zu einem negativen oder aus Sicht der FDA zu einem fragwürdigen Ergebnis kamen, also vor allem keine Wirkung einer Behandlung mit Antidepressiva fanden. Von ihnen wurden lediglich 14 publiziert.
• Doch selbst die Publikation an sich negativ verlaufender Studien erfolgt nicht ohne massive Modifikation des Gesamteindrucks. 11 von ihnen vermittelten nämlich nach Darstellung der Portlander Wissenschaftler einen eher positiven Eindruck. Nur 3 von 36 Studien mit negativem Ergebnis über die Wirkung der Antidepressive, d.h. unter 10% wurden also überhaupt als solche unverzerrt veröffentlicht.
• Die Unterschiede der Angaben zur Wirksamkeit in Fachzeitschriften im Vergleich mit jenen in Zulassungsunterlagen betragen laut Turner et al. 32%.
• Damit wird klar, dass die ausschließliche Lektüre und sich darauf stützende praktische Schlussfolgerungen (z. B. um Leitlinien zu erstellen) von in "good journals" publizierten Untersuchungen allein in die Irre führen können.
Die Reaktion von Pharmasprechern, die Kritik sei "überholt", ist richtig und falsch zugleich. Richtig ist, dass seit den unerwünschten Folgen eines Arzneimittels, die zwar den Herstellern bekannt, aber nicht in die Öffentlichkeit gedrungen waren, alle Arzneimittelstudien von den Firmen selber und in dem öffentlichen Portal der National Library of Medicine (im Januar 2008 finden sich dort 49.920 Stunden aus 153 Ländern) Interessenten und der Öffentlichkeit zugänglich gemacht werden. Falsch oder unvollständig ist die Beruhigung deshalb, weil diese Meldepflichten für ältere, also den größeren Teil der Arzneimittel nicht erfüllt werden (müssen).
Von dem gerade erschienenen Aufsatz "Selective Publication of Antidepressant Trials and Its Influence on Apparent Efficacy" von Erick H. Turner, Annette M. Matthews, Eftihia Linardatos, Robert A. Tell und Robert Rosenthal im "New England Journal of Medicine (NEJM)" (N Engl J Med 2008;358:252-60) erhältlich man kostenfrei lediglich das Abstract.
Bernard Braun, 24.1.2008
Arzneimittelinformationen für Patienten: Massive Kritik an der standardisierten Einheits-Information des Beipackzettels
 Eine Meta-Analyse von knapp 30 wissenschaftlichen Veröffentlichungen über Arzneimittel-Informationen hat jetzt unter anderem gezeigt, dass die gängige Praxis, nur eine einzige standardisierte Information (in Form des Beipackzettels) zu erstellen, die unterschiedlichen Interessen von Patienten völlig missachtet. Die Erwartungen und Informationsinteressen von Patienten, denen ein Medikament verschrieben wurde, unterscheiden sich wie Tag und Nacht. Einige bevorzugen sehr detaillierte, andere eher knappe Auskünfte, einige möchten nur Hinweise bekommen über die Dosierung und Einnahmezeiten, andere ganz genau wissen, welche Funktion das Medikament im Rahmen ihrer Erkrankung hat. Daher, so die Autoren der Studie, wären solche Informationsbroschüren sehr viel nützlicher, die der Arzt nach dem Sprechstundentermin speziell auf die Informationsbedürfnisse des einzelnen Patienten vom Computer zuschneiden lässt und ihm übergibt.
Eine Meta-Analyse von knapp 30 wissenschaftlichen Veröffentlichungen über Arzneimittel-Informationen hat jetzt unter anderem gezeigt, dass die gängige Praxis, nur eine einzige standardisierte Information (in Form des Beipackzettels) zu erstellen, die unterschiedlichen Interessen von Patienten völlig missachtet. Die Erwartungen und Informationsinteressen von Patienten, denen ein Medikament verschrieben wurde, unterscheiden sich wie Tag und Nacht. Einige bevorzugen sehr detaillierte, andere eher knappe Auskünfte, einige möchten nur Hinweise bekommen über die Dosierung und Einnahmezeiten, andere ganz genau wissen, welche Funktion das Medikament im Rahmen ihrer Erkrankung hat. Daher, so die Autoren der Studie, wären solche Informationsbroschüren sehr viel nützlicher, die der Arzt nach dem Sprechstundentermin speziell auf die Informationsbedürfnisse des einzelnen Patienten vom Computer zuschneiden lässt und ihm übergibt.
Patienten erhalten Arzneimittel-Informationen in Europa fast nur in Form der vom Pharma-Unternehmen erstellten Beipackzettel , sieht man einmal von Websites ab, wie zum Beispiel die Seite "Medikamente im Test" der Stiftung Warentest, die Bewertungen von über 9.000 Medikamenten zum (kostenpflichtigen) Download bereit hält. Eine große Zahl von Studien hat in der letzten Zeit deutlich gemacht, dass diese Medikamenten-Beipackzettel aus Verbrauchersicht erhebliche Mängel aufweisen, etwa die deutsche Studie des WIdO (vgl. Medikamenten-Beipackzettel: Zu lang, unverständlich, angsteinflößend) oder eine englische Meta-Studie (vgl. Studie zeigt gravierende Mängel bei Arzneimittel-Information für Patienten auf).
Aus diesem Grund hat jetzt eine englische Forschungsgruppe noch einmal wissenschaftliche Veröffentlichungen neu zusammengefasst, die sich speziell mit der Bedeutung von Arzneimittelinformationen für Patienten, also deren Erwartungen und Informationsmotiven, beschäftigt haben. Insgesamt 27 Studien flossen in ihre Meta-Analyse ein. Herausgekommen sind einige neue Erkenntnisse, die für die Pharma-Industrie ebenso wie für Ärzte und Einrichtungen im Gesundheitswesen erhebliche praktische Bedeutung haben.
Die möglicherweise wichtigste Erkenntnis heißt: "Informationsbedürfnisse verändern sich im Zeitablauf während einer Erkrankung und variieren auch erheblich zwischen einzelnen Patienten. Von daher ist das Konzept einer standardisierten und einheitlichen Broschüre, die in der Lage ist, alle oder fast alle Interessen zu befriedigen, unrealistisch. Viele Patienten möchten darüber hinaus Informationen, die ihre Erkrankung mit einbeziehen. Die aktuell gängigen Beipackzettel beschäftigen sich jedoch mit Medikamenten, und nicht mit Krankheiten. Von Computern erstellte Informationsbroschüren, die in der Sprechstunde dem Patienten ausgehändigt werden, würden es demgegenüber ermöglichen, auf den einzelnen Patienten, seine speziellen Bedingungen und Interessen einzugehen." (S. 295)
Diese Konsequenz lässt sich ableiten aus Forschungsbefunden zu den sehr unterschiedlichen Informationsgewohnheiten und -interessen von Patienten. So zeigt sich in sechs Studien, dass ausführliche und detaillierte Beschreibungen gegenüber knappen und verdichteten Hinweisen bevorzugt werden. In zwei anderen Studien hingegen wurde eine zu umfangreiche Information kritisiert. Eine Studie fand heraus, dass 67% der Befragten eine eher knappe Darstellung bevorzugen, zugleich möchten jedoch 88% auch, dass die Darstellung leicht verständlich ist.
Fragen, die sich Patienten stellen, wenn ihnen ein Medikament verschrieben wird, sind sehr unterschiedlicher Natur, unter anderem betreffen sie die folgenden Aspekte: Ist dieses Medikament für meine Erkrankung geeignet? Gibt es noch andere Behandlungsmöglichkeiten, mit oder ohne Arzneimittel? Wann und wie oft muss ich das Mittel einnehmen und über welche Zeitdauer? Was genau bewirkt das Medikament? Was passiert, wenn ich die Einnahme vergesse oder bewusst darauf verzichte? Was spüre ich, wenn ich das Medikament eingenommen habe? Welche Nebenwirkungen gibt es und was ist zu beachten, wenn noch andere Medikamente eingenommen werden? Welche Risiken gibt es bei einer länger dauernden Einnahme?
Das Informationsinteresse verändert sich im Verlaufe der Erkrankung und der Medikamenten-Einnahme. Zu einem späteren Zeitpunkt werden oftmals andere Fragen gestellt als zu Beginn einer Erkrankung - der Beipackzettel ist jedoch derselbe. So ist nicht verwunderlich, dass in den Studien zwar 60-95% der Befragten angaben, dass sie die Information auch (teils flüchtig, teils genau) gelesen hätten, jedoch nur ein einziges Mal nach der ersten Verordnung.
Hinsichtlich der unterschiedlich Erkenntnisinteressen der einzelnen Studien sind zwei unterschiedliche Richtungen erkennbar. Ein Typus von Studien ist eher daran interessiert, Informationen so zu gestalten, dass Patienten sich auch an die Einnahmevorschriften halten - also eine hohe "Compliance" oder "Adherence" an den Tag legen. Ein anderer Typus möchte Patienten eher dazu befähigen, Nutzen und Risiken des Arzneimittels und auch seine Wirkung zu verstehen, um so stärker eingebunden zu werden in die "Partizipative Entscheidungsfindung" (Shared Decision Making ) bei der Therapieentscheidung.
Die Meta-Analyse zählt noch eine Reihe weiterer Erkenntnisse auf, unter anderem:
• das von einigen Patientengruppen artikulierte Misstrauen an der Zuverlässigkeit und Vertrauenswürdigkeit der von Pharma-Unternehmen erstellten Informationen,
• die generelle Abneigung einiger (meist älterer) Patienten gegenüber schriftlichen Informationen und die bei ihnen eindeutige Bevorzugung mündlicher Aufklärung durch den Arzt,
• das spezielle Interesse einer Reihe von Befragungsteilnehmern, durch Lektüre der Beipackzettel genauere - und vom Arzt nicht mitgeteilte - Auskünfte über ihre Diagnose und Krankheit zu erhalten.
Ein kostenloses Abstract der Studie ist hier zu finden: Janet Grime u.a.: The role and value of written information for patients about individual medicines: a systematic review (Health Expectations, Volume 10 Issue 3 Page 286-298, September 2007)
Der inhaltlich sehr viel aufschlussreichere Volltext des Artikels mit umfangreichen Literaturangaben ist leider kostenpflichtig, bzw. setzt ein Abo bei "Wiley Interscience" voraus
Gerd Marstedt, 7.8.2007
US-Gesundheitswissenschaftler: "Antidepressiva für die gesamte Bevölkerung zur Prävention"
 In ihrer Juni-Ausgabe veröffentlichte die Fachzeitschrift PharmacoEconomics (2007; 25 (6): 511-521) eine Studie mit dem viel sagenden Titel Kosten und Vorzüge direkter Verbraucher-Werbung. Darin kommt der Gesundheitswissenschaftler Adam Block aus Harvard zu dem Ergebnis, der durchschnittliche Lebensqualitätsgewinn für jeden neu mit Antidepressiva behandelten Patienten sei 63 Mal so groß wie die anfallenden Therapiekosten. Der so ermittelte Therapiegewinn auf Seiten der tatsächlich an Depression Erkrankten sei so überwältigend, dass sich die Behandlung einer ganzen Nation selbst dann rechnet, wenn die Behandlung 15 Mal so viele Gesunde wie Depressive erfassen würde und praktisch nur einer von 20 neu mit Antidepressiva behandelten "Patienten" das Medikament wirklich brauchte. Insgesamt sei es gesundheitsökonomisch gerechtfertigt, die gesamte US-Bevölkerung ohne vorherigen Arztkontakt und entsprechende Diagnostik und Rezeptausstellung mit Psychopharmaka zu behandeln.
In ihrer Juni-Ausgabe veröffentlichte die Fachzeitschrift PharmacoEconomics (2007; 25 (6): 511-521) eine Studie mit dem viel sagenden Titel Kosten und Vorzüge direkter Verbraucher-Werbung. Darin kommt der Gesundheitswissenschaftler Adam Block aus Harvard zu dem Ergebnis, der durchschnittliche Lebensqualitätsgewinn für jeden neu mit Antidepressiva behandelten Patienten sei 63 Mal so groß wie die anfallenden Therapiekosten. Der so ermittelte Therapiegewinn auf Seiten der tatsächlich an Depression Erkrankten sei so überwältigend, dass sich die Behandlung einer ganzen Nation selbst dann rechnet, wenn die Behandlung 15 Mal so viele Gesunde wie Depressive erfassen würde und praktisch nur einer von 20 neu mit Antidepressiva behandelten "Patienten" das Medikament wirklich brauchte. Insgesamt sei es gesundheitsökonomisch gerechtfertigt, die gesamte US-Bevölkerung ohne vorherigen Arztkontakt und entsprechende Diagnostik und Rezeptausstellung mit Psychopharmaka zu behandeln.
Die flächendeckende antidepressive Behandlung aller US-Bürger schlüge nach Blocks Berechnungen mit einem Überschuss von 72 Millionen US-$ (58 Mio €) zu Buche und führe damit zu einem unbestreitbaren "Wohlfahrtsgewinn". Diesen Überschuss hat der Professor aus Harvard an Hand so genannter qualitäts-adjustierter Lebensjahre (QALY's) ermittelt, die auf einer recht willkürlichen Umrechnung von Krankheiten und Behinderungen in kalkulierbare Kosten basieren Damit sieht der Autor die Einwände gegen Laienwerbung für verschreibungspflichtige Medikamente entkräftet, die bisher nur in den USA und Neuseeland zulässig ist und dort zu einem rasanten Anstieg der Arzneimittelausgaben geführt hat.
Das Ganze hat nur einen kleinen Haken: In der abschließenden Diskussion seines Beitrags gesteht Block, sein Ergebnis würde vermutlich völlig anders ausfallen, wenn er die unerwünschten Erscheinungen von Antidepressiva berücksichtigt hätte. Die hatte er nämlich in seinem Kalkül schlichtweg unter den Tisch fallen lassen. Dabei gehören Psychopharmaka zu den meist gefürchteten Medikamenten mit erheblichen "Neben"-Wirkungen. Sie verursachen nicht nur selber Kopfschmerzen, Verwirrtheit, Magen-Darm-Probleme oder sexuelle Dysfunktionen. Weitaus problematischer sind die häufigen Wechselwirkungen mit anderen Arzneimitteln, deren Wirkung sie wahlweise verstärken oder abschwächen können.
Passend zur meist schlichten Modellwelt der Ökonomie blendet Block, der Professor an einer der auch von deutschen Politikern so gerne erwähnten Elite-Universitäten ist, auch alle weiteren externen Effekte aus. So berücksichtigt er weder ökonomische oder ökologische Zusatzkosten erhöhter Tablettenproduktion für ein 320-Millionenvolk noch die Konsequenzen für den anfallenden Massentransport. Schleierhaft bleibt zudem, ob schon jeder Säugling als Psychopharmaka-Verbraucher mitgezählt ist. Ganz zu schweigen von den direkten und indirekten Kosten der zu erwartenden unerwünschten Wirkungen, die durch den Verlust an QALY's, zusätzliche Arztkontakte und Krankenhausaufenthalte sowie erhöhtem Medikamentenverbrauch bei allen Präparaten ebenfalls erhebliche volkswirtschaftliche Kosten erwarten lassen. Einen Einblick in die komplexe Welt der Antidepressiva-induzierten Wechselwirkungen vermittelt ein im Internet frei zugängliches Vorlesungskript von Josef Donnerer am Institut für Experimentelle und Klinische Pharmakologie der Universität Graz.
Einen Überblick über die Prävalenz und Bedeutung von depressiven Erkrankungen, die therapeutischen Möglichkeiten und häufige unerwünschte Wirkungen von Antidepressiva vermittelt der frei zugängliche Beitrag von Vincenza Snow, Steven Lascher und Christel Mottur-Pilson im Auftrag des American College of Physicians - American Society of Internal Medicine verfasste Beitrag Pharmacologic Treatment of Acute Major Depression and Dysthymia: Clinical Guideline, Part 1 (Annals of Internal Medicine 2000; 132 (9), S. 738-742). Die wichtigsten Leitlinien fasst der Beitrag von John Williams, Cynthia Mulrow, Elaine Chiquette, Polly Hitchcock, Christine Aguilar und John Cornell A Systematic Review of Newer Pharmacotherapies for Depression in Adults: Evidence Report Summary: Clinical Guideline, Part 2 zusammen (Ann Int Med 2000; 132 (9), S. 743-756).
Das Thema der Laienbewerbung verschreibungspflichtiger Medikamente kommt auch in der EU in den letzten Jahren verstärkt auf die Tagesordnung. Neben deutlich steigenden Medikamentenausgaben zeigen gesundheitswissenschaftliche Studien über Folgen allgemein zugänglicher Werbung für Arzneimittel in den USA vor allem zwei Tendenzen. Die Studie Promotion of Prescription Drugs to Consumers von Meredith Rosenthal, Ernst Berndt, Julie Donohue, Richard Frank und Arnold Epstein im N Engl J Med 2002; 346 (7), S. 498-505 diagnostiziert neue Herausforderungen an Ärzte, die ihren Patienten beistehen müssen, die Informationen und Behauptungen aus der Laienwerbung richtig einzuordnen. Frei zugänglich ist nur das Abstract des Artikels aus dem New England Journal of Medicine.
Richard Kravitz, Ronald Epstein, Mitchell Feldman, Carol Franz, Rahman Azari, Michael Wilkes, Ladson Hinton und Peter Franks bestätigen diesen Befund in ihrem Artikel Influence of Patients' Requests for Direct-to-Consumer Advertised Antidepressants: A Randomized Controlled Trial im JAMA 2005; 293 (16), S. 1995-2002 und weisen auf widersprüchliche Effekte von direkter Verbraucherwerbung hin: Zwar könnten sie Unterversorgung vermeiden helfen, aber gleichzeitig beflügeln die sie Überversorgung. Kostenfrei stehet ebenfalls nur das Abstract des JAMA-Artikels zur Verfügung.
Die Kalkulationsstudie über flächendeckenden Einsatz von Antidepressiva zeigt nicht zuletzt vor dem Hintergrund vorliegender sozial- und gesundheitswissenschaftlicher Erkenntnisse eindrücklich, welchen Unsinn auch renommierte Universitäten verzapfen, auf die deutsche Bildungspolitiker so gerne verweisen. Und sie wirft ein schräges Licht auf die Seriosität ökonomischer Fachzeitschriften, die wie die Pilze aus dem Boden schießen und ihre politischen Intentionen kaum verbergen. Kostenfrei ist nur das Abstract der Studie aus der Juni-Ausgabe von Pharmacoeconomics herunterzuladen. Eine Glosse zur Studie und zur zunehmenden Stromlinienform von Fachpublikationen liefert die tageszeitung in ihrer Ausgabe vom 13.7.2007.
Hier finden sie einen Hintergrundartikel zu der Untersuchung aus Harvard aus der Ausgabe vom 9. August 2007 der Zürcher WochenZeitung
Jens Holst, 11.7.2007
Studie zeigt gravierende Mängel bei Arzneimittel-Information für Patienten auf
 Arzneimittel-Informationen für Patienten, in Form von Beipackzetteln oder ärztlichen Instruktionen, sind für Patienten selbst ganz überwiegend unverständlich formuliert und wenig nachvollziehbar, dies hat jetzt eine große Studie festgestellt, in der über 70 wissenschaftliche Veröffentlichungen zu diesem Thema noch einmal neu ausgewertet wurden. Darüber hinaus wurden in der Studie im Rahmen vieler Workshops mit Ärzten, Patienten und Selbsthilfegruppen Anregungen für eine zukünftig bessere Gestaltung dieser wichtigen Informationen erarbeitet.
Arzneimittel-Informationen für Patienten, in Form von Beipackzetteln oder ärztlichen Instruktionen, sind für Patienten selbst ganz überwiegend unverständlich formuliert und wenig nachvollziehbar, dies hat jetzt eine große Studie festgestellt, in der über 70 wissenschaftliche Veröffentlichungen zu diesem Thema noch einmal neu ausgewertet wurden. Darüber hinaus wurden in der Studie im Rahmen vieler Workshops mit Ärzten, Patienten und Selbsthilfegruppen Anregungen für eine zukünftig bessere Gestaltung dieser wichtigen Informationen erarbeitet.
In dem jetzt vorgelegten Bericht eines Forschungsteams mit Wissenschaftlern mehrerer englischer Universitäten wird sowohl die inhaltliche als auch die grafische Gestaltung von Arzneimittelinformationen heftig kritisiert. Patienten bemängeln den medizinischen Fachjargon, der für sie nicht verständlich ist, ebenso wie die zumeist spartanische grafische Gestaltung und die fehlende Anreicherung der Zettel oder Broschüren durch Grafiken und anschauliche Diagramme.
Ein genau so zentraler Kritikpunkt von Patienten zielt darauf, dass die Information viel zu pauschal und allgemein ist, und dass der einzelne Patient mit seinem ganz besonderem Krankheitsspektrum nicht berücksichtigt wird. Medikamentenwirkungen in Abhängigkeit von Alter und Geschlecht, Gesundheitszustand und weiteren Beschwerden oder auch chronischen Erkrankungen wären jedoch für Patienten von erheblicher Bedeutung. Schließlich wird auch kritisiert, dass in den Informationen kein Gleichgewicht besteht in der Abwägung von positiven und negativen Facetten der Medikamente, von Risiken und Nutzen.
Auch die Tatsache, dass Medikamenten-Beipackzettel von der Pharma-Industrie selbst und nicht von unabhängigen Institutionen verfasst sind, ist Anlass für Kritik. Da gegenüber der Pharma-Industrie ganz allgemein ein erheblich Misstrauen bestünde, führen die Wissenschaftler aus, wirkt sich dieses dann so aus, dass deren Informationen über Wirkungen und Nebenwirkungen der Medikamente eher mit Skepsis und Misstrauen begegnet wird. Sie schlagen auch vor, dass bei der inhaltlichen Gestaltungen von Arzneimittel-Informationen zukünftig sehr viel stärker Patienten und Patienten-Selbsthilfegruppen beteiligt werden sollten.
Hat die Art der Arzneimittel-Information einen Einfluss auf die Therapietreue, also die Einnahme der Medikamente so wie verordnet? Der Bericht geht auch auf diese Frage ein, findet jedoch keine überzeigende Belege für diese Annahme. Offensichtlich ist zum gegenwärtigen Zeitpunkt die Art der Information in den USA und Europa derart ähnlich und derart ähnlich unbefriedigend, dass hier keine positiven Beispiele durchschlagen können.
Überraschend für die Wissenschaftler war die völlig unterschiedliche Einschätzung der Funktion von Arzneimittel-Informationen. Während Ärzte fast immer hervorheben, dies sei wichtig, um die "Compliance" zu steigern, also den Patienten zu überzeugen, dass er die Arznei so lange und in der Tages-Dosierung wie verschrieben einnimmt, ist bei Patienten eine andere Sicht vorherrschend. In aller erster Linie lesen sie die Beipackzettel, um zu entscheiden, ob sie die Medizin überhaupt einnehmen oder nicht. Darüber hinaus versuchten sie damit herauszufinden, was der Arzt mit ihnen vorhabe und welche Diagnose er gestellt habe.
"Unsere Studie hat auch gezeigt", heben die Wissenschaftler hervor, "dass die geschriebene Information unbedingt mit dem übereinstimmen sollte, was Ärzte in der Sprechstunde ihren Patienten mitteilen. Und sie sollte flexibler und differenzierter als bislang ausgestaltet sein, um den Bedürfnissen ganz verschiedener Patienten in verschiedenen Situationen zu genügen". Da gedruckte Informationen hier wenig geeignet sind, um unterschiedliche Patienten und Krankheitsbilder zu berücksichtigen, dürfte zukünftig dem Internet eine zunehmend größere Bedeutung zukommen.
• Hier findet man ein Abstract der Studie
• Die komplette Studie im Volltext (PDF, 194 Seiten) ist hier verfügbar: A systematic review of quantitative and qualitative research on the role and effectiveness of written information available to patients about individual medicines (Health Technol Assess 2007;11(5):1-178)
Dort findet sich auch eine sehr detaillierte Darstellung der Fragestellungen und Ergebnisse der ausgewerteten 70 Studien zum Thema "Patienteninformation zu Arzneimitteln"
Gerd Marstedt, 4.3.2007
Medicare: Große Kommunikationslücken über Arzneimittel zwischen älteren Patienten und Ärzten
 Eine in der Januar 2007-Ausgabe des "Journal of General Internal Medicine" veröffentlichte us-amerikanische Studie fand eine alarmierend hohe Zahl älterer Amerikaner, die mit ihren Ärzten nicht von sich aus über Probleme mit den ihnen verordneten Medikamenten redeten. Dies umschloss auch die Kommunikation über unerwünschte Nebenwirkungen, Erhältlichkeit oder die wahrgenommene Wirksamkeit der Arzneimittel.
Eine in der Januar 2007-Ausgabe des "Journal of General Internal Medicine" veröffentlichte us-amerikanische Studie fand eine alarmierend hohe Zahl älterer Amerikaner, die mit ihren Ärzten nicht von sich aus über Probleme mit den ihnen verordneten Medikamenten redeten. Dies umschloss auch die Kommunikation über unerwünschte Nebenwirkungen, Erhältlichkeit oder die wahrgenommene Wirksamkeit der Arzneimittel.
Die am "Tufts-New England Medical Center" forschende Gruppe um Ira B. Wilson, Cathy Schoen, Patrician Neuman et al. hat in ihrer vom "Commonwealth Fund" und der "Henry J. Kaiser Family Foundation" geförderten Studie "PHYSICIAN-PATIENT COMMUNICATION ABOUT PRESCRIPTION MEDICATION NONADHERENCE: A 50-STATE STUDY OF AMERICA’S SENIORS" u.a. folgende Kommunikationsdefiziten bei den rund 17.000 befragten Medicare-Versicherten im Alter von 65 und mehr Jahren identifiziert:
• Ein Drittel der befragten Senioren hatte in den letzten 12 Monaten nicht über alle ihrer Arzneimittel mit ihrem behandelten Arzt gesprochen.
• Insgesamt 41 % aller Befragten hielten sich nicht an die ärztlichen Vorgaben zum Umgang mit den verordneten Arzneimitteln. Diese so genannte "Non-compliance" war sogar unter den Senioren größer, nämlich 52 %, die an drei und mehr chronischen Erkrankungen litten.
• Patienten, die mit ihrem Arzt über die Kosten der Verordnung redeten waren eher dazu zu bewegen, sich preisgünstigere Alternativen verordnen zu lassen.
Dass es sich hier um keinen "Ausrutscher" handelt, zeigt ein Blick in die Zusammenfassung der Ergebnisse einer im Jahre 2003 publizierten vergleichbaren Studie "PRESCRIPTION DRUG COVERAGE AND SENIORS: FINDINGS FROM A 2003 NATIONAL SURVEY" von Safran et al.: 40 % der auch damals befragten Medicare-Versicherten hatten die ihnen verordneten Arzneimittel wegen der Kosten, Nebenwirkungen, wahrgenommenen Mangel an Wirksamkeit oder der Überzeugung, sie bräuchten die Mittel nicht, nicht eingenommen, was wahrscheinlich zum Teil ebenfalls auf Verständigungsproblemen beruhte.
Eine zweiseitige Zusammenfassung der Ergebnisse des Aufsatzes "PHYSICIAN-PATIENT COMMUNICATION ABOUT PRESCRIPTION MEDICATION NONADHERENCE: A 50-STATE STUDY OF AMERICA’S SENIORS" gibt es als "In the literature"-Fassung beim Commonwealth Fund.
Bernard Braun, 14.2.2007
GKV-Gemeinschaftsleistung: Transparenz durch die "GKV-Arzneimittel Schnellinformation (GAmSi)"
 "Rund 1,2 Arzneimitteldosen verschrieben Ärzte jedem gesetzlich Versicherten im Durchschnitt pro Tag zwischen Januar und November 2006,...Spitzenreiter war Mecklenburg-Vorpommern mit 1,5 Tagesdosen pro Kopf - knapp 28 Prozent mehr als im Bundesdurchschnitt. Die wenigsten Medikamentendosen pro Kopf und Tag bekamen die Bayern verordnet: Mit 1,1 Tagesdosen liegen sie knapp acht Prozent unter dem bundesweiten Mittel" - so eine Pressemitteilung der Techniker Krankenkasse vom 29.1.2007. Ihre bemerkenswerte Aktualität erklärt sie selber durch den Verweis auf eine bislang eher unbekannte Informationsquelle über ausgewählte Indikatoren zur Verordnung von Arzneimitteln in Deutschland: Der "GKV Arzneimittel Schnellinformation (GamSi)".
"Rund 1,2 Arzneimitteldosen verschrieben Ärzte jedem gesetzlich Versicherten im Durchschnitt pro Tag zwischen Januar und November 2006,...Spitzenreiter war Mecklenburg-Vorpommern mit 1,5 Tagesdosen pro Kopf - knapp 28 Prozent mehr als im Bundesdurchschnitt. Die wenigsten Medikamentendosen pro Kopf und Tag bekamen die Bayern verordnet: Mit 1,1 Tagesdosen liegen sie knapp acht Prozent unter dem bundesweiten Mittel" - so eine Pressemitteilung der Techniker Krankenkasse vom 29.1.2007. Ihre bemerkenswerte Aktualität erklärt sie selber durch den Verweis auf eine bislang eher unbekannte Informationsquelle über ausgewählte Indikatoren zur Verordnung von Arzneimitteln in Deutschland: Der "GKV Arzneimittel Schnellinformation (GamSi)".
Hierbei handelt es sich um einen Informationsdienst aller Spitzenverbände der GKV mit Unterstützung durch die "Informationstechnische Servicestelle der gesetzlichen Krankenkassen GmbH" und das "Wissenschaftliche Institut der AOK (WIdO)".
Im Kurzporträt des Projekts heißt es: "Die GKV-Spitzenverbände haben im Jahre 2001 auf Bundesebene einen gemeinsamen Datenverbund zunächst für eine monatliche Schnellinformation über die Arzneimittel-Verordnungen eingerichtet. Damit sollen die Verordnungsstrukturen in den Kassenärztlichen Vereinigungen transparent gemacht, Trendinformationen über Arzneimittelausgaben vermittelt und Kennzahlen für regionale Vergleichsmöglichkeiten gegeben werden (benchmarking). Das Arzneimittelbudget-Ablösungsgesetz machte diese Information seit 01. Januar 2002 zu einer gesetzlichen Aufgabe der GKV-Spitzenverbände....Das Projekt basiert auf Daten der Rezeptabrechnung, die monatlich dezentral von den Apothekenrechenzentren angenommenen werden. 14 Datenstellen innerhalb der Kassensysteme nach einheitlicher technischer Vorprüfung bereiten die Datenbestände auf und leiten diese ...an die Auswertungsstelle (WIdO). Dort werden die Übermittlungen zu einem GKV-Datenbestand zusammengeführt und nach Validität und Aktualität laufend gesichert. Dieser GKV-Datenbestand ist Grundlage für die monatlichen KV-bezogenen Auswertungen (sog. Standardberichte)....Die Standardberichte werden planmäßig ab dem 21. Werktag an die Spitzenverbände ausgeliefert und liegen somit rund sechs bis acht Wochen nach Apothekenabgabe der Arzneimittel vor."
Zurückreichend bis 2001 finden sich bei GamSi als PDF-Datei abgespeicherte Verordnungsdaten für 17 KV-Bezirke und das gesamte Bundesgebiet.
• Der 17-seitige Bericht über den "Arzneimittelmarkt in Deutschland vom Januar bis November 2006" vom 22.1.2007 enthält dann beispielsweise Angaben über sämtliche Arzneimittelverordnungen und -umsätze, Verordnungsanteile einzelner Marktsegmente (z.B. Generika oder Me-too-Präparate), Wert je Verordnung in diesen Segmenten und Umsatz je 1.000 Versicherte.
• In den Berichten für einzelne KV-Bezirke finden sich außerdem noch Informationen über die 30 umsatzstärksten Arzneimittelgruppen und Fertigarzneimittel sowie die Verordnungen und Umsätze nach Arztgruppen und weitere interessante vergleichbare Informationen.
Diese Daten sind zumindest für eine Basistransparenz über einen der finanziell und qualitativ wichtigsten Teilbereiche der gesundheitlichen Versorgung hilfreich.
Warum die Spitzenverbände ähnliche oder ähnlich aktuelle gemeinsame Informationssysteme trotz bestehender gesetzlicher Möglichkeiten (vgl. dazu die Möglichkeiten der gemeinsamen Datentransparenz nach den §§ 303 a-f SGB V) für andere Bereiche (z.B. Arbeitsunfähigkeit oder Krankenhausaufenthalte) bisher kaum auf die Beine stellen konnten oder wollten, verwundert im Lichte von GamSi etwas.
Den Zugang zur "GKV Arzneimittel Schnellinformation (GamSi)" erhalten Sie hier.
Bernard Braun, 29.1.2007
Desinformation über Arzneimittel: eher Regel als Ausnahme
 Wer mal nicht nur von "bösen Pharmakritikern" oder "linken Gazetten" über die "haarsträubenden Zustände im intransparenten medizinisch-industriellen Komplex" (Berliner Ärzte 12/2006: 16) informiert werden will, der kann jetzt auf die Dezember-2006-Ausgabe der "Berliner Ärzte elektronisch", der Zeitschrift der Berliner Ärztekammer, zugreifen. In mehreren Beiträgen werden darin Ergebnisse einer ebenfalls außergewöhnlichen Veranstaltung der Berliner Ärztekammer vorgestellt, nämlich des Symposiums "Arzneimittel(des)information", das anlässlich des 40-jährigen Bestehens des in Berlin erscheinenden unabhängigen Bulletins "Der Arzneimittelbrief" stattfand.
Wer mal nicht nur von "bösen Pharmakritikern" oder "linken Gazetten" über die "haarsträubenden Zustände im intransparenten medizinisch-industriellen Komplex" (Berliner Ärzte 12/2006: 16) informiert werden will, der kann jetzt auf die Dezember-2006-Ausgabe der "Berliner Ärzte elektronisch", der Zeitschrift der Berliner Ärztekammer, zugreifen. In mehreren Beiträgen werden darin Ergebnisse einer ebenfalls außergewöhnlichen Veranstaltung der Berliner Ärztekammer vorgestellt, nämlich des Symposiums "Arzneimittel(des)information", das anlässlich des 40-jährigen Bestehens des in Berlin erscheinenden unabhängigen Bulletins "Der Arzneimittelbrief" stattfand.
Die Spannbreite und Brisanz sowie der Informationswert lassen sich aus den Titeln der Beiträge entnehmen, die von Ärzten oder auch so einer renommierten Gesundheitsjournalistin wie Rosemarie Stein verfasst wurden. Sie lauten:
• Dr. med. Günther Jonitz: Vollmundigen Versprechungen nicht trauen
• Rosemarie Stein: Arzneimitteldesinformation eher Regel als Ausnahme
• Rosemarie Stein: Der Werbung zum Trotz: Vernünftig verordnen
Zum Ziel einer am Nutzen für die Patienten orientierten Verordnungsweise tragen zwei weitere Beiträge sehr speziell bei:
• Eine kleine Auswahl der pharma-unabhängigen Arzneimittel-Informationsquellen
• Kochen, Michael M und Niebling, Wilhelm: Informationen zur rationalen Arzneimitteltherapie in der hausärztlichen Praxis am Beispiel der Protonenpumpenhemmer. Dieser Aufsatz wurde im August diesen Jahres nicht in der für teuer Geld der "Deutschen Gesellschaft für Allgemeinmedizin und Familiennedizin (DEGAM)" erkauften, werbefreien "Zeitschrift für Allgemeinmedizin (ZFA)" abgedruckt. Dabei spielte der Druck eines Herstellers und Inserenten in anderen Zeitschriften des Verlags der ZFA, des Thiemeverlags, offensichtlich die entscheidende Rolle. Trotz einer zwischenzeitlichen Einigung zwischen DEGAM und dem Thiemeverlag, können die LeserInnen der "Berliner Ärzte" jetzt den Beitrag lesen und erahnen, mit welch harten Bandagen hier Märkte vor sachkundiger kritischer Information geschützt werden.
Hier erreichen Sie das Inhaltsverzeichnis der Zeitschrift "BERLINER ÄRZTE elektronisch" und die dortigen Links zu den PDF-Dateien der einzelnen Artikel.
Bernard Braun, 13.12.2006
Medikamenten-Beipackzettel: Viele US-Amerikaner haben Verständnisprobleme
 Erst vor kurzem hatte eine Studie des Wissenschaftlichen Instituts der AOK (WIdO) Packungsbeilagen der 100 am häufigsten verordneten Arzneimittel kritisch unter die Lupe genommen und Verbraucher nach ihren Einschätzungen hierzu befragt. Das eindeutige Urteil: Gebrauchsinformationen von Arzneimitteln sind nach dem Urteil von Experten ebenso wie von Patienten zu lang, schwer lesbar und oft unverständlich. (Siehe den Bericht in Forum Gesundheitspolitik Rubrik Patienteninformation: Medikamenten-Beipackzettel: Zu lang, unverständlich, angsteinflößend) .
Erst vor kurzem hatte eine Studie des Wissenschaftlichen Instituts der AOK (WIdO) Packungsbeilagen der 100 am häufigsten verordneten Arzneimittel kritisch unter die Lupe genommen und Verbraucher nach ihren Einschätzungen hierzu befragt. Das eindeutige Urteil: Gebrauchsinformationen von Arzneimitteln sind nach dem Urteil von Experten ebenso wie von Patienten zu lang, schwer lesbar und oft unverständlich. (Siehe den Bericht in Forum Gesundheitspolitik Rubrik Patienteninformation: Medikamenten-Beipackzettel: Zu lang, unverständlich, angsteinflößend) .
Diese Befunde wurden jetzt auch in den USA bestätigt. In einem in der Zeitschrift Annals of Internal Medicine veröffentlichten Aufsatz "Literacy and Misunderstanding Prescription Drug Labels" (Lesekompentenz und Missverständnisse bei Einnahmevorschriften für Medikamente) ließ man 395 englischsprachige US-Amerikaner die Beipackzettel für verschiedene Medikamente (die Antibiotika Amoxicillin und Trimethoprim, das Expektorans Guaifenesin, das Bluthochdruckmedikament Felodipin und das Diuretikum Furosemid) lesen und sich dann die Dosierungsempfehlungen erläutern.
Als Ergebnis zeigte sich: Viele Patienten haben Verständnisprobleme und es dürfte daher zu problematischen Über- oder Unterdosierungen kommen. Die Vorschrift "Nehmen Sie zwei Tabletten durch den Mund zweimal täglich ein" ("Take two tablets by mouth twice daily") war zwar für 71 Prozent der Patienten mit niedrigem Bildungsniveau verständlich, aber die Gesamtzahl der täglich einzunehmenden Tabletten gaben nur 35 Prozent richtig an. Noch mehr Missverständnisse traten auf, wenn neben der Tagesdoss auf dem Beipackzettel auch noch die Dauer der Einnahme angegeben wurde. "Nehmen Sie zwei Tabletten durch den Mund zweimal täglich sieben Tage lang ein" - daraus wurde für viele Patienten: Eine Tablette täglich, über sieben Tage.
Sehr große Verständnisprobleme zeigten sich auch, wenn Warnhinweise angegeben waren wie z.B. die, in der ersten Stunde nach der Einnahme auf Milchprodukte zu verzichten. Diese Hinweise wurden insbesondere von Patienten mit niedrigem Bildungsniveau völlig übersehen. Insgesamt ergab sich zwar ein recht deutlicher Zusammenhang zwischen Bildungsniveau und korrektem Verständnis der Einnahmevorschriften. Gleichwohl zeigten sich auch noch bei höher gebildeten Patienten recht häufig Fehlinterpretationen. Die Autoren fordern daher sehr viel ausführlichere Informationen und erläuternde Beispiele für Beipackzettel. Auch sollten Ärzte ihren Patienten nach der Verschreibung noch einmal mündlich erklären, wann, wie oft und wie lange sie die Medikamente einnehmen sollen.
Der komplette Aufsatz ist hier nachzulesen: Literacy and Misunderstanding Prescription Drug Labels
Gerd Marstedt, 10.12.2006
"Black box"-Warnhinweise auf Arzneimittelrisiken werden von amerikanischen Ärzten oft ignoriert
 Die härteste Form eines Hinweises auf hohe Risiken von Medikamenten, den die us-amerikanische "Food and Drug Administration (FDA)" verbreitet, sind so genannte "Black Box Warnings" (BBWs). Bisher war allerdings unbekannt, wie oft und intensiv amerikanische Ärzte Arzneimittel mit BBWs verordnen und ob sie dabei die Warnhinweise beachten.
Die härteste Form eines Hinweises auf hohe Risiken von Medikamenten, den die us-amerikanische "Food and Drug Administration (FDA)" verbreitet, sind so genannte "Black Box Warnings" (BBWs). Bisher war allerdings unbekannt, wie oft und intensiv amerikanische Ärzte Arzneimittel mit BBWs verordnen und ob sie dabei die Warnhinweise beachten.
In einer retrospektiven Analyse der Abrechnungsdaten für 929.958 Krankenversicherten in 10 geographisch unterschiedlichen Krankenversicherungen im Zeitraum von Anfang 1999 bis Mitte 2001 brachte eine Gruppe von Pharmakologen, Ärzten und Sozialwissenschaftlern (Anita K. Wagner; K. Arnold Chan; Inna Dashevsky; Marsha A. Raebel; Susan E. Andrade; Jennifer Elston Lafata; Robert L. Davis; Jerry H. Gurwitz; Stephen B. Soumerai; Richard Platt)unter Leitung der Bostoner Wissenschaftlerin Anita Wagner , etwas Licht in dieses möglicherweise gefährliche Dunkel. Die am 18. November in der Onlineausgabe der Zeitschrift "Pharmacoepidemiology and Drug Safety" unter der Überschrift "FDA drug prescribing warnings: is the black box half empty or half full?" veröffentlichten Ergebnisse (kostenlos ist nur ein Abstract erhältlich) zeigen verbreitete Informations- und Informationsnutzungs-Defizite der Ärzte:
• Mehr als 40 Prozent der Versicherten erhielten mindestens eine Medikation, die einen BBW erhalten hatte, der sie potenziell betreffen hätte können.
• Die meisten Fälle der Nichtbefolgung dieser Art von Warnhinweisen bestanden darin, dass Therapien ohne die davor empfohlenen Laboruntersuchungen gestartet wurde. Bei 49,6 Prozent aller Therapien, bei denen eine solche Handlungsabfolge empfohlen wird, folgten die Ärzte nicht diesen Empfehlungen.
• Wenig Missachtungen von Warnhinweisen gab es immerhin bei absolut kontraindizierten Arzneimitteln während der Schwangerschaft.
Um die Kommunikation über Arzneimittelrisiken zu verbessern und solche Systeme wie die BBWs wirksamer zu machen, benötigt man nach Meinung der US-Forscher mehr Informationen über die Art und Weise wie Verordnungen im Behandlungsalltag eingesetzt werden. Außerdem muss man viel mehr darüber wissen, welche Einflüsse im wesentlichen die Verordnungsweise von Ärzten beeinflussen und ihnen helfen, sich an Sicherheitsempfehlungen zu halten.
Empfohlen wird u.a., die BBWs einheitlicher und schematischer zu gestalten, um in kürzester Zeit auf eindeutig wichtige Warnhinweise stoßen zu können. Ein anderer Weg erscheint den Wissenschaftlern ebenfalls gangbar: Die Patienten sollten dann, wenn sie die Arzneimittel erhalten, automatisch einen Hinweis auf die Existenz von BBWs bekommen. Dies setzte allerdings eine entsprechend große und aktuelle Datenbank über die Risiken und Risikohinweise voraus.
Bernard Braun, 22.11.2005
Arzneimittel-Informationen für Ärzte: Veraltet, unvollständig oder ungenau
 Viele Patienten müssen regelmäßig zwei oder auch noch mehr verschiedene Medikamente einnehmen. Mögliche Wechselwirkungen zwischen den Medikamenten sind Ärzten und Apothekern in Deutschland jedoch oft nicht ausreichend bekannt, weil die ihnen zur Verfügung stehenden Fachinformationen veraltet, unvollständig oder ungenau sind. Zu diesem Ergebnis kommt jetzt eine Studie von Professor Dr. Walter Haefeli und seinen Mitarbeitern der Abteilung Innere Medizin VI, Klinische Pharmakologie und Pharmakoepidemiologie des Universitätsklinikums Heidelberg. Bei zwei Dritteln der von ihnen untersuchten Arzneimittelkombinationen entsprachen die Fachinformationen nicht dem aktuellen Stand der Wissenschaft. 16 Prozent der klinisch relevanten Wechselwirkungen wurden in den Fachinformationen überhaupt nicht erwähnt.
Viele Patienten müssen regelmäßig zwei oder auch noch mehr verschiedene Medikamente einnehmen. Mögliche Wechselwirkungen zwischen den Medikamenten sind Ärzten und Apothekern in Deutschland jedoch oft nicht ausreichend bekannt, weil die ihnen zur Verfügung stehenden Fachinformationen veraltet, unvollständig oder ungenau sind. Zu diesem Ergebnis kommt jetzt eine Studie von Professor Dr. Walter Haefeli und seinen Mitarbeitern der Abteilung Innere Medizin VI, Klinische Pharmakologie und Pharmakoepidemiologie des Universitätsklinikums Heidelberg. Bei zwei Dritteln der von ihnen untersuchten Arzneimittelkombinationen entsprachen die Fachinformationen nicht dem aktuellen Stand der Wissenschaft. 16 Prozent der klinisch relevanten Wechselwirkungen wurden in den Fachinformationen überhaupt nicht erwähnt.
Ausgangspunkt der Studie waren die Antworten von über 1.200 Allgemeinmedizinern in Deutschland auf die Frage, welche Arzneimittelkombinationen ihrer Ansicht nach Wechselwirkungen hervorriefen. Die 65 Substanzen, die dabei mindestens dreimal genannt wurden, bildeten die Basis der Studie. 579 Zweierkombinationen dieser Substanzen, deren Wechselwirkungen auch in mindestens zwei der drei internationalen wissenschaftlichen Standardquellen als klinisch bedeutsam eingestuft sind, wurden dann in die Studie einbezogen. Die Wissenschaftler untersuchten dann Fachinformationen für jede der 579 Kombinationen nach mehreren Kriterien. - Bei 91 Kombinationen fehlte ein Hinweis auf Wechselwirkungen - Die Wechselwirkungen der 488 verbliebenen Kombinationen werden 102 mal in verfälschender Weise auf die gesamte Substanzklasse statt auf deren spezifische Substanzen bezogen, deren chemische Struktur sich oft erheblich unterscheidet - Von den 386 verbliebenen Kombinationen fallen 30 durch ungenügende Erläuterung ihrer pharmakologischen Effekte auf - Nur für 251 der 356 verbliebenen Kombinationen werden in den Fachinformationen die richtigen ärztlichen Maßnahmen empfohlen.
Nur für 192 Arzneimittelkombinationen entspricht die Qualität der Fachinformationen demnach dem Stand der Wissenschaft. Ein Abgleich dieses Befundes mit den Verschreibungsdaten für 4.949 ambulante Patienten ergab, dass immerhin 224 dieser Patienten mit fehlerhaft charakterisierten Arzneimittelkombinationen behandelt werden. "Über die Folgen dieser Mängel der Fachinformationen zu spekulieren ist fast unmöglich", betont Professor Haefeli. Dafür gäbe es zu viele unbekannte Variablen und auch klare methodische Grenzen der eigenen Studie. Die Fachinformation oder "Summary of Product Characteristics" (SPC) ist ein gesetzlich vorgeschriebener und haftungsrechtlich bindender Bestandteil der Zulassungsunterlagen für jedes neue Medikament, aus der auch der Beipackzettel abgeleitet wird. Sie ist für Ärzte und Apotheker in Deutschland frei über das Internet zugänglich und wird besonders häufig von Allgemeinmedizinern häufig als Entscheidungshilfe beim Verschreiben von Arzneimitteln konsultiert.
Die Studie ist veröffentlicht im European Journal of Clinical Pharmacology (2005 Jul;61(5-6):327-35. Epub 2005 Jun 28): Bergk, Haefeli, Gasse, Brenner, Martin-Facklam: Information deficits in the summary of product characteristics preclude an optimal management of drug interactions: a comparison with evidence from the literature. Der Artikel kann bei der Pressestelle des Universitätsklinikums Heidelberg unter contact@med.uni-heidelberg.de angefordert werden.
Eine Zusammenfassung der Ergebnisse ist hier zu finden: In den Fachinformationen von Arzneimitteln fehlen häufig wichtige Informationen für Ärzte und Apotheker
Gerd Marstedt, 20.11.2005
Medikamenten-Beipackzettel: Zu lang, unverständlich, angsteinflößend
 "Zu Risiken und Nebenwirkungen lesen Sie die Packungsbeilage und fragen Sie Ihren Arzt oder Apotheker." Dieser Satz ist jedem Verbraucher und Patienten aus Presse, Funk und Fernsehen allzu bekannt. Eine Studie des Wissenschaftlichen Instituts der AOK (WIdO) ist diesem Ratschlag jetzt nachgegangen. Sie nimmt die Packungsbeilagen der 100 am häufigsten verordneten Arzneimittel kritisch unter die Lupe und hat Verbraucher nach ihren Einschätzungen hierzu befragt. Das eindeutige Urteil: Gebrauchsinformationen von Arzneimitteln sind nach dem Urteil von Experten ebenso wie von Patienten zu lang, schwer lesbar und oft unverständlich.
"Zu Risiken und Nebenwirkungen lesen Sie die Packungsbeilage und fragen Sie Ihren Arzt oder Apotheker." Dieser Satz ist jedem Verbraucher und Patienten aus Presse, Funk und Fernsehen allzu bekannt. Eine Studie des Wissenschaftlichen Instituts der AOK (WIdO) ist diesem Ratschlag jetzt nachgegangen. Sie nimmt die Packungsbeilagen der 100 am häufigsten verordneten Arzneimittel kritisch unter die Lupe und hat Verbraucher nach ihren Einschätzungen hierzu befragt. Das eindeutige Urteil: Gebrauchsinformationen von Arzneimitteln sind nach dem Urteil von Experten ebenso wie von Patienten zu lang, schwer lesbar und oft unverständlich.
Im einzelnen zeigen die Ergebnisse:
• zwei Drittel der Befragten bewerten die Packungsbeilage als wichtige Informationsquelle und lesen sie auch meistens
• jeder Dritte fühlt sich durch die Informationen verunsichert
• nicht ganz jeder Dritte hat ein Medikament schon einmal wegen dieser Informationen abgesetzt oder gar nicht erst genommen
• vier von zehn Verbrauchern bewerten die Informationen als zu lang.
Auch die Experten des WIdO nahmen die Beipackzettel unter die Lupe und bewerteten sie als wenig patientenfreundlich: Zu viele Information, zu kleine Schriftgrössen (kein einziger der 100 untersuchten Zettel hat die Mindest-Schriftgrösse von 8 Punkten), ein Viertel der Fremdwörter war ohne Übersetzung. Die Studie belässt es aber nicht bei Kritik, sondern stellt auch "goldene Regeln" für bessere Medikamenten-Informationen auf und hat auch für das (imaginäre) Medikament "Clarum" einen Muster-Beipackzettel vorgestellt.
• Die komplette Studie von Katrin Nink und Helmut Schröder: Zu Risiken und Nebenwirkungen: Lesen Sie die Packungsbeilage? (WIdO-Materialien Bd. 53, Bonn 2005) ist beim WIdO für 13,00 Euro erhältlich.
• Frei abrufbar ist eine kurze Zusammenfassung der wichtigsten Ergebnisse.
• Ferner gibt es beim AOK-Bundesverband eine Website "Schluss mit Hieroglyphen in Beipackzetteln", auf der umfangreiche Pressematerialien heruntergeladen werden können.
Gerd Marstedt, 5.11.2005