



Home | Patienten | Gesundheitssystem | International | GKV | Prävention | Epidemiologie | Websites | Meilensteine | Impressum
Sämtliche Rubriken in
"Patienten"
Einflussnahme der Pharma-Industrie |
Verhaltenssteuerung (Arzt, Patient), Zuzahlungen, Praxisgebühr |
Alle Artikel aus:
Patienten
Einflussnahme der Pharma-Industrie
Anwendungsbeobachtungen erhöhen die Arzneimittelausgaben
 Über Anwendungsbeobachtungen von Arzneimitteln, die von einem Hersteller veranlasst werden, haben wir mehrfach kritisch berichtet. Dieser Beitrag aus 2007 hat nach wie vor weitgehend Gültigkeit.
Über Anwendungsbeobachtungen von Arzneimitteln, die von einem Hersteller veranlasst werden, haben wir mehrfach kritisch berichtet. Dieser Beitrag aus 2007 hat nach wie vor weitgehend Gültigkeit.
Anwendungsbeobachtungen (AWB) sind eine Form der nichtinterventionellen Studien, die zumeist vom Hersteller der zu untersuchenden Substanz veranlasst und finanziert werden. Der Lobbyverband der forschenden Parma-Unternehmen bezeichnet AWB auch heute noch als "unverzichtbares Instrument für die Arzneimittelforschung" und ignoriert dabei Studien, wie die von Spelsberg et al. aus dem Jahr 2017. Eine Analyse von 558 AWBs konnte keinen nennenswerten Wissensgewinn für die Arzneimittelsicherheit entdecken; bemerkenswert war auch, dass weniger als 1% der Studien in einer Fachzeitschrift veröffentlicht wurden.
Eine neue Studie hat jetzt die lange gehegte Vermutung bestätigt, dass AWB sich auf das Verschreibungsverhalten der teilnehmenden Ärzte in dem Sinne auswirkt, dass sie das von ihnen in der AWB untersuchte Medikament nach Beendigung der AWB häufiger verschreiben als nicht teilnehmende Ärzte. Da in AWB vorzugsweise hochpreisige Medikamente untersucht werden, folgen daraus höhere Kosten für die gesetzliche Krankenversicherung. Fehlender Erkenntnisgewinn aber erhöhte Verschreibung unterstreichen die Annahme, dass es sich bei Hersteller-gesponserten AWBs um ein Marketinginstrument handelt und nicht um seriöse wissenschaftliche Forschung.
In dieser Studie verglichen die Autoren das Verschreibungsverhaltens von 2354 Ärzten, die an einer von 24 AWBs teilgenommen hatten, mit 6996 Ärzten ohne Beteiligung an einer AWB. Die Daten wurden vom GKV-Spitzenverband zur Verfügung gestellt, an den jede AWB vor Beginn gemeldet werden muss mit dem Datum von Beginn und Ende, dem Ziel der Studie, den Namen und der lebenslangen Arztnummer der teilnehmenden Ärzte, dem Studienplan, der Vergütung der Ärzte und einem Vertragsmuster. Das arztindividuelle Verschreibungsverhalten wurde über die Arzneimittel-Schnellinformation für Vertragsärztinnen und -ärzte des GKV-Spitzenverbandes bestimmt.
Primärer Endpunkt war der Vergleich der Verschreibungen von AWB-ÄrztInnen mit den Verschreibungen der Vergleichsgruppe 1 Jahr vor, während und 1 Jahr nach der AWB.
Sekundärer Endpunkt war der Anteil der Verschreibungen für das Studienmedikament im Vergleich zu alternativen Medikamenten und der Umsatz, der durch die Verschreibungen generiert wurde.
In den 24 AWBs wurden am häufigsten Krebsmedikamente und Medikamente zur Beeinflussung des Immunsystems sowie Medikamente bei neurologischen Erkrankungen eingesetzt. Ärzte, die an AWBs teilnahmen, verschrieben 8 bzw. 7% mehr von dem untersuchten Medikament während und ein Jahr nach Beendigung der Studie. Andere Medikamente für dieselbe Krankheit verschrieben sie seltener.
Die Autoren merken an, dass AWBs wenig reguliert sind, nur gemeldet aber nicht genehmigt werden müssen, keine Einverständniserklärung der einbezogenen Patienten erfordern aber die Behandlung der Patienten verändern. Erlaubt sollten nur solche Studien ein, die von der Zulassungsbehörde veranlasst werden bzw. über ein wissenschaftlich solides Design verfügen, das geeignet ist, Daten zu erheben, die für Patienten und ihre Sicherheit relevant sind.
Koch C, Schleeff J, Techen F, Wollschläger D, Schott G, Kölbel R, et al. Impact of physicians' participation in non-interventional post-marketing studies on their prescription habits: A retrospective 2-armed cohort study in Germany. PLOS Medicine. 2020;17(6):e1003151. Link
Spelsberg A, Prugger C, Doshi P, Ostrowski K, Witte T, Hüsgen D, et al. Contribution of industry funded post-marketing studies to drug safety: survey of notifications submitted to regulatory agencies. BMJ. 2017;356. Link
David Klemperer, 29.6.20
Medizinische Leit- oder Leidlinien? Wie unabhängig und interessenkonfliktfrei oder -reduziert sind Leitlinien?
 Die Anzahl medizinischer Leitlinien nimmt auch in Deutschland kontinuierlich zu und sie gehören zunehmend zum Repertoire der Qualitätssicherung in Krankenhäusern und Praxen niedergelassener Ärzt*innen.
Die Anzahl medizinischer Leitlinien nimmt auch in Deutschland kontinuierlich zu und sie gehören zunehmend zum Repertoire der Qualitätssicherung in Krankenhäusern und Praxen niedergelassener Ärzt*innen.
Dass daher auch die Hersteller von Arzneimittel und anderen Therapeutika daran interessiert sind was dort u.a. von Fachgesellschaften empfohlen oder wovon abgeraten wird, und versuchen die Erstellung durch unterschiedlichste Mittel (z.B. firmengesponserte Mitglieder der Leitliniengremien) zu ihren Gunsten zu beeinflussen, ist mehrfach belegt.
Wie stark oder intensiv dies der Fall ist, untersucht und dokumentiert das von Neurology first, MEZIS Mein Essen zahle ich selbst. Initiative unbestechlicher Ärztinnen und Ärzte und Transparency Deutschland getragene Projekt Leitlinienwatch.de für derzeit 152 von den in der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) zusammengeschlossenen medizinischen Fachgesellschaften und 11 der von der European Society of Cardiology (ESC) erstellten Leitlinien zu bewerten.
Im Mittelpunkt der Überprüfung steht auf der Grundlage der publizierten Angaben zum Umgang mit Interessenkonflikten in der jeweiligen Leitlinie und im begleitenden Leitlinienreport die Unabhängigkeit von Herstellern der jeweils behandlungsrelevanten Therapeutika bzw. die Anzahl und Art von Interessenkonflikten. Zu den Kriterien zählen die Transparenz des Leitlinienprozesses, die Zusammensetzung der Leitliniengruppe, die Unabhängigkeit der Vorsitzenden/federführenden Autoren, Enthaltung von Personen mit Interessenkonflikten bei Abstimmungen und die externe Beratung der Leitlinie. Je Kriterium werden 3 Punkte vergeben, was zu maximal 15 Punkten führt. Für spezielle Maßnahmen zur Reduzierung von Interessenkonflikten gibt es zusätzlich 3 Bonuspunkte. Als "gut" im Sinne fehlender oder stark reduzierter Interessenkonflikte als Indikator für Unabhängigkeit gelten Leitlinien mit 11-18 Punkten, mit einem "Achtung!" werden Leitlinien mit 6-10 Punkten bewertet und "Reformbedarf" sehen die Leitlinienwatch-Expert*innen (zwei Gutachter von denen mindestens eine(r) Arzt oder Ärztin ist) bei Leitlinien mit 0 bis 5 Punkten. Die Punktevergabe wird auch knapp begründet.
Die aktuellen Ergebnisse sehen so aus:
• Von den 152 AWMF-Leitlinien sind 19% gut, bei 43% heißt es Achtung! und bei 38% besteht Reformbedarf. Der Median liegt bei 6 von maximal 18 möglichen Punkten
• Die 11 ESC-Leitlinien weisen alle Reformbedarf auf und erreichen durchschnittlich 3 Punkte (Median).
Den Minimalwert von einem Punkt erreichen z.B. die Leitlinie "Brennen beim Wasserlassen" der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) oder die Leitlinie "Diagnostik, Therapie und Verlaufskontrolle des Diabetes mellitus im Alter" der Deutschen Diabetes Gesellschaft (DDG). Die Leitlinie "Prävention des Zervixkarzinoms" der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) liegt mit 8 Punkten im Mittelfeld. Derzeitiger Spitzenreiter mit 15 von 18 Punkten ist die "Nationale Versorgungsleitlinie Herzinsuffizienz".
An ihrer Bewertung ist bemerkenswert, dass nicht bereits die bloße Existenz von Interessenkonflikten bei Leitlinienwatch zu einer negativen Bewertung führt, sondern sehr differenziert auch der Umgang mit ihnen in die Bewertung einfließt. Die "Bestnote" erhält diese Leitlinie "obwohl 20 von 35 Leitlinienautoren Interessenkonflikte angaben. Aus dem Kommentar: 'Interessenkonflikte werden detailliert dokumentiert, in der Leitliniengruppe diskutiert und führen zu einigen Enthaltungen. Auch sonst werden verschiedene Maßnahmen zur Reduktion industrieller Einflussnahme getroffen. Darunter sind insbesondere die unabhängige Leitlinienkoordination sowie die Evidenzaufbereitung durch unabhängige Methodiker des ÄZQ positiv hervorzuheben. Kritikwürdig bleibt der hohe Anteil der kardiologischen Experten mit mutmaßlich Leitlinien-relevanten Interessenkonflikten. Die Heranziehung der erheblich interessenkonfliktbelasteten ESC- und anderer kardiologischer Leitlinien als Quell-Leitlinien ist aus unserer Sicht nicht unproblematisch. Jedoch werden nach unseren Stichproben diese Quellen kritisch und differenziert bewertet. Insgesamt enthält diese Leitlinie viele gute Maßnahmen zum adäquaten Umgang mit Interessenkonflikten.'"
Bernard Braun, 2.5.20
Die pharmazeutische Industrie in den USA - kritische Analysen
 Eine Schwerpunktausgabe des Journal of the American Medical Association vom 3. März 2020 befasst sich in mehreren Studien, Editorials und Kommentaren mit Strategien der Gewinnmaximierung und politischen Einflussnahme der pharmazeutische Industrie in den USA.
Eine Schwerpunktausgabe des Journal of the American Medical Association vom 3. März 2020 befasst sich in mehreren Studien, Editorials und Kommentaren mit Strategien der Gewinnmaximierung und politischen Einflussnahme der pharmazeutische Industrie in den USA.
Einige Kernergebnisse:
Pharmazeutische Firmen
• erwirtschaften höchste Profite
• erhöhen die Preise für ihre Produkte unaufhörlich
• übertreiben die Entwicklungskosten von Medikamenten zur Rechtfertigung überhöhter Preise
• nehmen gezielt Einfluss auf Politiker und Parteien.
Die Analyse von Ledley et al. zeigt, dass große pharmazeutische Unternehmen deutlich profitabler sind als große nicht pharmazeutische Unternehmen. Sie verglichen unterschiedliche Maße der Profitabilität von 35 großen pharmazeutischen Unternehmen mit 357 der größten nicht-pharmazeutischen börsennotierten US-amerikanischen Unternehmen aus dem S&P 500 Index. Im Zeitraum 2000 bis 2018 war der Nettogewinn (net income margin) der pharmazeutischen Unternehmen mit 13,8% fast doppelt so hoch im Vergleich zum Nettogewinn der nicht-pharmazeutischen Unternehmen mit 7,7%.
Hernandez et al. untersuchten, in welchem Ausmaß die Hersteller von Medikamenten in den USA die Preise für ihre Produkte im Zeitraum von 2007 bis 2018 erhöhten. Sie unterschieden zwischen dem Listenpreis, den der Hersteller für Großhändler und Direktabnehmer festsetzt und dem Nettopreis, in den Rabatte und andere Formen von Preisnachlässen eingehen. Untersucht wurden 602 Markenprodukte, die unterschiedlichen Indikationsgruppen zugeordnet wurden. Die Listenpreise stiegen insgesamt um 159%, entsprechend 9,1% pro Jahr. Die Nettopreise stiegen um 60%, entsprechend 4,5% pro Jahr. Multiple Sklerose-Medikamente verteuerten die Hersteller am meisten (Listenpreis 439%, Nettopreis 157%), gefolgt von Blutfett-senkenden Medikamenten (Listenpreis 278%, Nettopreis 95%) und Insulinen (Listenpreis 278%%, Nettopreis 51%). In einem Kommentar merken Deb und Curfman an, dass die Firmen die Erhöhung von Listenpreisen mit gleichzeitiger Rabattierung der Abwehr von Konkurrenzprodukten und der günstigen Positionierung des eigene Produkts dient. Patienten erhalten keine Ermäßigungen, insbesondere müssten Nichtversicherte sowie Versicherte mit hohem Selbstbehalt Listenpreise bezahlen. Sie weisen auch auf eine Befragung der Kaiser Family Foundation hin, der zufolge viele Patienten Schwierigkeiten haben, die Kosten für Medikamente aufzubringen - 35% sind es unter denen, die mehr als 3 Medikamente einnehmen müssen, bei den über 65-Jährigen mit subjektiv schlechter Gesundheit sind es 49%.
Wouters et al. berechneten die Kosten, die für ein neues Medikament bis zur Marktzulassung in den USA entstehen. Dafür werteten sie 63 Substanzen von 47 Firmen aus, für die öffentlich zugängliche Daten vorlagen. Die Zulassung erfolgte zwischen 2009 und 2018. Die Kosten für Forschung und Entwicklung betrugen im Durchschnitt 1,4 Mrd. Dollar, im Median 985 Mio. Dollar. Die Berechnungen unterscheiden sich für unterschiedliche therapeutische Bereiche und sind für Krebsmedikamente am mit durchschnittlichen Kosten höchsten. Eine von der Industrie häufig genannte Zahl liegt mit 2,8 Mrd. Dollar (in 2018 US Dollar) wesentlich höher, sie beruht auf einer 2013 veröffentlichten Studie eines Industrie-nahen Institutes, das die Berechnungen mit dem Argument der Vertraulichkeit von Daten nicht offen legte.
In einer weiteren Studie untersuchten Wouters et al. die Frage, wie viel Geld die pharmazeutische Industrie in den USA ausgab, um Einfluss auf Wahlen und Gesetzgebung auf Bundesebene und auf Bundesstaatenebene auszuüben. Grundlage waren Daten für die Jahre von 1999 bis 2018, die vom Center for Responsive Politics und vom National Institute on Money in Politics erhältlich waren. Auf Bundesebene betrugen die Zahlungen von 1999 bis 2018 insgesamt 4,7 Mrd. Dollar, entsprechend einem Jahresdurchschnitt von 233 Mio. Dollar. Im Vergleich zu den Lobby-Bemühungen aller anderen Industriezweigen sind dies die höchsten Geldbeträge. Die Pharmaceutical Research and Manufacturers of America waren der größte Einzelgeldgeber. Kandidaten für die Präsidentschaftswahlen und für die Kongresswahlen sowie Nationale Parteikomitees erhielten insgesamt 414 Mio. Dollar, davon Präsidentschaftskandidaten 22 Mio. Dollar und Kongresskandidaten 214 Mio. Dollar. Besonders bedacht wurden Mitglieder des Senats und des Repräsentantenhauses, die mit der der Gesundheitsgesetzgebung befasst sind. Auf der Ebene der Bundesstaaten zahlte die Industrie 877 Mio. Dollar an Kandidaten und Parteikomitees. Die Zahlungen stiegen sprunghaft an, wenn Gesetzgebung zur Regulation der Medikamentenpreise anstand. In diesem Zusammenhang ist es wenig verwunderlich, wie Deb und Curman. anmerken, dass Gesetzesvorhaben, die zu Preissenkungen bei Medikamenten führen würden, von Mitch McConnell, dem republikanischen Mehrheitsführer im Senat, als "sozialistische Preiskontrollen" abgekanzelt werden.
Ledley, F. D., McCoy, S. S., Vaughan, G., & Cleary, E. G. (2020). Profitability of Large Pharmaceutical Companies Compared With Other Large Public Companies. JAMA, 323(9), 834-843. doi:10.1001/jama.2020.0442 Link
Wouters, O. J., McKee, M., & Luyten, J. (2020). Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009-2018. JAMA, 323(9), 844-853. doi:10.1001/jama.2020.1166 Link
Wouters, O. J. (2020). Lobbying Expenditures and Campaign Contributions by the Pharmaceutical and Health Product Industry in the United States, 1999-2018. JAMA Internal Medicine. doi:10.1001/jamainternmed.2020.0146 Link
Hernandez, I., San-Juan-Rodriguez, A., Good, C. B., & Gellad, W. F. (2020). Changes in List Prices, Net Prices, and Discounts for Branded Drugs in the US, 2007-2018. JAMA, 323(9), 854-862. doi:10.1001/jama.2020.1012 Link
Deb, C., & Curfman, G. (2020). Relentless Prescription Drug Price Increases. JAMA, 323(9), 826-828. doi:10.1001/jama.2020.0359 Link
David Klemperer, 5.3.20
Wie die Familie Sackler trotz der Mitverantwortung für 300.000 Tote noch lange als Kultursponsor und Philantrop geschätzt wurde.
 Die selbst in der Vergangenheit extrem medikamenten-und heroinabhängige Künstlerin Nan Goldin und einige andere KünstlerInnen machen seit Anfang 2019 zumindest auf den Feuilletonseiten dadurch Schlagzeilen, dass sie Museen und anderen Kunsteinrichtungen (z.B. dem Guggenheim Museum in New York oder der National Portait Gallery in London) mit Boykott drohen, wenn sie nicht auf die Millionen Dollar oder Pfund schwere Förderung durch die Familie Sackler aus den USA verzichten. Diese Familie gehört seit langem zu den weltweit größten und vielfach gewürdigten Sponsoren zahlreicher Museen und Universitätseinrichtungen, sodass es bis heute u.a. einen Sackler-Flügel im Metropolitan Museum of Art in New York, eine Sackler-Bibliothek an der Universität Oxford und ausgerechnet eine Sackler-Medizinfakultät an der Universität Tel Aviv gibt.
Die selbst in der Vergangenheit extrem medikamenten-und heroinabhängige Künstlerin Nan Goldin und einige andere KünstlerInnen machen seit Anfang 2019 zumindest auf den Feuilletonseiten dadurch Schlagzeilen, dass sie Museen und anderen Kunsteinrichtungen (z.B. dem Guggenheim Museum in New York oder der National Portait Gallery in London) mit Boykott drohen, wenn sie nicht auf die Millionen Dollar oder Pfund schwere Förderung durch die Familie Sackler aus den USA verzichten. Diese Familie gehört seit langem zu den weltweit größten und vielfach gewürdigten Sponsoren zahlreicher Museen und Universitätseinrichtungen, sodass es bis heute u.a. einen Sackler-Flügel im Metropolitan Museum of Art in New York, eine Sackler-Bibliothek an der Universität Oxford und ausgerechnet eine Sackler-Medizinfakultät an der Universität Tel Aviv gibt.
Das Geld, das die überwiegend aus Ärzten bestehende Familie verteilte, stammt nicht aus erfolgreicher hausärztlicher Tätigkeit oder vergleichbaren Tätigkeiten, sondern aus den Milliarden-Gewinnen der dieser Familie mehrheitlich gehörenden US-Pharmafirma Purdue Pharma. Auf den ersten Blick würde aber noch nicht die aktuellen Boykotte rechtfertigen.
Diese stützen sich vielmehr darauf, dass diese Firma und persönlich ihre Eigentümer bewusst und zum Teil vorsätzlich die Herstellung und aktive sowie über die Risiken der Verordnung hinwegtäuschende Vermarktung des morphiumähnlichen Schmerzmedikaments Oxycontin zu verantworten haben. Dabei nahmen sie die Abhängigkeit von Millionen von Menschen und den Tod von zig- oder gar hunderttausenden von Menschen billigend in Kauf und verdienten damit Milliarden von US-Dollars.
Die Geschichte dieses Pharmaskandals hat in zweierlei Hinsicht gesundheitspolitischen und -wissenschaftlichen Lehrstückcharakter:
• Egal, ob es um die Herstellung und den Vertrieb verschleißträchtiger Silikon-Brustimplantate oder nebenwirkungsmächtiger Arzneimittel geht, wird die kritische öffentliche Debatte oft durch das Stereotyp des "grundbösen" profitgierigen Unternehmens oder Unternehmers geprägt. Dies ist eine Art Fortsetzung des in den 60-er und 70-er Jahren weit verbreiteten Bildes vom dickbäuchigen, zigarrerauchenden, melonetragenden kurz völlig unsympathischen Kapitalisten. Undenkbar, dass solche "Typen" gleichzeitig kulturfördernde und weltweit angesehene Philantropen sind. Aber genau dies waren im Lichte der Öffentlichkeit die Mitglieder der Familie Sackler trotz aller langsam bekannt gewordenen Details ihrer Unternehmertätigkeit über viele Jahre. Sie passten einfach nicht in das Bild des "bösen" Unternehmens oder Unternehmers, was u.a. dazu beitrug, dass ihr eigentliches Image von niemand aktiv wahrgenommen wurde und fast niemand störte, also nicht zu Boykotten und anderen Maßnahmen führte. Und dies selbst dann als der US-Präsident Trump bereits im August 2017 wegen der u.a. durch Oxycontin in den USA verursachten Opioid-Epidemie den nationalen Notstand ausrief.
• Die Firma steht mittlerweile wegen der Vermarktung ihres Medikaments vielfach vor Gericht und muss in den USA Strafen in Höhe von mehreren hundert Millionen Dollars bezahlen. Für die Debatte über die Kommunikation gesundheitlich riskanter Mittel und Maßnahmen stellt sich aber die Frage warum es erst 10 bis 20 Jahren nach den ersten wissenschaftlichen Aufsätzen zu den Risiken von Oyxcontin und vergleichbaren Medikamenten (vgl. unter zahlreichen anderen den 2009 erschienenen Aufsatz The Promotion and Marketing of OxyContin: Commercial Triumph, Public Health Tragedy von Ard van Zee in der Zeitschrift "American Journal of Public Health" (Februar 2009; 99(2): 221-227 und die dort zitierten weiteren Veröffentlichungen seit Ende der 1990er Jahre) und komplett kostenlos erhältlich), fast zwei Jahre nach Trumps Notstandserklärung (welche wirksamen Maßnahmen diese nach sich zog steht auf einem anderen Blatt), nach schätzungsweise 300.000 durch dieses Medikament mitbewirkten Toten in den USA und vollständiger und verständlicher journalistischer Darstellungen der durch Oxycontin verursachten und befeuerten Gesundheitsgefahren weltweit zu zivilgesellschaftlichen Reaktionen wie den eingangs geschilderten gegen die Hauptverantwortlichen kam. Verglichen mit dem bei wesentlich geringeren gesundheitsbezogenen unerwünschten Ereignissen in Sekundenschnelle aufziehenden Shitstorm in den so genannten sozialen Medien, handelt es sich, wenn es um die Sacklers und Oxycontin geht, höchstens um ein laues Lüftchen. Hinzu kommt in den Worten der Künstlerin Nan Goldin noch das: "Ich würde diese Nachricht (von der ersten kostenträchtigen Verurteilung im US-Bundesstaat Oklahoma - bb) begrüßen, wenn das Geld als Reparationen an die Menschen ginge, deren Leben die Sackler-Familie zerstört hat. 300.000 Menschen in diesem Land sind tot. (Die Familie) sollte in irgendeiner Weise für den Schaden aufkommen, den sie angerichtet hat." Trotz aller Opioid-Krisendebatte gibt es vor allem in den USA auch noch kaum regulative Maßnahmen gegen eine mögliche Wiederholung einer derartig "gelungenen" Vermarktung eines Medikaments.
Wer genauer wissen will, um was es geht und was einer kritischen Öffentlichkeit spätestens seit Herbst 2017 zugänglich war, kann dies mit zwei komplett kostenlos erhältlichen Texten tun.
Dies ist erstens der am 30. Oktober 2017 in der us-amerikanischen Zeitschrift "New Yorker" veröffentlichte brilliant recherchierte und sehr gut wie verständlich verfasste und an keiner Stelle widersprochene Essay The Family That Built an Empire of Pain. The Sackler dynasty's ruthless marketing of painkillers has generated billions of dollars—and millions of addicts. von Patrick Radden Keefe.
Zweitens ist dies der am 8. November 2018 in der britischen Tageszeitung "The Guardian" veröffentlichte Artikel The making of an opioid epidemic. When high doses of painkillers led to widespread addiction, it was called one of the biggest mistakes in modern medicine. But this was no accident. von Chris McGreal. Wer es lieber hören will, kann dies auch mit einem 27-Minuten-Podcast tun.
Bernard Braun, 29.3.19
Massive Interessenkonflikte bei Leitlinienautoren in den USA
 Interessenkonflikte bei Autoren von Leitlinien gefährden die Objektivität und Glaubwürdigkeit von Leitlinien (wir berichteten z.B. Link.
Interessenkonflikte bei Autoren von Leitlinien gefährden die Objektivität und Glaubwürdigkeit von Leitlinien (wir berichteten z.B. Link.
Khan et al. untersuchten jetzt, wie häufig in den USA Interessenkonflikte bei Autoren vorliegen, die an der Entwicklung von Leitlinien für umsatzstarke Arzneimitteln beteiligt waren. Darüber hinaus überprüften sie die Einhaltung von 3 der 8 Standards des Institute of Medicine zur Entwicklung von glaubwürdigen Leitlinien:
1. Schriftliche Offenlegung aller potentiellen Interessenkonflikte
2. Leitlinienengruppen-Vorsitzender ohne Interessenkonflikte
3. Mehrheit der Mitglieder der Leitliniengruppe ohne Interessenkonflikte
Im ersten Schritt identifizierten sie die 10 umsatzstärksten Medikamente des Jahres 2016 in den USA und im zweiten Schritt die dazugehörigen Leitlinien amerikanischer Fachgesellschaften aus den Jahren 2013 bis 2017. Dann überprüften sie die Zahlungen der Industrie an Leitlinien-Autoren. Eine Verpflichtung zur Meldung besteht für die pharmazeutische Industrie durch den Physician Payment Sunshine Act (wir berichteten, siehe z.B. Link. Diese Zahlungen sind öffentlich einsehbar in der Open Payment-Website der U.S. Centers for Medicare &Medicaid Services.
18 Leitlinien mit Bezug zu den 10 umsatzstarke Medikamenten wurden gefunden. An diesen Leitlinien waren insgesamt 160 US-amerikanische Autoren beteiligt. 79 Autoren (49,4%) gaben an, eine Zahlung erhalten zu haben, 50 (31%) von ihnen von Firmen, die eines der 10 umsatzstärksten Medikamente herstellt. Weitere 41 Autoren (25,6%) hatten Zahlungen von einer dieser Firmen erhalten aber nicht angegeben. Insgesamt lag bei 91 Autoren (56%) ein finanzieller Interessenkonflikt vor.
In keiner der 18 Leitlinien wurde der Standard der schriftlichen Offenlegung aller Interessenkonflikte erfüllt, nur 4 Leitliniengruppen hatten einen Vorsitzenden ohne finanziellen Interessenkonflikt und in nur 8 Leitliniengruppen war der Anteil der Mitglieder mit Interessenkonflikt auf weniger als 50% beschränkt.
Im Ergebnis hatte in den USA die Mehrzahl der Autoren von Leitlinien, die sich mit den umsatzstärksten Medikamenten befassten, finanzielle Interessenkonflikte, die sie teils nicht angaben. Darüber hinaus verfehlten die Leitliniengruppen die Erfüllung der Standards des Institute of Medicine für die Glaubwürdigkeit von Leitlinien beträchtlich.
Trotz vorbildlicher Offenlegung finanzieller Interessenkonflikte liegt die Entwicklung von Leitlinien in den USA offensichtlich darnieder.
Anzumerken ist hier, dass der Entwicklung von Leitlinien in Deutschland durch die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) eine stringente Methodik zur Minimierung von Bias durch Interessenkonflikte zugrunde liegt, über die in Kürze berichtet werden soll.
Khan R, Scaffidi MA, Rumman A, Grindal AW, Plener IS, Grover SC: Prevalence of financial conflicts of interest among authors of clinical guidelines related to high-revenue medications. JAMA Internal Medicine 2018. Abstract
David Klemperer, 31.10.18
10-jährige Kinder lernen kritisches Denken: wegweisende Studie zu Gesundheitswissen
 Aussagen darüber, was für die Gesundheit förderlich oder abträglich ist, sind im Alltag häufig. Menschen sollten dazu in der Lage sein, die Verlässlichkeit solcher Aussagen zu beurteilen.
Aussagen darüber, was für die Gesundheit förderlich oder abträglich ist, sind im Alltag häufig. Menschen sollten dazu in der Lage sein, die Verlässlichkeit solcher Aussagen zu beurteilen.
Dies ist der Ausgangspunkt einer Forschergruppe für die Entwicklung und Erprobung eines Schulungsprogramms, dem 12 Kernaussagen zugrunde liegen, u.a. folgende:
• Behandlungen können schädlich sein
• Persönliche Erfahrungen oder Anekdoten (Geschichten) sind in den meisten Fällen eine unzuverlässige Grundlage für die Beurteilung der Effekte von Behandlungen
• Weit verbreitete oder seit langer Zeit angewandte Behandlungen sind nicht notwendigerweise nützlich oder sicher
• Neue oder teurere Behandlungen oder Medikamente mit Markennamen sind nicht immer besser als vorhandene Alternativen
• Meinungen von Experten oder Autoritäten bilden allein keine ausreichende Grundlage, um über Nutzen und Schäden einer Behandlung zu entscheiden.
• Interessenkonflikte können zu irreführenden Aussagen über Behandlungsergebnisse führen.
• Die Bewertung der Effekte einer Behandlung erfordert angemessene Vergleiche
• Die Vergleichsgruppen müssen ähnlich sein ("Gleiches mit Gleichem vergleichen")
Zielgruppe waren Schülerinnen und Schüler in der 5. Klasse im Alter von 10 bis 12 Jahren in Grundschulen (primary schools) in der Zentralregion von Uganda.
Die Intervention umfasst folgende Elemente:
Materialien die von der Informed Health Choices-Gruppe entwickelt wurden:
• Ein Lehrbuch (The Health Choices Book)
• Ein Anleitungsbuch für Lehrer (Teachers' Guide for The Health Choices Book)
• Ein Übungsbuch für Kinder (Exercise Book. The Health Choices: Book Learning to think carefully about treatments).
• Die Lehrer nahmen an einem 2-tägigen Einführungsworkshop teil.
• Die Lehrer unterrichteten 9 Unterrichtseinheiten von je 80 Minuten während eines Schuljahres.
• Der Unterricht adressierte die 12 Kernaussagen, um Aussagen zu Gesundheitseffekten beurteilen und informierte Gesundheitsentscheidungen treffen zu können.
Den Effekt des Unterrichts auf die Kompetenz der Schülerinnen und Schüler untersuchten die Forscher in einer Cluster-randomisierten Studie. Die Interventionsgruppe bildeten 60 Schulen mit 76 Lehrern und 6383 Kindern, die Kontrollgruppe 60 Schulen mit 67 Lehrern und 4430 Kindern.
Messinstrument war ein Multiple Choice Test mit 24 Fragen (je 2 Fragen pro Kernaussage, siehe Appendix S. 18 ff.).
Gemessen wurde der Durchschnittswert zutreffender Antworten sowie die Bestehensquote, die auf mindestens 13 korrekte Antworten festgelegt wurde.
Der Durchschnittswert zutreffender Antworten lag in den Interventionsschulen bei 62,4% in den Kontrollschulen bei 43,1%. Die Bestehensquote betrug in den Interventionsschulen 69%, in den Kontrollschulen 27%. Die Ergebnisse sind statistisch hochsignifikant.
Die Forscher folgern, dass das die Intervention auf Grundlage der Informed Health Choices primary school learning-Ressourcen in Verbindung mit einem Einführungsworkshop für Lehrer bei Kindern zu einer starken Verbesserung der Fähigkeit führt, Aussagen über die Gesundheitseffekte von Behandlungen zu beurteilen. Die Ergebnisse zeigen, dass es möglich ist, Kindern kritisches Denken zu lehren in Schulen mit großen Klassen und wenig Ressourcen.
Künftige Studien sollten untersuchen
• Ausweitung des Gebrauchs der Ressourcen
• Langzeiteffekte incl. Gesundheitsentscheidungen
• Transfer in andere Länder
An dieser Studie waren neben afrikanischen und ugandischen Wissenschaftlern auch Urgesteine der Evidenzbasierte Medizin beteiligt: Iain Chalmers ist einer der Gründer der Cochrane Collaboration, Andrew Oxman ist einer der Autoren der wegweisenden "Users' guides to the medical literature"-Artikel-Serie im JAMA ab 1993.
Mit dem Schulungsprojekt ist es gelungen, Grundkonzepte kritischen Denkens in Gesundheitsfragen 10- bis 12-jährigen Kindern in Uganda nahezubringen. Diese Grundkonzepte sind Teil einer kritischen Gesundheitskompetenz ("critical health literacy"), die auch in Deutschland sowohl in der Bevölkerung als auch bei Professionellen verbesserungsfähig ist. In den aktuellen Bestrebungen, die Gesundheitskompetenz der Bevölkerung zu erhöhen (z.B. Allianz für Gesundheitskompetenz, Nationalen Aktionsplans Gesundheitskompeten), sollte diese wegweisende Studie angemessen gewürdigt und einbezogen werden.
Nsangi A, Semakula D, Oxman AD, Austvoll-Dahlgren A, Oxman M, Rosenbaum S, Morelli A, Glenton C, Lewin S, Kaseje M et al: Effects of the Informed Health Choices primary school intervention on the ability of children in Uganda to assess the reliability of claims about treatment effects: a cluster-randomised controlled trial. The Lancet 2017, 390(10092):374-388. Link
David Klemperer, 21.2.18
November 2017: Die Serie zu neuen Krebsmedikamenten besteht jetzt aus 7 Beiträgen
 Die Beiträge mit den zugrunde liegenden Studien geben ein recht konsistentes Bild: • Krebsmedikamente werden überwiegend auf Grundlage von Studien zugelassen, die keine oder nur unzureichende Aussagen über Mortalität, Morbidität und Lebensqualität enthalten.
Die Beiträge mit den zugrunde liegenden Studien geben ein recht konsistentes Bild: • Krebsmedikamente werden überwiegend auf Grundlage von Studien zugelassen, die keine oder nur unzureichende Aussagen über Mortalität, Morbidität und Lebensqualität enthalten.
• Wenn die Zulassungsbehörden ergänzende Studien fordern, kommen die Hersteller dem zumeist zögerlich oder gar nicht nach. Die Zulassungsbehörden lassen sich das gefallen.
• Die Preise für die neuen Krebsmedikamente sind exorbitant.
Neue Krebsmedikamente 1: Nutzen für Patienten fraglich, Preise exorbitant
Link.
Mailankody S, Prasad V. Five years of cancer drug approvals: Innovation, efficacy, and costs. JAMA Oncology 2015;1:539-40
Neue Krebsmedikamente 2: Leichtfertige Zulassung in den USA
Link.
Prasad V, Kim C, Burotto M, Vandross A: The strength of association between surrogate end points and survival in oncology: A systematic review of trial-level meta-analyses. JAMA Internal Medicine 2015
Neue Krebsmedikamente 3: "Durchbruch" in der Therapie weckt falsche Hoffnungen Link
Krishnamurti T, Woloshin S, Schwartz LM, Fischhoff B: A randomized trial testing us food and drug administration "breakthrough" language. JAMA Internal Medicine 2015, 175(11):1856-1858
Neue Krebsmedikamente 4: Wunder, Revolutionen und Durchbrüche - Superlative in der amerikanischen Presse häufig
Link
Abola MV, Prasad V: THe use of superlatives in cancer research. JAMA Oncology 2015:1-2
Neue Krebsmedikamente 5: Niedrige Zulassungshürden behindern Fortschritte in der Forschung
Link
Fojo T, Mailankody S, Lo A: Unintended consequences of expensive cancer therapeutics—the pursuit of marginal indications and a me-too mentality that stifles innovation and creativity: The John Conley Lecture. JAMA Otolaryngology-Head & Neck Surgery 2014, 140:1225-123
Neue Krebsmedikamente 6 - FDA: Hürde für Zulassung niedrig, kein Biss bei Postmarketing-Studien
Link
Kim, C., & Prasad, V. (2015). Cancer Drugs Approved on the Basis of a Surrogate End Point and Subsequent Overall Survival: An Analysis of 5 Years of US Food and Drug Administration Approvals. JAMA Intern Med, 175(12), 1992-1994. doi:10.1001/jamainternmed.2015.5868
Neue Krebsmedikamente 7 - EMA: Patientennutzen auch nach Jahren häufig unbekannt
Link
Davis, C., Naci, H., Gurpinar, E., Poplavska, E., Pinto, A., & Aggarwal, A. (2017). Availability of evidence of benefits on overall survival and quality of life of cancer drugs approved by European Medicines Agency: retrospective cohort study of drug approvals 2009-13. BMJ, 359. doi:10.1136/bmj.j4530
David Klemperer, 4.11.17
Neue Krebsmedikamente 7 - EMA: Patientennutzen auch nach Jahren häufig unbekannt
 In einer vor kurzem im British Medical Journal veröffentlichten Studie ging es um die Frage, ob bei Krebsmedikamenten zum Zeitpunkt der Zulassung durch Die Europäische Arzneimittel-Agentur EMA (European Medicines Agency) oder ggf. Jahre später Evidenz über den Patientennutzen vorlag. Als patientenrelevante Behandlungsendpunkte werden die Verlängerung des Lebens und die Verbesserung der Lebensqualität angesehen.
In einer vor kurzem im British Medical Journal veröffentlichten Studie ging es um die Frage, ob bei Krebsmedikamenten zum Zeitpunkt der Zulassung durch Die Europäische Arzneimittel-Agentur EMA (European Medicines Agency) oder ggf. Jahre später Evidenz über den Patientennutzen vorlag. Als patientenrelevante Behandlungsendpunkte werden die Verlängerung des Lebens und die Verbesserung der Lebensqualität angesehen.
In Jahren 2009 bis 2013 sprach die EMA 68 Zulassungen für Krebsmedikamente aus.
Art der Zulassung:
• neue Substanzen: 33
• Erweiterung der Indikation bereits zugelassener Medikamenten: 35
Art der Krebserkrankung;
• solide Tumoren (Brust, Lunge, Darm Prostata) 51
• hämatologische Erkrankungen 17
Ziel der Therapie
• kurativ 7
• nicht-kurativ 61
Zulassungsweg
• reguläre Zulassung (market authorisation) 58
• verkürzter Zulassungsweg (conditional market authorisation) 10
Für die 68 Zulassungen lagen insgesamt 72 Studien vor.
Nur 18 der 72 Studien untersuchten die Verlängerung des Lebens als primären Endpunkt, die übrigen 54 Studien untersuchten Surrogatendpunkte, die sich auf die biologische Aktivität eines Tumors beziehen, aber keine Aussage über den Patientennutzen erlauben.
Für 35 Studien lagen Ergebnisse zur Lebensqualität vor, in keiner Studie war die Lebensqualität als primärer Endpunkt definiert.
Für nur 24 der 68 Zulassungen lag zum Zeitpunkt der Zulassung Evidenz vor bezüglich
• Lebensverlängerung für 21 der 51 Zulassungen für solide Tumoren und für 3 der 17 Zulassungen für hämatologische Erkrankungen, wobei die Dauer der Lebensverlängerung zwischen 1,0 und 5,8 Monaten lag.
• Verbesserung der Lebensqualität für lediglich für 7 der 68 Zulassungen
Von den 68 Zulassungen erfolgten somit
• 44, ohne Evidenz für die Lebensverlängerung
• 61 ohne Evidenz für die Verbesserung der Lebensqualität.
Für gerade 29 der 68 Zulassungen (43%) lag somit Evidenz entweder für die Lebensverlängerung oder für die Verbesserung der Lebensqualität vor.
Die Untersuchung der Evidenzlage mehrere Jahre (zwischen 3,3 und 8,1 Jahren) nach der Zulassung ergab Folgendes:
• Von den 44 Zulassungen ohne Patientennutzen zum Zeitpunkt der Zulassung wurde für 3 Zulassungen eine Verlängerung der Lebenszeit und für 5 eine Verbesserung der Lebensqualität nachgewiesen. Für keine der 10 verkürzten Zulassungen lag zum Zeitpunkt der Zulassung oder Jahre danach Evidenz für eine Lebensverlängerung oder Verbesserung der Lebensqualität vor.
• Von den 23 Zulassungen mit Evidenz für einen Überlebensvorteil sind nach den Maßstäben der European Society for Medical Oncology nur 11 als klinisch bedeutsam zu bewerten.
Zusammenfassend ergibt sich folgendes Bild:
Für die Mehrzahl der Krebsmedikamente, die von der EMA eine Marktzulassung erhalten, ist nicht bekannt, ob und wenn ja welchen Nutzen die Patienten zu erwarten haben. Fehlende Kenntnisse sollten zwar in der Phase nach der Zulassung durch sog. Postmarketing-Studien gewonnen werden. Die EMA akzeptiert aber offensichtlich, dass die Hersteller hier nicht liefern.
Patienten erhalten somit Krebstherapien, mit unklarem Nutzen, die häufig sehr belastend sind und 5- bis 6-stelligen Eurobereich kosten.
Aus Sicht des Verfassers ist dies ein völlig unhaltbarer Zustand.
Davis, C., Naci, H., Gurpinar, E., Poplavska, E., Pinto, A., & Aggarwal, A. (2017). Availability of evidence of benefits on overall survival and quality of life of cancer drugs approved by European Medicines Agency: retrospective cohort study of drug approvals 2009-13. BMJ, 359. doi:10.1136/bmj.j4530 Link
Kommentar
Prasad, V. (2017). Do cancer drugs improve survival or quality of life? BMJ, 359. doi:10.1136/bmj.j4528 Link
David Klemperer, 4.11.17
Neue Krebsmedikamente 6 - FDA: Hürde für Zulassung niedrig, kein Biss bei Postmarketing-Studien
 Krebstherapien sollen das Leben von Kranken verlängern, darüber hinaus Beschwerden lindern, Komplikationen vermeiden und die Lebensqualität verbessern. Die Arzneimittelzulassungsbehörden legen ihren Entscheidungen über die Neuzulassung von Krebsmedikamenten jedoch häufig nicht diese patientenrelevanten Behandlungsendpunkte sondern Surrogatendpunkte zugrunde. Surrogatendpunkte messen z.B. die vorübergehende Verkleinerung eines Tumors (Ansprechrate) oder die Zeit bis zum Fortschreiten des Tumorwachstums (progressionsfreies Überleben). Dabei setzen die Zulassungsbehörden auf die Hoffnung, dass Medikamente, die auf Grundlage von Surrogatendpunkten zugelassen wurden, sich später als wirksam auf die Lebensdauer bzw. die Lebensqualität erweisen.. Um dies zu prüfen, verpflichtet die Zulassungsbehörde die Hersteller zu weitere Studien, sog. Postmarketing-Studien.
Krebstherapien sollen das Leben von Kranken verlängern, darüber hinaus Beschwerden lindern, Komplikationen vermeiden und die Lebensqualität verbessern. Die Arzneimittelzulassungsbehörden legen ihren Entscheidungen über die Neuzulassung von Krebsmedikamenten jedoch häufig nicht diese patientenrelevanten Behandlungsendpunkte sondern Surrogatendpunkte zugrunde. Surrogatendpunkte messen z.B. die vorübergehende Verkleinerung eines Tumors (Ansprechrate) oder die Zeit bis zum Fortschreiten des Tumorwachstums (progressionsfreies Überleben). Dabei setzen die Zulassungsbehörden auf die Hoffnung, dass Medikamente, die auf Grundlage von Surrogatendpunkten zugelassen wurden, sich später als wirksam auf die Lebensdauer bzw. die Lebensqualität erweisen.. Um dies zu prüfen, verpflichtet die Zulassungsbehörde die Hersteller zu weitere Studien, sog. Postmarketing-Studien.
Chul Kinnund und Vinay Prasad, zwei Amerikanische Onkologen, haben untersucht, wie hoch der Anteil von Surrogatendpunkten bei der Neuzulassung von Krebsmedikamenten durch die Food and Drug Administration (FDA) ist und inwieweit bei alleinigem Vorliegen von Surrogatendpunkte die Hersteller ihrer Pflicht nachkommen, die Verbesserung des Überlebens in weiteren Studien zu untersuchen.
Untersucht wurden alle 54 Neuzulassungen von Krebsmedikamenten durch die FDA von Anfang 2008 bis Ende 2012.
Surrogatendpunkte als Grundlage für die Zulassung akzeptierte die FDA bei 36 der 54 Substanzen (67%), und zwar bei allen 15 Substanzen im beschleunigten Zulassungsverfahrens und bei 21 von 39 Substanzen (54%) im traditionellen Zulassungsverfahren.
Die Ansprechrate akzeptierte die FDA bei 19 (53%) der 36 Neuzulassungen aufgrund von Surrogatendpunkten und das progressionsfreie Überleben 17 (47%).
Nach knapp 4 ½ Jahren wurde der Überlebensvorteil für 5 Medikamente in randomisierten kontrollierten Studien erbracht und zwar für eines der 15 Medikamente aus dem beschleunigten und für 4 der 21 Medikamente aus dem traditionellen Zulassungsverfahren.
Bei 18 Medikamenten zeigten randomisierte kontrollierte Studien keine Verbesserung des Überlebens und zwar in 6 der 15 Medikamente aus dem beschleunigten und für 12 der 21 Medikamente aus dem traditionellen Zulassungsverfahren.
Bei 13 Medikamenten bleibt unbekannt, ob sie die Überlebenszeit verlängern und zwar bei 8 der 15 Medikamente aus dem beschleunigten und bei 5 der 21 Medikamente aus dem traditionellen Zulassungsverfahren.
Zusammenfassend besteht bei 36 der 54 neu zugelassenen Krebsmedikamente kein Nachweis eines Überlebensvorteils vorliegt, insbesondere für keines der 15 beschleunigt zugelassenen Krebsmedikamente. Bezüglich der 36 Medikamente mit unbekanntem Nutzen zum Zeitpunkt der Zulassung liegen Jahre später Studien vor, die für 5 einen Überlebensvorteil und für 18 keinen Überlebensvorteil belegen. Für die übrigen 13 der 36 Medikamente haben die Hersteller auch nach Jahren keine aussagekräftigen Studien vorgelegt.
Bereits im Jahr 2009 hatte das U.S. Government Accountability Office (GOA), eine Aufsichtsbehörde des amerikanischen Kongresses, in einem Bericht grobe Mängel der FDA in der Handhabung von Postmarketing-Studien festgestellt. Es fehlten insbesondere Vorgehensweisen, Hersteller unter Druck zu setzen, die ihrer Verpflichtung, Postmarketing-Studien vorzulegen, nicht nachkommen. Auch fehlten Kriterien dafür, wann einem Medikament die Zulassung entzogen wird.
Kim, C., & Prasad, V. (2015). Cancer Drugs Approved on the Basis of a Surrogate End Point and Subsequent Overall Survival: An Analysis of 5 Years of US Food and Drug Administration Approvals. JAMA Intern Med, 175(12), 1992-1994. Link
United States Government Accountability Office (GOA). (2009). NEW DRUG APPROVAL. FDA Needs to Enhance Its Oversight of Drugs Approved on the Basis of Surrogate Endpoints. {Link}{http://www.gao.gov/products/GAO-09-866
David Klemperer, 4.11.17
...fragen sie ihren...Apotheker, aber was wenn der selber Antworten sucht und nicht findet?
 Ein nicht unbeträchtlicher Anteil aller Medikationsmittel werden nicht von Ärzten verordnet, sondern direkt von PatientInnen oder um ihre Gesunderhaltung besorgten Gesunden in Apotheken erworben und komplett privat bezahlt. Die meisten dieser Mittel werden von ihren Herstellern als kurativ wie präventiv hilfreich beworben.Eine ganze Reihe dieser so genannten "Over-The-Counter (OTC)"-Arzneimittel sind auch nachgewiesenermaßen hochwirksame Mittel, die zum Teil auch mit anderen Arzneimitteln und dann auch noch zum Nachteil des sie einnehmenden Menschen interagieren können. Wenn es darum geht den Nutzen der OTC-Präparate oder auch das bei der Einnahme zu Beachtende zu bestätigen oder zu erfahren, sind ihre Käufer in hohem Maße von der fachlichen Beratung der ApothekerInnen abhängig. Dies umso mehr als dass rund die Hälfte der in Apotheken abgegebenen Packungen Präparate zur Selbstmedikation enthalten.
Ein nicht unbeträchtlicher Anteil aller Medikationsmittel werden nicht von Ärzten verordnet, sondern direkt von PatientInnen oder um ihre Gesunderhaltung besorgten Gesunden in Apotheken erworben und komplett privat bezahlt. Die meisten dieser Mittel werden von ihren Herstellern als kurativ wie präventiv hilfreich beworben.Eine ganze Reihe dieser so genannten "Over-The-Counter (OTC)"-Arzneimittel sind auch nachgewiesenermaßen hochwirksame Mittel, die zum Teil auch mit anderen Arzneimitteln und dann auch noch zum Nachteil des sie einnehmenden Menschen interagieren können. Wenn es darum geht den Nutzen der OTC-Präparate oder auch das bei der Einnahme zu Beachtende zu bestätigen oder zu erfahren, sind ihre Käufer in hohem Maße von der fachlichen Beratung der ApothekerInnen abhängig. Dies umso mehr als dass rund die Hälfte der in Apotheken abgegebenen Packungen Präparate zur Selbstmedikation enthalten.
Dazu benötigen sie aber bei der Vielzahl alter und neuer Präparate selber wissenschaftlich gesicherte oder evidente Informationen. Und um diese in knapper, verständlicher aber dennoch inhaltlich valider Form zugänglich zu machen, startete eine der populären pharmazeutischen Fachzeitschriften, die "Pharmazeutische Zeitung (PZ)" im Jahr 2015 eine Serie "Evidenzbasierte Selbstmedikation".
Das Mitglied der Chefredaktion, Professor Dr. Manfred Schubert-Zsilavecz, begründete dieses Angebot folgendermaßen, was wegen der weiteren Ereignisse ausführlich zitiert werden soll: "Kommt ein Kunde in die Apotheke, dann entscheidet er zusammen mit dem Apotheker über die nächsten Schritte. Behandlung unnötig? Selbstmedikation? Arztbesuch? Die Apotheker sind hier als Berater in der Schlüsselrolle. Das setzt eine hohe heilberufliche Kompetenz voraus. Aber nicht nur bei der Beantwortung dieser wichtigen Frage, auch bei der Auswahl des am besten für einen bestimmten Patienten geeigneten OTC-Arzneimittels ist die Kompetenz des Apothekers gefragt. Rationale OTC-Arzneimittel sind wahrlich keine Arzneimittel »zweiter Klasse«, vielmehr gelten auch für sie die Prinzipien Wirksamkeit, Unbedenklichkeit und pharmazeutische Qualität als Grundlage einer jeden Zulassung. Darüber hinaus gilt es im Kontext evidenzbasierter Pharmazie das für die jeweilige Erkrankung am besten geeignete OTC-Arzneimittel auszuwählen. Entscheidende Kriterien müssen dabei an erster Stelle die Ergebnisse klinischer Studien sein. Aber auch die individuellen therapeutischen Erfahrungen des beratenden Apothekers und die Wünsche des Patienten sollten in die Entscheidung eingebracht werden. In den letzten zehn Jahren hat es einen nicht unerheblichen Zuwachs an molekular-pharmakologischen Erkenntnissen und neuen Studiendaten für OTC-Arzneimittel gegeben, weshalb es sich lohnt, Umfang und Qualität der klinischen Evidenz der am häufigsten eingesetzten OTC-Arzneimittel zu kennen und die daraus zu ziehenden Schlüsse in den Beratungsgesprächen zu berücksichtigen."
Worüber die LeserInnen dann durch fundierte und mit Verweisen auf hochwertige Studienliteratur versehene Beiträge von PharmazeutInnen informiert wurden und welche Hinweise auf wissenschaftlich fundierte Hinweise zur Abgabe oder Nichtabgabe an nachfragende Personen sie erhielten, soll an zwei Beispielen aufgezeigt werden:
• Zu Vitamin C-präparaten gegen oder bei Erkältungen heißt es im PZ-Heft 48 2015: "Fazit: Auf der Datenbasis des Cochrane-Reviews senkt die prophylaktische Einnahme von Vitamin C das Risiko für eine Erkältung in der Allgemeinbevölkerung nicht. Eine Ausnahme sind Menschen, die akut starker körperlicher Belastung oder großer Kälte ausgesetzt sind. Dauer und Schweregrad (Zustand von Arbeitsunfähigkeit) verkürzen sich bei regelmäßiger Supplementierung für Erwachsene nur um einige Stunden. Bei therapeutischer Einnahme nach Beginn der Erkältungssymptome ist kein eindeutiger Effekt auf Dauer oder Schweregrad nachweisbar. Unklar ist bisher, ob für die therapeutische Anwendung höhere Dosierungen unter Umständen stärkere Therapieeffekte erzielen - für eine allgemeine Empfehlung sind derzeit aber bessere Belege aus qualitativ hochwertigen Studien nötig."
• Und zum Pelargonium-Extrakt, als "traditionelles Arzneimittel" angepriesen heißt es in der PZ-Ausgabe 8/2016 knapp: "Nutzen wahrscheinlich, aber nur für Tropfen".
Mindestens noch acht vergleichbare Artikel waren geplant, von denen aber letztlich ohne öffentliche Begründung nur vier erschienen.
Woran dies lag, erfuhr der Vorstand des "Verbandes der Pharmazeutinnen und Pharmazeuten (VdPP)" auf eine Anfrage bei der PZ in seltener Klar- und Offenheit. Der Chefredakteur Daniel Rücker nannte in seinem Antwortschreiben (zitiert nach der Veröffentlichung auf der Website doccheck vom 25. April 2017 zwei Gründe:
• "Zeitschriften wie die PZ sind nach unseren Erfahrungen mit der Serie wegen eines nicht auflösbaren Interessenkonflikts ungeeignet, OTC-Arzneimittel zu bewerten. OTC-Anzeigen sind eine wesentliche Einnahmequelle der PZ. (…) Es gibt schon einzelne OTC-Hersteller, die schnell dabei sind, mit der Stornierung von Anzeigen zu drohen." Und weiter: ""Es gab durchaus Gegenwind von pharmazeutischen Unternehmen. Manche wünschen sich, dass ihre Präparate positiver dargestellt werden, als es die Datenlage hergibt. Doch es war nicht so, dass wir die Serie hätten einstellen müssen. Wir haben nach sechs Folgen aufgehört."
• "Wir hatten erwartet, dass die Serie eine größere Aufmerksamkeit unter Apothekern erzeugt und es sie sehr stark interessiert, welche OTC-Arzneimittel tatsächlich erwiesen wirksam sind und welche nicht. Das war nicht der Fall."
Im Übrigen: Die PZ erscheint in der Avoxa Mediengruppe, die eine hundertprozentige Tochtergesellschaft des Spitzenverbandes der deutschen Apothekerschaft: der ABDA - Bundesvereinigung Deutscher Apothekerverbände e. V., ist also keine beliebige Publikation, sondern ein Standesorgan. Die Standesvertretung der ApothekerInnen soll aber nach Angaben des VdPP bisher auf das Bekanntwerden der Gründe "gelassen" reagiert haben.
So müssen ApotherInnen weiterhin auf alltagstaugliche (natürlich könnten sie auch selber stunden- oder tagelang nach Cochrane Reviews etc. suchen und sie zu lesen anfangen, würden dann aber genauso lang in der Apotheke fehlen) valide Antworten zum Nutzen wichtiger OTC-Präparate in ihrer verbandseigenen Fachzeitschrift warten bzw. verzichten und PatientInnen oder KundInnen bekommen entweder keine oder ausschließlich herstellergetränkte Antworten.
Bernard Braun, 27.4.17
Falsches Wissen 2 - bei Patienten weit verbreitet
 Notwendige Voraussetzung für sachgerechte Entscheidungen in der Medizin ist ein zutreffendes Wissen über Nutzen und Schäden (Risiken). Eine systematische Übersichtsarbeit zeigt, dass Patienten fast regelhaft nicht über zutreffendes Wissen verfügen - ihre Vorstellungen über Nutzen und Schäden für therapeutische, diagnostische und präventive Maßnahmen sind selten selten zutreffend. Ein überoptimistisches Bild herrscht vor - der Nutzen wird zumeist überschätzt und die Schäden werden unterschätzt. Ein vergleichbares Ergebnis hatte eine entsprechende Studie über das Wissen von Ärzten ergeben.
Notwendige Voraussetzung für sachgerechte Entscheidungen in der Medizin ist ein zutreffendes Wissen über Nutzen und Schäden (Risiken). Eine systematische Übersichtsarbeit zeigt, dass Patienten fast regelhaft nicht über zutreffendes Wissen verfügen - ihre Vorstellungen über Nutzen und Schäden für therapeutische, diagnostische und präventive Maßnahmen sind selten selten zutreffend. Ein überoptimistisches Bild herrscht vor - der Nutzen wird zumeist überschätzt und die Schäden werden unterschätzt. Ein vergleichbares Ergebnis hatte eine entsprechende Studie über das Wissen von Ärzten ergeben.
Für die Übersichtsarbeit werteten die Autoren die Angaben von 27.323 Ärzten in 35 Studien aus den Jahren 1994 bis 2013 aus. Die Studien stammen aus 16 Ländern, 17 der 35 Studien aus den USA. Die Teilnehmerzahl lag zwischen 45 und 228. Eingeschlossen sind Studien, in denen die Patienten quantitative Angaben zu Nutzen und Schäden von Therapie (16 Studien) oder diagnostische Untersuchungen bzw. Screening (20 Studien, davon 15 zu Krebs).
22 Studien untersuchten die Erwartung an den Nutzen, 10 die Erwartungen an Nutzen und Schäden (Risiken) und 3 die Erwartung von Schäden.
Insgesamt ergaben sich 81 Ergebnisse (Outcomes, Endpunkte), 54 zu Erwartungen an den Nutzen und 27 zu Schäden. Die meisten Studien benutzen Multiple-Choice-Fragen, einige gaben keine Antwortauswahl vor. Bei den Probanden handelte es sich um Patienten, die eine Intervention erhalten hatten oder in Kürze erhalten sollten, um Patienten die sich in einem Krankenhaus oder einer Praxis befanden oder kürzlich befunden hatten und um Allgemeinbevölkerung.
Im Ergebnis überschätze die Mehrzahl der Befragten der meisten Outcomes. Der Anteil der Befragten, die den Nutzen überschätzen, lag je nach Outcome zwischen 7 und 94%.
Nur bei 2 Outcomes schätzte die Mehrzahl den Nutzen korrekt - die Sehverbesserung durch Katarakt-Operation und die Genauigkeit des PAP-Tests (Abstrich des Gebärmutterhalses). Nur bei einem Outcome (Nutzen der Operation bei Kreuzschmerz) unterschätzte mehr als die Hälfte den Nutzen.
In 10 von 25 Outcomes unterschätzen zwischen 18 und 97% der Befragten die Schäden. Nur für 2 Outcomes schätzte die Mehrzahl die Schäden korrekt ein (Fehlgeburt nach Fruchtwasseruntersuchung, verbleibende Notwendigkeit für Sehhilfen nach Katarakt-Operation). Der einzige Schaden, der überschätzt wurde, war das Risiko für Brustkrebs infolge der Hormontherapie bei gesunden Frauen.
Zu hohe Erwartungen an den Nutzen in teils ganz erheblichem Ausmaß lagen vor für
• Screening-Untersuchungen (Brustkrebs, Gebärmutterhalskrebs, Prostatakrebs und Darmkrebs)
• Krebstherapien (Stammzelltransplantation, adjuvante Chemotherapie bei Brustkrebs)
• Prävention und Therapie von Herz-Kreislauf-Erkrankungen (medikamentöse Prävention, Stenting der Herzkranzgefäße)
• Operationen (Nierentransplantation, bariatrische Operationen)
• Arzneitherapie (Infliximab for entzündliche Darmerkankungen, Hormontherapie, Prävention der Hüftgelenksfraktur bei Osteoporose)
Diese hochrelevante systematische Übersichtsarbeit weist darauf hin, dass Patienten ihre Entscheidungen häufig auf überoptimistische Erwartungen an Nutzen und Schäden gründen. Die analoge Studie zum Wissen der Ärzte legt den Schluss nahe, dass die Ärzte maßgeblichen zu den Fehleinschätzungen der Patienten beitragen. Die Gründe für diesen medizinischen Überoptimismus sind vielfältig, die Folge sind Overdiagnosis und Overuse, also ein Zuviel an Untersuchungen und Behandlungen zum Schaden der Patienten. Sowohl die Studie über die Erwartungen der Ärzte als auch der Patienten zeigt, dass dieses Phänomen nicht neu ist. Gewachsen ist jedoch die Aufmerksamkeit dafür und eine internationale Bewegung, die sich für eine bessere Medizin einsetzt, wie z.B.
• Choosing Wisely
• Gemeinsam Klug Entscheiden
• Preventing Overdiagnosis
• Realistic Medicine
• Right Care.
Erwähnt sei auch die umfassende Right Care-Serie, die im Januar 2017 im Lancet veröffentlicht wurde.
Hoffmann TC, Del Mar C. Patients' expectations of the benefits and harms of treatments, screening, and tests: a systematic review. JAMA Intern Med 2015;175(2):274-86. doi: 10.1001/jamainternmed.2014.6016 [published Online First: 2014/12/23]
Link.
Hoffmann TC, Del Mar C. Clinicians' expectations of the benefits and harms of treatments, screening, and tests: A systematic review. JAMA Internal Medicine 2017;177(3):407-19. im Forum Gesundheitspolitik: Link
David Klemperer, 13.4.17
Transparenz über Lobbyismus und Interessenkonflikte im Gesundheitswesen: Ein Schritt vor, zwei Schritte zurück!
 Nachdem es jahrzehntelang zu den bestgehütesten Geheimnissen der Hersteller und Verordner von Gesundheitsgütern gehörte, mit welchen und wie viel Mitteln erstere Ärzte, Krankenhäuser oder auch Selbsthilfegruppen vom Nutzen ihrer Produkte zu überzeugen versuchten, wurde und wird dies beginnend in den USA und unter dem Einfluss des öffentlichen Drucks zunehmend transparenter.
Nachdem es jahrzehntelang zu den bestgehütesten Geheimnissen der Hersteller und Verordner von Gesundheitsgütern gehörte, mit welchen und wie viel Mitteln erstere Ärzte, Krankenhäuser oder auch Selbsthilfegruppen vom Nutzen ihrer Produkte zu überzeugen versuchten, wurde und wird dies beginnend in den USA und unter dem Einfluss des öffentlichen Drucks zunehmend transparenter.
In Deutschland begann dies im Jahr 2008 mit einem "sanktionsbewehrten" Kodex des Vereins "Freiwillige Selbstkontrolle für die Arzneimittelindustrie e.V. (FSA)", der seit 2009 auch in Gestalt von ersten groben Informationen über die Zuwendungen an Patientenorganisationen umgesetzt wurde. Mit den seit März 2016 in einer durchsuchbaren Datenbank auf der FSA-Website veröffentlichten Daten der Pharmaunternehmen über Empfänger, Höhe und Zweck der Zuwendungen an Selbsthilfegruppen im Jahr 2015 findet die Transparenz mit 1.415 Einträgen einen vorläufigen Endpunkt. Dort findet man, dass alle Patientenorganisationen 2015 rund 5,8 Millionen Euro von Pharmaunternehmen erhielten und wie viel Euro z.B. von welchen Antidiabetika-Herstellern an Diabetes-Selbsthilfegruppen gezahlt wurden.
Vorläufig deshalb, weil die FSA in einer Pressemitteilung vom 31. März 2016 für ihre Mitgliedsunternehmen ankündigt "noch in der ersten Jahreshälfte 2016 analog zum Kodex Patientenorganisationen alle Zuwendungen an Ärzte sowie weitere Angehörige der Fachkreise und medizinischen Einrichtungen" zu veröffentlichen. Man kann sich also schon einmal den 1. Juli 2016 als Transparenzmerktag in den Kalender eintragen!
Trotz dieser Fortschritte bei der Transparenz über den Lobbyismus der Pharmaindustrie besteht aber leider kein Grund (selbst)zufrieden zu sein und sich anderen Fragen und Problemen zuzuwenden. Dies liegt zum einen daran, dass es eine vergleichbare Transparenz über die Aktivitäten der Hersteller anderer Gesundheitsgüter, also z.B. der Geräte für bildgebende Diagnostik oder von Hilfsmitteln (z.B. Blutzuckermessgeräte, Rollstühle) nicht gibt - noch nicht einmal Pläne oder einen Kodex.
Zum anderen zeigen zwei aktuell veröffentlichte Studien, dass sich sowohl Pharmaunternehmen als auch die anderen so genannten "biomedical companies" mittlerweile auf andere und möglicherweise sogar wirksamere Mittel und Wege des Lobbyismus für ihre Produkte konzentrieren für die es bis jetzt kaum Transparenz gab und gibt.
Eine von kanadischen WissenschaftlerInnen durchgeführte Untersuchung der im Jahr 2012 von 95 nationalen und internationalen medizinischen Fachorganisationen erstellten 290 Behandlungsleitlinien, die für Interessenten und Nutzer auf der viel genutzten und geschätzten Website des "National Guideline Clearinghouse" veröffentlicht wurden, kommt zu folgenden Ergebnissen:
• 63% der Leitlinienverfasser geben auf ihrer Website oder in einer von den WissenschaftlerInnen durchgeführten Befragung an, finanzielle Mittel von Herstellern erhalten zu haben, deren Produkte in den Leitlinien empfohlen oder auch nicht empfohlen wurden.
• Nur 1% der Leitlinienverfasser schließen definitiv jegliche finanzielle Beziehungen zu Herstellern und damit dadurch existierende Interessenkonflikte aus.
• Da an dieser Stelle häufig eingewandt wird, finanzielle Unterstützung müsse nicht zwangsläufig dazu führen, dass die Verkaufsinteressen der zahlenden Hersteller bedient werden, ist ein weiteres Ergebnis dieser Untersuchung wichtig: Die Behandlungsleitlinien der Organisationen mit rigiden Interessenkonflikt-Regelungen (was dies im Detail bedeutet, lohnt sich nachzulesen) geben relativ weniger positive (-9%) und mehr negative (+32%) Empfehlungen für patentierte biomedizinische Produkte als Organisationen ohne solche Regelungen. Organisationen mit Interessenkonfliktregelungen veröffentlichen auch deutlich mehr (+31%) Hinweise auf direkte fianzielle Zuwendungen und finanzielle Beziehungen von Mitgliedern ihrer Leitlinien-Arbeitsgruppen (+36%) als solche ohne solche Regelungen.
Da anzunehmen ist, dass derartige Varianten des Lobbyismus nicht nur bei den hier untersuchten Organisationen und den 290 untersuchten Behandlungsleitlinien auf der Clearinghouse-Website stattfinden, muss man davon ausgehen, dass das berufliche Handeln eines beträchtlichen Anteils der Ärzte, die sich versuchen evidenzbasiert oder leitliniengerecht zu verhalten, möglicherweise zum Nachteil oder auch nur nicht zum Vorteil (falls ein nicht empfohlenes Produkt nützlicher wäre) ihrer PatientInnen, durch die Hersteller beinflusst wird.
Dass aber die Intransparenz über den Lobbyismus der Arzneimittelhersteller in Deutschland trotz FSA nicht verschwunden ist und sich möglicherweise nicht nur auf die Einflussnahme auf Behandlungsempfehlungen konzentriert, zeigt eine im März 2016 erschienene Studie über das Verfahren zur Nutzenbewertung von neuen Arzneimitteln für in der Gesetzlichen Krankenversicherung versicherte PatientInnen.
Zum Hintergrund: Das Arzneimittelmarktneuordnungsgesetz (AMNOG) aus dem Jahr 2011 hat eine frühe Nutzenbewertung für neue Arzneimittel eingeführt. Neue Wirkstoffe müssen, um in den späteren Preisverhandlungen zwischen den Herstellern und dem GKV-Spitzenverband einen möglichst hohen Preis erzielen zu können, einen gegenüber der bisherigen Therapie (so genannte zweckmäßige Therapie) zusätzlichen Nutzen haben. Dieser muss vom Hersteller per Dossier belegt werden. Das "Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)" wertet diese Unterlagen wissenschaftlich aus und gibt dem "Gemeinsamen Bundesausschuss (G-BA)" als gesetzlichem Beschlussorgan eine auf bestverfügbare Evidenz gestützte Empfehlung. Der G-BA führt darüber eine Anhörung von verschiedenen externen ExpertInnen aus den je nach Indikation betroffenen Fachgesellschaften und aus der Arzneimittelkommission der deutschen Ärzteschaft (AKdÄ) durch und entscheidet letztlich in einem nichtöffentlichen Fachausschuss.
Wie die Stellungnahmen der externen ExpertInnen in den 136 zwischen 2011 und August 2015 abgeschlossenen Verfahren zur Nutzenbewertung ausfielen und wie sie sich auf die Entscheidungen des G-BA auswirkten, untersuchte nun die hier näher betrachtete Studie des IGES-Instituts.
Die wesentlichen Ergebnisse lauten:
• Die ExpertInnen aus den Fachgesellschaften sahen in den neuen Wirkstoffen wesentlich häufiger einen Zusatznutzen als die ExpertInnen der AKdÄ. Während die AKdÄ in 18% der Fälle den Zusatznutzen höher bewertet als das IQWiG und sich in 64% der Fälle dessen Votum anschließt, bewerten die Fachgesellschaften-ExpertInnen den Zusatznutzen in 84% der Fälle höher als das IQWiG und stimmen dessen Votum nur in 14% der Fälle zu.
• Wenn es um so genannte patientenrelevante Endpunkte ging, widersprachen in 83% der Fälle die Fachgesellschafts-ExpertInnen der Einschätzung des IQWiG, was die AKdÄ-ExpertInnen in 63% der Fälle taten. In diesem Zusammenhang ist eine andere Beobachtung der Studie interessant und wichtig: Obwohl Vertreter der unterschiedlichsten Patientenorganisationen bei der Bewertung in öffentlicher und nichtöffentlicher Sitzung beteiligt sind (auch im Fachausschuss allerdings gemäß der gesetzlichen Bestimmungen zur Patientenvertretung im G-BA nicht an der Entscheidung), gibt es über ihre Voten keine Veröffentlichungen.
• Auch wenn dies kein kausaler Beleg für den Einfluss der ExpertInnenvoten auf die Entscheidung über den Zusatznutzen ist, folgt der G-BA deutlich häufiger den AKdÄ- als den Fachgesellschaftsvoten. In den Fällen wo die ExpertInnen den Zusatznutzen höher als das IQWiG bewerten, folgt der G-BA 75% der AKdÄ- und 46% der Fachgesellschaftsvoten. Bei Kontroversen um die patientenrelevanten Endpunkte beträgt das Verhältnis 46% zu 24%.
• Als Erklärung für die vielfach unterschiedlichen Voten bieten sich mehrere an: Zum einen folgen ExpertInnen der Fachgesellschaftren häufig praktischen Behandlungserfahrungen und AKdÄ-ExpertInnen eher der in methodisch hochwertigen Studien ermittelten Evidenz für den Nutzen bestimmter Arzneimittel. Zum anderen aber stellt der Bremer Pharmakologe und das AKdÄ-Vorstandsmitglied Bernd Mühlbauer fest: "Viele der Mitglieder aus den Fachgesellschaften sitzen in Advisory-Boards der Hersteller und sind auch sonst vielfach mit ihnen verbunden" - was ihre Neutralität erheblich beeinträchtige.
Ob das zuletzt Geäußerte zutrifft und ob dies für einige AKdÄ-ExpertInnen nicht auch zutrifft, müsste eigentlich spätestens die FSA-Veröffentlichung über die "Zuwendungen…an weitere Angehörige der Fachkreise und medizinischen Einrichtungen" offenbaren. Umso gespannter kann man ihr entgegensehen.
Die 132 Seiten umfassende und sehr materialreiche IGES-Studie Auswirkungen von Stellungnahmen der Wissenschaft in der Nutzenbewertung von Arzneimitteln von H. Bleß et al. ist komplett kostenlos erhältlich. Mustergültig ist in dem untersuchten Zusammenhang der Hinweis, dass sie im Auftrag von Takeda Pharma Vertrieb erstellt wurde.
Die 16-seitige Studie Financial Relationships between Organizations That Produce Clinical Practice Guidelines and the Biomedical Industry: A Cross-Sectional Study von Paul Campsall, Kate Colizza, Sharon Straus und Henry T. Stelfox ist in der Fachzeitschrift "PLOS Medicine" (2016; 13 (5)) erschienen und ebenfalls komplett kostenlos erhältlich.
Bernard Braun, 11.6.16
Neue Krebsmedikamente 5: Fortgeschrittener Krebs - keine Chemotherapie ist auch eine Option
 Beitrag Fortgeschrittener Krebs - keine Chemotherapie ist auch eine Option
Beitrag Fortgeschrittener Krebs - keine Chemotherapie ist auch eine Option
David Klemperer, 25.11.15
Neue Krebsmedikamente 3: "Durchbruch" in der Therapie weckt falsche Hoffnungen
 Krebspatienten gründen ihre Entscheidungen über eine Chemotherapie auf den zu erwartenden Gewinn an Lebenszeit und auf die Beeinträchtigung der Lebensqualität durch die Toxizität der Behandlung. Dafür benötigen sie evidenzbasierte Informationen über ihr Krankheitsbild und die zu erwartenden Behandlungsergebnisse, insbesondere die Verlängerung der Überlebenszeit.
Krebspatienten gründen ihre Entscheidungen über eine Chemotherapie auf den zu erwartenden Gewinn an Lebenszeit und auf die Beeinträchtigung der Lebensqualität durch die Toxizität der Behandlung. Dafür benötigen sie evidenzbasierte Informationen über ihr Krankheitsbild und die zu erwartenden Behandlungsergebnisse, insbesondere die Verlängerung der Überlebenszeit.
Die amerikanische Arzneimittelzulassungsbehörde (Food and Drug Administration, FDA) kann seit dem Food and Drug Administration Safety and Innovation Act von 2012 Arzneimittel beschleunigt zulassen, wenn sie, als "Durchbruch" ("Breakthrough Therapy", dazu FDA Fact Sheet) anerkannt sind. Dies gilt für ein Arzneimittel zur Behandlung einer "ernsten Erkrankung", für das "vorläufige klinische Evidenz" für die substantielle Verbesserung von mindestens einem klinischen Endpunkt vorliegt im Vergleich zu den existierenden Therapien. Anerkannt werden u.a. Belege aus nicht-kontrollierten Studien und Surrogatendpunkte (Einzelheiten in der Broschüre für die Industrie). Eine Verbesserung der Prognose und/oder Lebensqualität ist nicht Bedingung.
Es liegt nahe, dass eine als "Durchbruch" bezeichnete Therapie hohe Erwartungen weckt. Eine Forschergruppe aus Dartmouth prüfte dies in einer kleinen, unaufwändigen Studie.
In einer Online-Befragung erhielten 597 Teilnehmer je eine von 4 Fallvignetten.
Alle 4 Gruppen erhielten einen Text mit den Fakten, dass die FDA ein neues Medikament gegen Lungenkrebs zugelassen habe, dass bei der Hälfte der Probanden den Tumor vorübergehend verkleinert. Genannt wurden auch unerwünschte Wirkungen, wie Durchfall, Übelkeit, Erbrechen und Veränderung von Laborwerten.
• Gruppe 1 erhielt nur diese Fakten (Basisinformation)
• Gruppe 2 erhielt zusätzlich die Information, dass die FDA das Medikament als "aussichtsreich" (promising) bezeichnet hat
• Gruppe 3 erhielt zusätzliche die Information, dass die FDA das Medikament als "Durchbruch" (breakthrough) bezeichnet hat
• Gruppe 4 wurde wie Gruppe 3 mit dem Begriff "Durchbruch" konfrontiert und erhielt zusätzlich die (eher vorsichtig formulierte) Erklärung, dass damit eine Verbesserung des Überlebens oder eine Minderung der Krankheitssymptome nicht gesichert sei und die Aufrechterhaltung der vorläufigen Zulassung möglicherweise vom Ergebnis weiterer Studien abhänge.
• Gruppe 5 wurde wie Gruppe 3 mit dem Begriff "Durchbruch" konfrontiert und erhielt zusätzlich die deutlich Erklärung, dass die vorübergehende Verkleinerung des Tumors noch keine Verbesserung des Überlebens oder eine Minderung der Krankheitssymptome bedeute und die Aufrechterhaltung der vorläufigen Zulassung definitiv vom Ergebnis weiterer Studien abhänge.
Die Probanden gaben dann an auf einer Likert-Skala an, wie sie den Nutzen, die Schäden und die Stärke der Evidenz des Medikaments beurteilten.
Zusammenfassend erhöhten die Begriffe "breakthrough" und "promising" den Glauben an den Nutzen und an die Stärke der Evidenz, die Information über den nicht erwiesenen Patientennutzen minderte den Glauben.
Im Einzelnen:
Die Zusatzinformation "promising" oder "breakthrough" erhöhte den Anteil der positiven Bewertungen
• sehr oder vollständig effektiv: Basisinformation 11% / promising 23% / breakthrough 25%
• viel oder etwas effektiver als die bisher verfügbaren Medikamente: Basisinformation 69% / promising 78% / breakthrough 86%
• Evidenz stark oder sehr stark: Basisinformation 43% / promising 59% / breakthrough 63%
•
• würde das Medikament vielleicht oder sicher einnehmen: Basisinformation 72% / promising 84% / breakthrough 76%
Die Frage, ob bewiesen sei, dass das Medikament leben rette bejahten 31% aus der breakthrough-Gruppe, 16% aus der Gruppe mit zurückhaltend erklärender Information und 10% aus der Gruppe mit deutlich erklärender Information.
Fazit
Die Verwendung von Begriffen wie "vielversprechend" (promising) oder "Durchbruch" (breakthrough) weckt in einer Gruppe Gesunder falsche und überhöhte Vorstellungen über den Nutzen des mit einem dieser Begriffe bezeichneten Medikaments. Dies wirkt der Anforderung an informierte Entscheidung durch den Patienten entgegen und erscheint auch ethisch bedenklich, denn Patienten treffen Entscheidungen über Chemotherapie differenziert entsprechend der Toxizität und der zu erwartenden Lebensverlängerung.
Die Tendenz zu illusionären Erwartungen an die Effekte einer Chemotherapie wird so verstärkt. Es sei daran erinnert, dass die Mehrheit der Patienten mit fortgeschrittenem Lungenkrebs und Darmkrebs die Chemotherapie fälschlich als möglicherweise heilend einschätzen {(wir berichteten){http://forum-gesundheitspolitik.de/artikel/artikel.pl?artikel=2170}.
Krishnamurti T, Woloshin S, Schwartz LM, Fischhoff B: A randomized trial testing us food and drug administration "breakthrough" language. JAMA Internal Medicine 2015, 175(11):1856-1858 Volltext.
Journalistische Beiträge in der Laienpresse dürften für Patienten, die Öffentlichkeit und auch für Investoren eine wichtige Informationsquelle darstellen mit größerer Reichweite als Fachzeitschriften-Beiträge. Die Art der Darstellung dürfte wesentlich dazu beitragen, wie eine Therapieform in der Öffentlichkeit bewertet wird.
Eine amerikanische Studie ging der Frage nach, wie häufig neue Krebstherapien mit Superlativen beschrieben wurden. Die Autoren durchsuchten dafür Google news für den kurzen Zeitraum vom 21. bis 25. Juni 2015 mit dem Suchbegriff "cancer drug" in Verbindung mit den folgenden superlativen Begriffen: breakthrough, game changer, miracle, cure, home run, revolutionary, transformative, life saver, groundbreaking, marvel.
Sie fanden 94 Nachrichten aus 66 unterschiedlichen Nachrichtenquellen mit 97 Superlativen bezogen auf 36 bestimmte und 3 unbenannte Medikamente.
Unter den Therapieformen wurde die gezielte Therapie in 17 der 36 Artikel am häufigsten aufgegriffen, die zytotoxische Therapie bzw. Chemotherapie in 9 Artikeln, Checkpoint Inhibitoren in 5 Artikeln. 3 Artikel mit Superlativen bezogen sich auf Krebsimpfungen bzw. therapeutische Vakzine, einer auf Bestrahlungstherapie und einer auf Gentherapie.
Von den 97 Superlativen bezogen sich 39 auf eine gezielte Therapie, 37 auf einen Checkpoint-Inhibitor, 10 auf ein zytotoxisches Medikament, 5 auf eine Krebsimpfung, 3 nannten keine Therapieform, 2 auf eine Strahlentherapie, eine auf eine Gentherapie.
Von den 36 Substanzen hatten 18 bis Mitte Juli 2015 noch keine Zulassung von der Food and Drug Administration erhalten. Allein auf Grundlage von Tierversuchen, Zellkulturen oder präklinischer Forschung, also ohne Erkenntnisse aus Versuchen an Menschen, wurde 5 Substanzen mit einem Superlativ bedacht.
Die Superlative wurden 53 Journalisten, 26 Ärzten, 9 Industrievertretern, 8 Patienten und einem Kongressabgeordneten zugeschrieben. In der Mehrheit der Fälle wurde der Superlativ nicht vom Autor kommentiert.
Superlative wurden genauso häufig für zugelassene wie für nicht zugelassene Substanzen und für alle Arten von Krebstherapie gebraucht. Superlative erhielten auch Substanzen, wie z.B. Palbociclib und auch Krebsimpfungen, für die bisher keine Daten für einen Patientennutzen aus klinischen Studien vorliegt. Insgesamt wurden 5 Substanzen mit einem Superlativ vorgestellt, für die noch keinerlei Daten aus Studien an Menschen vorlagen.
Krebsmedikamente werden somit in der amerikanischen Öffentlichkeit häufig auf eine Weise dargestellt, dass die Leserinnen und Leser gefährdet sind, den Nutzen weit zu überschätzen, Risiken zu unterschätzen und falsche Hoffnungen zu entwickeln.
Dass eine entsprechende Studie in Deutschland ähnliche Ergebnisse erbringen könnte, zeigen die Ergebnisse bei Google News für die Eingabe der Begriffe "Krebstherapie" und "Durchbruch": zwischen dem 14.10. und 14.11.2015 finden sich 5 unkritische Berichte und 1 Bericht über die hier vorgestellte Studie. "Krebstherapie" und "Innovation" ergibt für denselben Zeitraum 14 Treffer.
Abola MV, Prasad V: THe use of superlatives in cancer research. JAMA Oncology 2015:1-2 Abstract
Serie Neue Krebsmedikamente
1 Nutzen für Patienten fraglich, Preise exorbitant Link
2 Leichtfertige Zulassung in den USA Link
3 "Durchbruch" in der Therapie weckt falsche Hoffnungen
Link
4 Wunder, Revolutionen und Durchbrüche - neue Krebstherapien werden in der amerikanischen Presse häufig mit Superlativen bezeichnet Link
5 folgt: Patientennutzen meistens gering Link
David Klemperer, 6.11.15
Neue Krebsmedikamente 2: Leichtfertige Zulassung in den USA
 Den Zusammenhang von Surrogatendpunkten und patientenrelevanten Endpunkten von Krebsmedikamenten untersuchten Mitarbeiter des amerikanischen National Cancer Institute.
Den Zusammenhang von Surrogatendpunkten und patientenrelevanten Endpunkten von Krebsmedikamenten untersuchten Mitarbeiter des amerikanischen National Cancer Institute.
Surrogatendpunkte sind dem Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) zufolge "Endpunkte, die selbst nicht von unmittelbarer Bedeutung für einen Patienten sind, aber mit patientenrelevanten Endpunkten assoziiert sind (zum Beispiel Senkung des Blutdrucks als Surrogatparameter für Vermeidung eines Schlaganfalls)".
Als wichtigster patientenrelevanter Endpunkt wird in der Onkologie die Überlebenszeit, also die Verbesserung der Prognose angesehen (overall survival). Ein gebräuchlicher Surrogatendpunkt in der Onkologie ist das Schrumpfen ("Ansprechen") des Tumors (auch wenn es nur vorübergehend ist), was in Studien als Ansprechrate (response rate) erfasst wird.
Ein weiterer Surrogatendpunkt bezieht sich auf die Zeit, in der die Krankheit nicht voranschreitet und wird als krankheitsfreies Überleben (progression-free survival) bezeichnet.
Surrogatendpunkte werden in vielen Fällen von Zulassungsbehörden als ausreichend für die Zulassung anerkannt. Die Klärung der Frage, ob z.B. das Schrumpfen des Tumors tatsächlich mit längerer Überlebenszeit einhergeht, muss jedoch in Studien geprüft werden, die beide Arten von Endpunkt untersuchen (s.a. IQWiG "Validierung von Surrogatendpunkten").
Die amerikanischen Autoren fanden in ihrer Recherche 36 Studien mit 65 Korrelationen zwischen Surrogatendpunkten und patientenrelevanten Endpunkten.
• 34 von 65 Korrelationen (52%) waren schwach.
• 16 von 65 (25%) waren von mittlerer Stärke
• 15 von 65 (23%) waren hoch korreliert.
Surrogatendpunkte lassen also in der Mehrzahl der Fälle keine Verbesserung der patientenrelevanten Endpunkte erwarten.
Die Autoren stellen daher in der Diskussion die verbreitete Praxis der Zulassung von Krebsmedikamenten auf Grundlage von Surrogatendpunkten infrage. Sie weisen auch darauf hin, dass sie zahlreiche Studien einschließen konnten, weil zur Analyse notwendige Daten nicht veröffentlicht waren und ihnen auch auf Anfrage nicht zur Verfügung gestellt wurden. Möglicherweise sind daher die dargestellten Ergebnisse positiver als die Wirklichkeit.
Weit überwiegend erscheint daher der Nutzen von Krebsmedikamenten, von denen man lediglich weiß, dass sie einen Tumor vorübergehend schrumpfen lassen oder sein Wachstum verzögern, sehr fraglich. Viele Patienten erhalten somit hochtoxische Medikamente, die ihnen höchstwahrscheinlich nicht nutzen. Dass diese Medikamente mit exorbitanten Preisen zu bezahlen sind, berichteteÜber die Preisgestaltung neuer Krebsmedikamente berichteten wir im Forum.
Es gibt Beispiele dafür, dass die Zulassung eines Medikaments erhalten bleibt, selbst wenn sich in weiteren Studien herausstellt, dass der patientenrelevante Endpunkt Überleben nicht verbessert wird, wie bei Bevacizumab/Avastin® bei metastasiertem Brustkrebs. Bevacizumab war aufgrund der Verlängerung des progessionsfreien Überlebens zugelassen worden, obwohl aus früheren Analysen bekannt war, dass dieses Kriterium kein verbessertes Überleben erwarten ließ.
Die Autoren belegen an einer Reihe weiterer Beispiele die Zulassung von Krebsmedikamenten in den USA auf Grundlage einer sehr schmalen Evidenzlage.
Einen Einblick darin, wie die Akteure in Deutschland denken und fühlen, geben die Vortragsfolien zur Veranstaltung "BfArM im Dialog: Gemeinsam Gesundheit gestalten - Strategie BfArM 2025", die hier herunterladbar sind.
Prasad V, Kim C, Burotto M, Vandross A: The strength of association between surrogate end points and survival in oncology: A systematic review of trial-level meta-analyses. JAMA Internal Medicine 2015 Abstract
Journalistische Beiträge in der Laienpresse dürften für Patienten, die Öffentlichkeit und auch für Investoren eine wichtige Informationsquelle darstellen mit größerer Reichweite als Fachzeitschriften-Beiträge. Die Art der Darstellung dürfte wesentlich dazu beitragen, wie eine Therapieform in der Öffentlichkeit bewertet wird.
Eine amerikanische Studie ging der Frage nach, wie häufig neue Krebstherapien mit Superlativen beschrieben wurden. Die Autoren durchsuchten dafür Google news für den kurzen Zeitraum vom 21. bis 25. Juni 2015 mit dem Suchbegriff "cancer drug" in Verbindung mit den folgenden superlativen Begriffen: breakthrough, game changer, miracle, cure, home run, revolutionary, transformative, life saver, groundbreaking, marvel.
Sie fanden 94 Nachrichten aus 66 unterschiedlichen Nachrichtenquellen mit 97 Superlativen bezogen auf 36 bestimmte und 3 unbenannte Medikamente.
Unter den Therapieformen wurde die gezielte Therapie in 17 der 36 Artikel am häufigsten aufgegriffen, die zytotoxische Therapie bzw. Chemotherapie in 9 Artikeln, Checkpoint Inhibitoren in 5 Artikeln. 3 Artikel mit Superlativen bezogen sich auf Krebsimpfungen bzw. therapeutische Vakzine, einer auf Bestrahlungstherapie und einer auf Gentherapie.
Von den 97 Superlativen bezogen sich 39 auf eine gezielte Therapie, 37 auf einen Checkpoint-Inhibitor, 10 auf ein zytotoxisches Medikament, 5 auf eine Krebsimpfung, 3 nannten keine Therapieform, 2 auf eine Strahlentherapie, eine auf eine Gentherapie.
Von den 36 Substanzen hatten 18 bis Mitte Juli 2015 noch keine Zulassung von der Food and Drug Administration erhalten. Allein auf Grundlage von Tierversuchen, Zellkulturen oder präklinischer Forschung, also ohne Erkenntnisse aus Versuchen an Menschen, wurde 5 Substanzen mit einem Superlativ bedacht.
Die Superlative wurden 53 Journalisten, 26 Ärzten, 9 Industrievertretern, 8 Patienten und einem Kongressabgeordneten zugeschrieben. In der Mehrheit der Fälle wurde der Superlativ nicht vom Autor kommentiert.
Superlative wurden genauso häufig für zugelassene wie für nicht zugelassene Substanzen und für alle Arten von Krebstherapie gebraucht. Superlative erhielten auch Substanzen, wie z.B. Palbociclib und auch Krebsimpfungen, für die bisher keine Daten für einen Patientennutzen aus klinischen Studien vorliegt. Insgesamt wurden 5 Substanzen mit einem Superlativ vorgestellt, für die noch keinerlei Daten aus Studien an Menschen vorlagen.
Krebsmedikamente werden somit in der amerikanischen Öffentlichkeit häufig auf eine Weise dargestellt, dass die Leserinnen und Leser gefährdet sind, den Nutzen weit zu überschätzen, Risiken zu unterschätzen und falsche Hoffnungen zu entwickeln.
Dass eine entsprechende Studie in Deutschland ähnliche Ergebnisse erbringen könnte, zeigen die Ergebnisse bei Google News für die Eingabe der Begriffe "Krebstherapie" und "Durchbruch": zwischen dem 14.10. und 14.11.2015 finden sich 5 unkritische Berichte und 1 Bericht über die hier vorgestellte Studie. "Krebstherapie" und "Innovation" ergibt für denselben Zeitraum 14 Treffer.
Abola MV, Prasad V: THe use of superlatives in cancer research. JAMA Oncology 2015:1-2 Abstract
Serie Neue Krebsmedikamente
1 Nutzen für Patienten fraglich, Preise exorbitant Link
2 Leichtfertige Zulassung in den USA Link
3 "Durchbruch" in der Therapie weckt falsche Hoffnungen
Link
4 Wunder, Revolutionen und Durchbrüche - neue Krebstherapien werden in der amerikanischen Presse häufig mit Superlativen bezeichnet Link
5 folgt: Patientennutzen meistens gering Link
David Klemperer, 6.11.15
Neue Krebsmedikamente 1: Nutzen für Patienten fraglich, Preise exorbitant
 Die Behandlung mit neuen Krebsmedikamenten kostet in den USA zumeist mehr als 100.000 Dollar pro Jahr. Zwei Mitarbeiter des National Cancer Institute der National Institutes of Health sind der Frage nachgegangen, ob der Preis mit wesentlichen Verbesserungen der Behandlungsergebnisse im Vergleich zu den vorher verfügbaren Medikamenten oder zumindest mit neuen Wirkmechanismen zusammenhängt, die einen pharmakologischen Fortschritt bedeuten.
Die Behandlung mit neuen Krebsmedikamenten kostet in den USA zumeist mehr als 100.000 Dollar pro Jahr. Zwei Mitarbeiter des National Cancer Institute der National Institutes of Health sind der Frage nachgegangen, ob der Preis mit wesentlichen Verbesserungen der Behandlungsergebnisse im Vergleich zu den vorher verfügbaren Medikamenten oder zumindest mit neuen Wirkmechanismen zusammenhängt, die einen pharmakologischen Fortschritt bedeuten.
Dafür wurden alle 51 Krebsmedikamente untersucht, die von Anfang 2009 bis Ende 2013 von der amerikanischen Arzneimittelzulassungsbehörde, der Food and Drug Administration, für 63 Indikationen zugelassen wurden. 21 Substanzen hatten einen neuartigen Wirkmechanismus, 30 hingegen einen bereits bekannten Wirkmechanismus ("me-too"-Arzneimittel oder "next-in-class drugs").
Die Preise für die 30 Substanzen mit bekanntem Wirkmechanismus lagen mit durchschnittlich 119.765 Dollar für eine 12-monatige Behandlung etwas höher als die Preise für 21 Substanzen mit neuem Wirkmechanismus, die im Durchschnitt 116.100 Dollar pro Jahr kosteten.
Die Zulassung erfolgte auf Grund der Erfüllung von mindestens einem von 3 Kriterien, die im Folgenden mit den durchschnittlichen Jahresbehandlungskosten genannt werden.
• Gesamtüberlebens (overall survival) 112.370 Dollar
• Ansprechrate (response rate) 137.952 Dollar
• progressionsfreie Überleben 102.677 Dollar
Anzumerken ist hier, dass sowohl eine Verbesserung der Ansprechrate als auch ein verlängertes progressionsfreies Überleben keine Verbesserung der Prognose garantieren und lediglich Surrogatendpunkte darstellen.
Surrogatendpunkte sind dem Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) zufolge "Endpunkte, die selbst nicht von unmittelbarer Bedeutung für einen Patienten sind, aber mit patientenrelevanten Endpunkten assoziiert sind (zum Beispiel Senkung des Blutdrucks als Surrogatparameter für Vermeidung eines Schlaganfalls)".
Kein Zusammenhang bestand zwischen dem Ausmaß des Zusatznutzens (erfasst in progessionsfreiem Überleben oder Gesamtüberleben) und dem Preis.
Davon ausgehend, dass die Entwicklung von Substanzen mit neuartigem Wirkmechanismus aufwändiger ist, als die Modifikation einer vorhandenen Substanz, spiegeln sich im Preis also auch nicht die Entwicklungskosten.
Die Autoren gelangen zum Ergebnis, dass die derzeitige Preisfindung für neue Krebsmedikamente nicht rational sei sondern allein reflektiere, was der Markt hergibt.
Hier ist zu ergänzen, dass von einem Markt nicht gesprochen werden kann, weil neu zugelassene Substanzen unter Patentschutz stehen das damit verbundene Monopol alle Marktmechanismen außer Kraft setzt. Der Hersteller kann den Preis nach Belieben festlegen. Entwicklungskosten und Forschungskosten spielen offensichtlich eine nachgeordnete Rolle. Aus Sicht der Hersteller dürfte es durchaus rational sein, den höchstmöglichen Preis zu erzielen.
Aus Patientensicht ist es hingegen wenig rational, dass Medikamente aufgrund von Surrogatparametern zugelassen werden und es ungeklärt ist, ob sie ob sie überhaupt einen Nutzen für die Patienten haben.
Mailankody S, Prasad V. Five years of cancer drug approvals: Innovation, efficacy, and costs. JAMA Oncology 2015;1:539-40 Volltext
Serie Neue Krebsmedikamente
Neue Krebsmedikamente 1: Nutzen für Patienten fraglich, Preise exorbitant Link
Neue Krebsmedikamente 2: Leichtfertige Zulassung in den USA Link
Neue Krebsmedikamente 3: "Durchbruch" in der Therapie weckt falsche Hoffnungen Link
Neue Krebsmedikamente 4: Wunder, Revolutionen und Durchbrüche - Superlative in der amerikanischen Presse häufig Link
Neue Krebsmedikamente 5: Niedrige Zulassungshürden behindern Fortschritte in der Forschung Link
David Klemperer, 5.11.15
Gut gemeint ist nicht immer gut gemacht: "Open Payment" oder "Sunshine database" zwischen Licht und Schatten!
 Was in Deutschland entweder einer der vielen Träume von Transparenz im Gesundheitswesen ist oder als Eingriff in die Freiheit eines Berufsstandes bekämpft wird, ist in den USA im Prinzip Wirklichkeit - nur fehlen an der Transparenz über die Zahlungen der Pharma- und Medizinprodukteindustrie im Moment mehrere Milliarden US-Dollar und zigtausende Empfänger.
Was in Deutschland entweder einer der vielen Träume von Transparenz im Gesundheitswesen ist oder als Eingriff in die Freiheit eines Berufsstandes bekämpft wird, ist in den USA im Prinzip Wirklichkeit - nur fehlen an der Transparenz über die Zahlungen der Pharma- und Medizinprodukteindustrie im Moment mehrere Milliarden US-Dollar und zigtausende Empfänger.
Seit kurzem kann jedermann auf der von der Regierungseinrichtung "Centers for Medicare & Medicaid Services (CMS)" betriebenen Website "OpenPaymentsData.CMS.gov" erfahren, wie viel Geld die größten Akteure der Gesundheitswirtschaft unter unterschiedlichsten Etiketten (z.B. Forschungsgelder, Finanzierung von Kongressen oder Angebot von Aktien) an wie viele Ärzte und Kliniken in den USA bezahlt haben. Im Jahre 2013 waren dies 3,5 Milliarden US-Dollar, die von 1.419 Herstellern in 4,4 Millionen einzelnen Aktionen an 546.000 Ärzte und 1.360 Kliniken verteilt wurden. Jeder dieser Ärzte und Kliniken erhielt mindestens eine Zuwendung der Industrie.
Diese für Deutschland fast unvorstellbare Durchleuchtung der Einflussnahme auf Leistungsanbieter im Gesundheitswesen ist aber auch in den USA nicht ohne fatale Schattenseiten. Als erstes wirkt die Website als ob es so etwas wie Web Design nicht gäbe. Wer glaubt, schnell die relevanten Daten zu finden, verklickt sich rasch in einer schier endlosen Kette von Links. Zweitens fehlen noch wichtige Informationen über die Identität der Zahlungsempfänger, die bisher lediglich für das Jahr 2015 zugesagt sind. Und drittens teilt die Regierungsbehörde vor wenigen Tagen mit, dass für den Zeitraum August bis Dezember 2013 noch Angaben über die Zahlung von 1,3 Milliarden US-Dollar an 360.000 Ärzte und 873 Kliniken fehlen.
Zu der "open payment"-Informationsquelle findet sich in dem am 7. Oktober 2014 im Wall Street Journal erschienen Artikel More Than $1B in Payments to Doctors is Excluded From Sunshine Database von Ed Silverman etwas mehr. Das Open Payment Data Fact Sheet ist ebenfalls frei zugänglich.
Spätestens dann, wenn die Transparenz komplett ist und auch leichter erreicht werden kann, stellt sich die Frage, warum so etwas Systematisches nicht auch in Deutschland möglich ist.
Bernard Braun, 8.10.14
Wer oder was sorgt für desolate Gesundheitssysteme in Afrika? Die Rolle von Pharmafirmen am Beispiel Uganda.
 Zu den Bedingungen welche die Ausbreitung der akuten Ebola-Erkrankungswelle in Westafrika förderten und zukünftige Ausbrüche ermöglichen, zählen u.a. das Fehlen öffentlicher Krankenversicherungen und fehlende oder personell wie infrastrukturell desolate Versorgungssysteme.
Zu den Bedingungen welche die Ausbreitung der akuten Ebola-Erkrankungswelle in Westafrika förderten und zukünftige Ausbrüche ermöglichen, zählen u.a. das Fehlen öffentlicher Krankenversicherungen und fehlende oder personell wie infrastrukturell desolate Versorgungssysteme.
Dabei entsteht oft der Eindruck oder wird sogar erzeugt, es handle sich dabei ausschließlich um die Unfähigkeit oder den Unwillen der afrikanischen Staaten und Gesellschaften.
Dass für das schwache oder dysfunktionale Gesundheitsversorgungssystem jenseits von Ebola aber auch europäische Akteure aktiv verantwortlich sind, zeigt der gerade veröffentlichte "Pharma Brief spezial" 1/2014 von BUKO Pharma-Kampagne und HEPS Uganda über das Geschäftsverhalten der Pharmafirmen Boehringer Ingelheim, Bayer und Baxter in Uganda, einem der ärmsten Länder Afrikas.
Fakten- und facettenreich kommt diese Untersuchung zu dem Fazit: "Die Markenhersteller haben kein oder nur geringes Interesse daran, ein Land ohne zahlungskräftige PatientInnen mit Arzneimitteln zu beliefern und sich dort in der Forschung zu engagieren. Während Baxter den ugandischen Markt bereits aufgegeben hat, plant Boehringer Ingelheim den Rückzug. Nur die Firma Bayer vertreibt weiterhin Medikamente in Uganda - darunter etliche Hormonpräparate und Verhütungsmittel, manche von eher zweifelhaftem Nutzen."
Das "manche" eine sehr zurückhaltende Bewertung ist, zeigt das Angebot der Firma Bayer auf dem ugandischen Markt: Dort "sind 49 Mayer-Medikamente registriert, von denen wir 21 als irrational bewerteten. 13 Produkte wurden als unentbehrlich eingestuft." Als "irrational" bewerteten die damit beauftragten Pharmazeuten vor allem Meduikamente mit mehreren Wirkstoffen.
Die Studie schildert ausführlich und aus Sicht aller daran Beteiligten oder davon Betroffenen die Folgen dieser Art des freien Marktes, also u.a. die massive gesundheitliche Benachteiligung und Schädigung der sozial schwachen Mehrheit der Bevölkerung.
Und schließlich spricht die Studie noch Fragen an, "denen sich entwicklungs- und gesundheitspolitische Akteure und EntscheidungsträgerInnen stellen sollten: Wie kann es z.B. gelingen, gravierende Versorgungslücken zu schließen, wenn der freie Markt versagt? Wie kann die lokale Produktion gestärkt werden? Und last but not least: Sind Entwicklungshilfegelder - die etwa im Rahmen der Contraceptive-Security-Initiative oder des Jadelle-Access-Programms an die Firma Bayer fließen - ein sinnvoller Anreiz, um Pharmaunternehmen dazu zu bewegen, einen vernachlässigten Markt wie Uganda zu bedienen?"
Positiv vermerken die AutorInnen schließlich das insgesamt positive und konstruktive Kommunikationsverhalten der Firmen, insbesondere im Vergleich zu ihrem Verhalten im Rahmen einer Vorgängerstudie. Dies zeigt, dass Studie wie die jetzt vorgelegte keineswegs nur ohnmächtige Anklagen sind, sondern etwas bewegen können.
Den 52 Seiten umfassenden und ansprechend aufgemachten "Pharma Brief Spezial 1/2014" Arm und vergessen - Untersuchung des Geschäftsverhaltens von Boehringer Ingelheim, Bayer und Baxter in Uganda erhält man als PDF-Datei kostenlos, kann ihn aber auch für 5 € bei der BUKO Pharma-Kampagne in Bielefeld bestellen (info@bukopharma.de).
Über den Stand der Verbreitung des Ebola-Fiebers in Westafrika erfährt man Verlässliches in dem Aufsatz Ebola Virus Disease in West Africa — The First 9 Months of the Epidemic and Forward Projections des WHO Ebola Response Team. Er ist auf der "Ebola Outbreak site" der Fachzeitschrift NEJM am 23. September 2014 veröffentlicht und kostenlos erhältlich. Sein Fazit lautet: "These data indicate that without drastic improvements in control measures, the numbers of cases of and deaths from EVD are expected to continue increasing from hundreds to thousands per week in the coming months."
Bernard Braun, 1.10.14
Stabile KHK und PCI 1: Schlechte Information - schlechte Entscheidungen, gute Informationen - gute Entscheidungen
 Dieser Beitrag befasst sich mit der ersten von 4 neuen Studien über die perkutane Intervention bei stabiler koronarer Herzkrankheit, die ersten 3 sind am 25.8.2014 im JAMA Internal Medicine erschienen, die 4. am 8.9.2014 im British Medical Journal.
Dieser Beitrag befasst sich mit der ersten von 4 neuen Studien über die perkutane Intervention bei stabiler koronarer Herzkrankheit, die ersten 3 sind am 25.8.2014 im JAMA Internal Medicine erschienen, die 4. am 8.9.2014 im British Medical Journal.
Zum Verständnis der Studien ist wesentlich, dass die perkutane Intervention (PCI), also die Aufdehnung einer verengten Herzkranzarterie mit Einsetzen eines Stents, bei Patienten ohne oder mit leichten Angina pectoris-Beschwerden ("stabile KHK") weder das Herzinfarktrisiko noch das Sterberisiko senkt wenn, wenn sie zusätzlich zur in jedem Fall erforderlichen "optimalen medikamentösen Therapie" (OMT) durchgeführt wird. Die PCI hat lediglich einen eher geringen Effekt auf etwaige Angina pectoris-Beschwerden. Patienten ist dies zumeist nicht bewusst, es besteht eine therapeutische Fehleinschätzung ("therapeutic misconception"), in deren Folge der Patient eine Behandlung erhält, die er bei zutreffender Information abgelehnt hätte. Zur ausführlicheren Einführung in die Problematik überflüssiger Stents siehe Forum Beitrag.
Wie sich Patienten mit stabiler KHK entscheiden, wenn sie die Informationen zur PCI in unterschiedlichen Formen erhalten, untersuchten Rothberg et al. in einer kürzlich erschienenen Studie.
An der Studie nahmen 1257 gesunde Probanden ab 50 Jahren teil. Diese versetzten sich über ein schriftliches Szenario in die Situation eines Patienten mit stabiler KHK, der leichte Angina pectoris-Beschwerden verspürt. Alle erhielten die selben Informationen über die technischen Aspekte und die Risiken einer PCI sowie über den Nutzen und die Risiken einer OMT.
Anschließend wurden sie per Zufallszuteilung in 3 Gruppen eingeteilt, in denen ein hypothetischer Kardiologe sie folgendermaßen informierte:
Gruppe 1: keine Informationen über die Effekte der PCI auf einen Herzinfarkt
Gruppe 2:. explizite Information darüber, dass die PCI das Herzinfarktrisiko nicht reduziert
Gruppe 3: erklärende Information, in der über die explizite Information hinaus erläutert wurde, warum die PCI das Herzinfarktrisiko nicht mindert.
Anschließend wurden die Probanden mit Hilfe eines Fragebogens nach ihrem Verständnis gefragt und nach den Konsequenzen, die sie ziehen würden.
Die Ergebnisse:
Ohne Information (Gruppe 1) nahmen 71% fälschlich an, dass eine PCI einen Herzinfarkt verhindern kann. Bei expliziter (Gruppe 2) und bei erklärender Information (Gruppe 3) lag der Anteil deutlich niedriger, aber immer noch bei 30,7% bzw. 30,6%.
Weniger besorgt, in der Zukunft einen Herzinfarkt zu erleiden, waren 64,6% in Gruppe 1, 40,2% in Gruppe 2 und 34,6% in Gruppe 3.
Für eine PCI würden sich entscheiden:
Gruppe 1: 69,4%
Gruppe 2: 48,7%
Gruppe 3: 45,7%
Für eine medikamentöse Therapie (OMT) würden sich entscheiden:
Gruppe 1: 83,1%
Gruppe 2: 87,4%
Gruppe 3: 92,3%
Der Anteil der Probanden, welche die Informationen zutreffend erinnerten, betrug in
Gruppe 1: 22,1%
Gruppe 2: 63,6% und in
Gruppe 3: 69%.
Eine falsche Erinnerung (der Arzt habe mitgeteilt, dass die PCI einen Herzinfarkt verhindern könne) gaben an:
Gruppe 1: 51,9%
Gruppe 2: 20%
Gruppe 3: 17,9%
Die als vom Arzt erhalten erinnerte Information entsprach zumeist auch der Annahme der Probanden, ob die PCI einen Herzinfarkt verhindern könne oder nicht.
Prädiktoren dafür, sich der PCI zu unterziehen, waren die Annahme, dadurch das Herzinfarktrisiko zu mindern, die Sorge einen Herzinfarkt zu erleiden und diese Sorge durch eine PCI zu verringern sowie ein höherer Bildungsgrad.
Prädiktor für eine Entscheidung gegen PCI war die zutreffende Annahme über die Wirksamkeit der medikamentösen Therapie.
Ein wichtiger Prädiktor für die Entscheidung war auch die Erinnerung an das, was der Arzt gesagt hat: diejenigen, die fälschlicherweise erinnerten, der Arzt habe gesagt, dass eine PCI das Herzinfarktrisiko mindere, stimmten der PCI eher zu, als diejenigen, die korrekt erinnerten, dass dies nicht der Fall sei.
Kernpunkte der Studie:
In einem Szenario von Patienten mit stabiler koronarer Herzkrankheit
• verstehen Patienten den Nutzen eines Stents (perkutane Intervention) besser, wenn er ihnen explizit und erklärend mitgeteilt wird,
• versteht ein relevanter Teil der Probanden die Information falsch,
• hängt die Entscheidung für oder gegen die PCI stark von der erinnerten Information ab.
Eine bedarfsgerechte Versorgung von Patienten mit stabiler koronarer Herzkrankheit erfordert somit zwingend, ihnen das Wissen zu vermitteln und das Verständnis sicherzustellen, dass sie ihr Herzinfarktrisiko mit einer PCI nicht mindern, also der therapeutischen Fehleinschätzung entgegenzuwirken. Shared Decision Making ist das hierfür angemessene Konzept der Arzt-Patient-Kommunikation. Informationen in einem Umfang von wenigen Zeilen haben sich als hocheffektiv erwiesen.
Rothberg MB, Scherer L, Kashef M, et al. The effect of information presentation on beliefs about the benefits of elective percutaneous coronary intervention. JAMA Internal Medicine 2014. Abstract
David Klemperer, 9.9.14
4 Jahre nach Beendigung Ergebnisse von 30% der klinischen Studien in USA nicht veröffentlicht - industriefinanzierte allen voran
 Ergebnisse von wissenschaftlichen Studien spielen eine immer gewichtigere und letztlich entscheidende Rolle in der institutionalisierten Zulassung von gesundheitsbezogenen Diagnostika und Therapeutika sowie in öffentlichen Debatten. Wie einige jüngeren Kontroversen gezeigt haben (z.B. die um das Influenza-Präparat Tamiflu der Firma Roche), spielen dabei die Veröffentlichung der Ergebnisse aller Studien, d.h. positiver wie negativer und der freie Zugang zu deren Daten eine oftmals entscheidende Bedeutung, wenn es um die Bewertung ihres Nutzens oder Schadens geht.
Ergebnisse von wissenschaftlichen Studien spielen eine immer gewichtigere und letztlich entscheidende Rolle in der institutionalisierten Zulassung von gesundheitsbezogenen Diagnostika und Therapeutika sowie in öffentlichen Debatten. Wie einige jüngeren Kontroversen gezeigt haben (z.B. die um das Influenza-Präparat Tamiflu der Firma Roche), spielen dabei die Veröffentlichung der Ergebnisse aller Studien, d.h. positiver wie negativer und der freie Zugang zu deren Daten eine oftmals entscheidende Bedeutung, wenn es um die Bewertung ihres Nutzens oder Schadens geht.
Nachdem zum einen seit einiger Zeit gewährleistet ist, dass Studienprotokolle und der zeitliche Ablauf solcher Studien in öffentlich zugänglichen Datenbanken erfasst werden und zum anderen mehrere Male kritisch über die selektive Veröffentlichung von Ergebnissen berichtet wurde, war anzunehmen, dass es damit Schluss sei.
Dass dies ein quantitativ relevanter Irrtum ist und daran auch die alten "Täter" maßgeblich mitwirken, zeigt eine am 15. Juli 2014 veröffentlichte Auswertung der us-amerikanischen Studiendatenbank ClinicalTrials.gov (CTG) bzw. der Veröffentlichungen auf ihrer Website durch ForscherInnen der Boston University School of Public Health (BUSPH).
In diese Auswertung gingen 400 zufällig ausgewählte klinische Studien ein, die im Jahr 2008 laut ihres eigenen Studienprotokolls beendet wurden.
Die wichtigsten Ergebnisse lauten so:
• 4 Jahre nach Beendigung gab es bei 118, d.h. 29,5% dieser Studien keinerlei Veröffentlichung von Ergebnissen in einer Fachzeitschrift oder auf der CTG-Website.
• Die Ergebnisse der restlichen 282 Studien wurden im Durchschnitt erst nach 602 Tagen veröffentlicht.
• Studienergebnisse wurden dann, wenn es sich um solche in früheren Studienphasen (2 versus 3 / 4), nur mit erwachsenen Personen, solche mit Randomisierung oder kleinem Umfang handelte, signifikant weniger veröffentlicht.
• Schließlich wurden die Ergebnisse der von der Industrie finanzierten Studien signifikant weniger veröffentlicht als die ohne Industriesponsoren.
Die Bostoner WissenschaftlerInnen sehen einen auch aktuell beträchtlichen "reporting bias", dessen Niveau und Entwicklung ihres Erachtens "threatens the validity of the clinical research literature in the U.S.". Hinzu kommt das ethische Problem, dass die TeilnehmerInnen an solchen Studien oft aus einer altristischen Grundhaltung heraus teilnehmen und daher auch die völlige Transparenz über jedes Resultat erwarten.
Der Aufsatz How Frequently Do the Results from Completed US Clinical Trials Enter the Public Domain? - A Statistical Analysis of the ClinicalTrials.gov Database. von Hiroki Saito und Christopher J. Gill ist in der Fachzeitschrift "PLoS ONE" (2014; 9 (7): e101826) erschienen und komplett kostenlos zugänglich.
Bernard Braun, 21.7.14
"Nur lesen. Fotografieren und Kopieren verboten" oder wie sich die "European Medicines Agency (EMA)" Transparenz vorstellt
 Auch wenn es lange Zeit gedauert hat und es bei jeder passenden Gelegenheit Verweigerung oder Tricksereien der Arzneimittelhersteller gibt: Um jedem und vor allem auch den gesetzlich damit beauftragten wissenschaftlichen Instituten die Möglichkeit zu geben, den Nutzen und den Schaden durch Arzneimittel überprüfen zu können, muss es vollständige Transparenz über die dazu u.a. von der Pharmaindustrie selbst durchgeführten Untersuchungen geben. Dass zur Transparenz auch die Möglichkeit gehört, die kompletten Texte zu kopieren und mit den darin enthaltenen Daten zusätzliche Berechnungen anzustellen, schien eigentlich zu den Grundregeln geistiger Arbeit oder zur selbstverpflichtenden Transparenzkultur der Hersteller zu gehören.
Auch wenn es lange Zeit gedauert hat und es bei jeder passenden Gelegenheit Verweigerung oder Tricksereien der Arzneimittelhersteller gibt: Um jedem und vor allem auch den gesetzlich damit beauftragten wissenschaftlichen Instituten die Möglichkeit zu geben, den Nutzen und den Schaden durch Arzneimittel überprüfen zu können, muss es vollständige Transparenz über die dazu u.a. von der Pharmaindustrie selbst durchgeführten Untersuchungen geben. Dass zur Transparenz auch die Möglichkeit gehört, die kompletten Texte zu kopieren und mit den darin enthaltenen Daten zusätzliche Berechnungen anzustellen, schien eigentlich zu den Grundregeln geistiger Arbeit oder zur selbstverpflichtenden Transparenzkultur der Hersteller zu gehören.
Dass dies ein Irrtum ist, zeigt ein Blick auf die noch im Mai 2014 öffentlich vorgetragenen Vorstellungen der europäischen Zulassungsbehörde für Arzneimittel zur Nutzung der auf ihrer Website künftig veröffentlichten klinischen Arzneimittel-Bewertungsstudien. In einer am 27. Mai 20124 verbreiteten Pressemitteilung weist das "Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)" - selbst zeitweise an der Expertendiskussion über die Transparenz durch die EMA beteiligt - auf die Absicht der EMA hin, am 12. Juni 2014 folgendes zu beschließen: "Demnach dürfen Interessenten die klinischen Studiendaten lediglich am Bildschirm betrachten. Untersagt sind dagegen das Herunterladen, das Abspeichern, die Bearbeitung, das Abfotografieren, das Ausdrucken, die Verteilung und die Übertragung der Informationen."
Dies ist u.a. einer Präsentation des Chief Policy Adviser der EMA, Noël Wathion, zu entnehmen, der ausgerechnet unter der Überschrift "very user friendly system" u.a. die Akzeptanz der "terms of use" "'view -on-screen-only', not downloadable, not printable" verlangt.
Zusätzlich besteht aber nach derzeitigem Stand noch die Möglichkeit, dass wichtige Details der Studiendaten wie z.B. die Auswirkungen des Medikaments auf patientenrelevante Endpunkte wie die gesundheitliche Lebensqualität von den Herstellern rechtlich zulässig geschwärzt oder gelöscht werden können. So korrekt es ist, Daten, die Rückschlüsse auf einzelne Patienten zuließen, nicht zu veröffentlichen, so nachteilig ist für Patienten die gerade skizzierte Intransparenz.
Die EMA-Präsentation Finalisation of EMA policy on publication of and access to clinical trial data. Targeted consultation with key stakeholders vom Mai 2014 ist kostenlos erhältlich.
Die komplette Pressemitteilung des IQWiG Nur gucken, nicht anfassen: EMA-Nutzungsbedingungen für klinische Studiendaten impraktikabel ist ebenfalls kostenlos erhältlich.
Noch ausführlicher setzen sich mit den herstellerergebenen Vorstellungen der EMA und den damit verbundenen Nachteilen für die Versorgungsqualität drei IQWiG-VertreterInnen, Beate Wieseler, Natalie McGauran und Thomas Kaiser, in dem "rapid response"-Beitrag European drug agency backtracks on plan to give researchers access to clinical trial reports im Medizinjournal "British Medical Journal (BMJ)" vom 21. Mai 2014 (2014;348:g3432) auseinander.
Was bis zur endgültigen Entscheidung der EMA im Juni 2014 und auch danach gilt, ist, dass offensichtlich weder für die Hersteller noch für angeblich unabhängige öffentliche Zulassungs- und Kontrollinstitutionen uneingeschränkte und wirklich nutzerfreundliche Transparenz zu den Grundtugenden gehört auf die man sich verlassen kann.
Bernard Braun, 27.5.14
Überdiagnose und Übertherapie durch Interessenkonflikte in Leitliniengruppen
 Definitionen von Krankheiten und die Kriterien, nach denen sie diagnostiziert werden, beruhen zumeist auf der Übereinkunft der Spezialisten des jeweiligen Fachgebiets. Was auf den ersten Blick vernünftig erscheint, hat sich in der Wirklichkeit als problematisch erwiesen, weil Experten stets auch akademische Eigeninteressen verfolgen und sich um eine möglichst große Bedeutung und Beachtung ihres Gebietes sorgen. Weiterhin sind Experten gerade wegen ihrer Definitionsmacht von größtem Interesse für die Hersteller der Arzneimittel, die im jeweiligen Bereich angewendet werden. Schon fast unbezahlbar werden die Experten für die pharmazeutischen Unternehmen, wenn sie Leitlinien-Gruppen angehören, die sich mit der (Neu-)Festsetzung von Definitionen und diagnostischen Kriterien befassen. Hier kann ein Federstrich zu einer Vergrößerung der Zahl der Betroffenen und zu Millionen zusätzlich medikamentös behandlungsbedürftiger Patienten führen.
Definitionen von Krankheiten und die Kriterien, nach denen sie diagnostiziert werden, beruhen zumeist auf der Übereinkunft der Spezialisten des jeweiligen Fachgebiets. Was auf den ersten Blick vernünftig erscheint, hat sich in der Wirklichkeit als problematisch erwiesen, weil Experten stets auch akademische Eigeninteressen verfolgen und sich um eine möglichst große Bedeutung und Beachtung ihres Gebietes sorgen. Weiterhin sind Experten gerade wegen ihrer Definitionsmacht von größtem Interesse für die Hersteller der Arzneimittel, die im jeweiligen Bereich angewendet werden. Schon fast unbezahlbar werden die Experten für die pharmazeutischen Unternehmen, wenn sie Leitlinien-Gruppen angehören, die sich mit der (Neu-)Festsetzung von Definitionen und diagnostischen Kriterien befassen. Hier kann ein Federstrich zu einer Vergrößerung der Zahl der Betroffenen und zu Millionen zusätzlich medikamentös behandlungsbedürftiger Patienten führen.
Eine Gruppe australischer und amerikanischer Wissenschaftler hat jetzt für den Zeitraum 2000 bis April 2013 für die USA untersucht,
• ob in Leitlinien zu den häufigsten und pharmazeutisch am teuersten zu behandelnden Krankheiten die Krankheitsdefinitionen verändert wurden
• wie groß der Anteil der Wissenschaftler war, die finanzielle Beziehungen zu pharmazeutischen Unternehmen unterhielten
• ob die entsprechenden Firmen Arzneimittel für den Geltungsbereich der jeweiligen Leitlinie anboten.
Die Forscher fanden 16 Leitlinien zu 14 Krankheiten. Für die Ausweitung der Definition bzw. Kriterien bildeten sie 3 Kategorien:
• Prä-Krankheit, wie z.B. Prä-Hypertonie
• Absenkung der diagnostischen Schwelle bzw. niedrigerer Grenzwert
• frühere Diagnosestellung oder andersartige diagnostische Methode.
Bei 2 Krankheiten - HIV und Arthrose - stellten die Autoren keine Veränderungen fest. Eine Ausweitung stellten sie in 10 Leitlinien zu 9 Krankheiten fest (ADHD, Alzheimer, Depression, Cholesterin, Refluxösophagitis, Bluthochdruck, Multiple Sklerose, Herzinfarkt, rheumatoide Arthritis), eine Einengung für die Anämie bei chronischer Niereninsuffizienz und Veränderungen mit unklaren Folgen in 5 Leitlinien zu 4 Krankheiten (Asthma, bipolare Störung, COPD, Diabetes Typ 2).
Als Begründung für die Ausweitung gaben die Leitlinien-Gruppen u.a. die Minderung künftiger Risiken (Cholesterin, Bluthochdruck) oder neue Untersuchungsmethoden und früheren Behandlungsbeginn (Alzheimer) an.
Die Ausweitung einer Krankheitsdefinition kann erwünschte Folgen haben, wie Minderung der Sterblichkeit oder Verbesserung der Lebensqualität aber auch unerwünschte Folgen, wie Überdiagnose, Überbehandlung, Medikalisierung und die Etikettierung beschwerdefreier Menschen als krank. 6 der insgesamt 15 Leitlinien-Gruppen sprachen die unerwünschten Folgen an, zumeist jedoch in sehr knapper und allgemeiner Form, wie z.B. "ethische und praktische Implikationen einer Diagnose des M. Alzheimer in einer präklinischen Phase müssen untersucht werden".
Als finanzielle Verbindung definierten die Autoren Honorare für Vorträge und Beratung, Reisekostenerstattung, Forschungsförderung, Aktienbesitz, Lizenzgebühren und Angestelltenverhältnis. In 13 der 15 Leitlinien-Gruppen fanden sich derartige Verbindungen. Die Diabetes-Gruppe machte die eher nicht glaubwürdige Angabe, niemand habe einen relevanten Interessenkonflikt, die Cholesterin-Gruppe äußerte sich erst gar nicht dazu. Bei den insgesamt 262 Leitlinien-Gruppenmitgliedern bestanden insgesamt 2081 Verbindungen zur Industrie.
Finanzielle Beziehungen zur Industrie hatten u.a.
• 12 der 15 Vorsitzenden der Leitlinien-Gruppen
• 5 von 9 Mitgliedern der ADHD-Gruppe
• 26 von 46 Mitgliedern der Alzheimer-Gruppe
• 23 der 24 Mitglieder einer der beiden Asthma-Gruppen
• 9 der 11 Mitglieder Hypertonie-Gruppe
Im nächsten Schritt prüften die Autoren, wie zielgenau die Industrie ihre Beziehungen zu Mitgliedern von Leitlinien-Gruppen knüpfte.
Bluthochdruck: Die pharmazeutischen Unternehmen Bristol-Myers Squibb, Merck und Novartis bieten die zum damaligen Zeitpunkt (2004) noch Patent-geschützten und daher hochpreisigen Substanzen Irbesartan, Losartan und Amlodipin an. Jeder der 3 Firmen unterhielt finanzielle Beziehungen zu 8 der 11 Mitglieder der Bluthochdruckgruppe. Diese Gruppe prägte den Begriff "Prä-Hypertonie".
COPD: Astra Zeneca, Boehringer-Ingelheim und GlaxoSmithKline bieten zu dieser Krankheit Arzneimittel an. Jede dieser 3 Firmen unterhielt Beziehungen zu 11 der 12 Mitglieder, incl. des Vorsitzenden.
In den Jahren 2009 (wir berichteten) und 2011 (Link) veröffentlichte das amerikanische Institute of Medicine Empfehlungen zur Beschränkung des Einflusses von interessenkonfliktbeladenen Mitgliedern auf die Inhalte der Leitlinien. Die Autoren stellten fest, dass diese Empfehlungen kaum befolgt werden.
Zusammenfassend sind finanzielle Verbindungen von Leitlinien-Gruppenmitgliedern zu Firmen, die Medikamente zur Behandlung der jeweiligen Krankheiten anbieten, eher die Regel als die Ausnahme. Diese Studie belegt, dass die Industrie Beziehungen zu den Experten pflegt, die über die Ausweitung der Krankheitsdefinitionen und damit über die Größe des Absatzmarktes für Medikamente entscheiden. Damit werden der Überdiagnose - eine Diagnose mit negativer Nutzen-Schaden-Bilanz - und der Übertherapie der Weg gebahnt.
Moynihan RN, Cooke GPE, Doust JA, Bero L, Hill S, Glasziou PP: Expanding Disease Definitions in Guidelines and Expert Panel Ties to Industry: A Cross-sectional Study of Common Conditions in the United States. PLoS Med 2013; 10: e1001500. Download Volltext
Report zu Interessenkonflikte in der medizinischen Forschung, Ausbildung und Praxis:
Lo B, Field MJ. Conflict of Interest in Medical Research, Education, and Practice. Washington D.C., 2009. Website
Report zu klinischen Leitlinien
Institute of Medicine (IOM). Clinical Practice Guidelines We Can Trust, 2011 Website
s.a. Kategorie Einflussnahme der Pharma-Industrie Link
David Klemperer, 19.12.13
Rosarote Brille - Gefahr für Patienten. Interessenkonflikte bei Autoren von Leitlinien
 Interessenkonflikte beeinträchtigen das Urteilsvermögen und bringen die Menschen dazu, Dinge so zu sehen, wie sie nicht sind. Was im Alltag bisweilen ein Teil von Lebenskunst darstellt, kann in der Medizin zu einer ernsten Gefahr für Patienten werden. Interessenkonflikte lassen Personen den Nutzen einer Technologie, z.B. eines Arzneimittels, höher erscheinen und den Schaden niedriger als Personen ohne Interessenkonflikt. Gegebene Studiendaten bewerten sie optimistisch, Gefahren und Risiken ignorieren sie. Dem liegt zumeist keine böse Absicht vor, vielmehr laufen die entsprechenden kognitive Vorgänge unbewusst ab. Am Beispiel des Diabetesmittels Avandia (Rosiglitazon) haben wir dieses Phänomen bereits im Forum dargelegt (Link).
Interessenkonflikte beeinträchtigen das Urteilsvermögen und bringen die Menschen dazu, Dinge so zu sehen, wie sie nicht sind. Was im Alltag bisweilen ein Teil von Lebenskunst darstellt, kann in der Medizin zu einer ernsten Gefahr für Patienten werden. Interessenkonflikte lassen Personen den Nutzen einer Technologie, z.B. eines Arzneimittels, höher erscheinen und den Schaden niedriger als Personen ohne Interessenkonflikt. Gegebene Studiendaten bewerten sie optimistisch, Gefahren und Risiken ignorieren sie. Dem liegt zumeist keine böse Absicht vor, vielmehr laufen die entsprechenden kognitive Vorgänge unbewusst ab. Am Beispiel des Diabetesmittels Avandia (Rosiglitazon) haben wir dieses Phänomen bereits im Forum dargelegt (Link).
Über einen neuen Fall berichten jetzt Autoren, die aus dem Kreis der Arzneimittelkommission der deutschen Ärzteschaft stammen. Die im Deutschen Ärzteblatt erschienene Studie "Besteht ein Einfluss pharmazeutischer Unternehmen auf Leitlinien? Zwei Beispiele aus Deutschland" wurde von der Förderinitiative Versorgungsforschung der Bundesärztekammer unterstützt.
Untersucht wurde die Bewertung des Medikaments Raptiva (Substanz: Efalizumab), das gegen eine bestimmte Form der Schuppenflechte (Psoriasis) eingesetzt wurde, in 2 Leitlinien, eine erstellt von Autoren mit und eine von Autoren ohne Interessenkonflikte.
• Die S3-Leitlinie (Version 2006) der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) wurde von einer 15-köpfigen Gruppe verfasst, in der 10 Mitglieder finanzielle Verbindungen zur Firma Serono hatten, dem Lizenzinhaber von Raptiva. Darüber hinaus wurde die Arbeit der Leitlinien-Gruppe von einer Stiftung gefördert wurde, die u.a. von Serono unterstützt wurde.
• Ohne Interessenkonflikte war hingegen die Arbeitsgruppe, welche die Leitlinie für das englische National Institute of Health and Care Excellence (NICE) verfasste.
Die Unterschiede in der Bewertung kritischer Sachverhalte zeigen die Autoren durch den Vergleich der Formulierungen zu identischen Sachverhalten auf.
Dazu 3 Beispiele aus der Studie:
• Die NICE-Leitlinie sieht die Indikation für Efalizumab nur dann gegeben, wenn eine andere Substanz, Etanercept, unwirksam ist bzw. nicht gegeben werden darf. In der S3-Leitlinie wird Efalizumab hingegen bei mittelschwerer und schwerer Form der Psoriasis zur Ersttherapie empfohlen. Zugelassen war es aber nur für Patienten, bei denen alle Standardtherapien versagt haben.
• In die NICE-Leitlinie wurden 5 randomisierte kontrollierte Studien einbezogen, von denen 4 wegen mangelnder Darstellung als in ihrer Qualität nicht beurteilbar bewertet wurden. Die S3-Leitlinie stützt sich auf 6 Studien, das Evidenzniveau bezeichnen die Autoren als insgesamt sehr gut. Eine Studie wird als vergleichende Studie klassifiziert, obwohl sie das nicht ist.
• Zur Frage der Kombination mit anderen Arzneimitteln rät das NICE ab, weil keine Studien dazu vorliegen. Die Autoren der S3-Leitlinie stellen ebenfalls fest, dass keine kontrollierten Studien zu dieser Frage vorliegen, stellen dann aber im Folgesatz unvermittelt fest: "Eine Kombination (...) erscheint möglich und sinnvoll."
An anderer Stelle lassen sich die S3-Leitlinie-Autoren zu der Aussage hinreißen: "Efalizumab besitzt aus heutiger Sicht ein günstiges Sicherheitsprofil." Die NICE-Autoren urteilen hier sehr viel zurückhaltender und weisen auf die Unsicherheit der Datenlage hin.
Die Beispiele zeigen, dass die Autorengruppe mit Interessenkonflikten das Medikament wie durch eine rosarote Brille betrachten, hinter der Unsicherheiten und Probleme verschwinden. Raptiva ist ein - weiteres - Beispiel dafür, dass dies für Patienten tödlich ausgehen kann: Das immunsuppressiv wirkende Raptiva wurde im Februar 2009 wegen einiger Fälle von schweren, teils tödlichen endenden Infektionen vom Markt genommen (Link zur Information des Herstellers).
Das Fallbeispiel Raptiva ist auch ein weiterer Beleg dafür, dass Leitlinien vom Einfluss der Industrie durch eine undurchlässige Wand geschützt werden müssen.
Ein zweiter Aspekt der Studie - der hier nicht näher ausgeführt werden soll - ist der an der Substanz Gabapentin geführte Nachweis, dass Daten, die von einem pharmazeutischen Unternehmen betrügerisch manipuliert wurden, Eingang in S3-Leitlinie gefunden haben.
Schott G, Dünnweber C, Mühlbauer B, Niebling W, Pachl H, Ludwig W-D. Besteht ein Einfluss pharmazeutischer Unternehmen auf Leitlinien? Zwei Beispiele aus Deutschland. Deutsches Ärzteblatt 2013;110:575-583 Link
Deutsche Gesellschaft für Dermatologie. S3-Leitlinie zur Therapie der Psoriasis vulgaris.
Version 2006: Nast A, Kopp IB, Augustin M, et al.: S3-Leitlinie zur Therapie der Psoriasis vulgaris. J Dtsch Dermatol Ges 2006; 4 Suppl 2, 1-126 Link zum kostenpflichtigen Download
National Institute of Health and Care Excellence (NICE). Bewertung von Raptiva im Juli 2006. Link
Wang AT, McCoy CP, Murad MH, Montori VM. Association between industry affiliation and position on cardiovascular risk with rosiglitazone: cross sectional systematic review.
Link BMJ 2010;340:c1344
Link Forum Gesundheitspolit
David Klemperer, 8.9.13
Selten teure "rauchende Colts": Fast 500 Millionen US-$ Strafe für vorsätzlich gesetzwidrige Vermarktung eines Medikaments
 Weil die kritische Auseinandersetzung mit Vermarktungsstrategien der Arzneimittelhersteller, die Gewinnziele vor Patienteninteressen stellen, oft keine eindeutigen Belege findet, verdienen die wenigen klaren Fälle umso mehr öffentliche Aufmerksamkeit.
Weil die kritische Auseinandersetzung mit Vermarktungsstrategien der Arzneimittelhersteller, die Gewinnziele vor Patienteninteressen stellen, oft keine eindeutigen Belege findet, verdienen die wenigen klaren Fälle umso mehr öffentliche Aufmerksamkeit.
Dies gilt auch für die am 30 Juli 2013 öffentlich abgeschlossene Auseinandersetzung zwischen dem bis 2009 selbstständigen und dann vom Branchenführer Pfizer gekauften Pharmaunternehmen Wyeth und der in den USA für die Zulassung von Arzneimitteln zuständigen US-Food and Drug Administration (FDA) bzw. dem US-Justizministerium. Das Unternehmen akzeptiert damit, für die mit Vorsatz und mit enormem Aufwand betriebene ungesetzliche Vermarktung seines Medikaments Rapamune eine Strafe von 490,9 Millionen US-Dollar bezahlen zu müssen.
Das Medikament sollte Abstoßreaktionen des körpereigenen Immunsystems gegen ein implantiertes Organ verhindern. 1999 erhielt die Firma nach entsprechenden Vorstudien und Prüfungen durch die FDA die Zulassung - allein und ausdrücklich für den Einsatz bei Patienten mit einer Nierentransplantation. Die Firma hinderte dies nicht daran, fast unmittelbar nach dieser Zulassung ihre Pharmareferenten mit Vertriebsmaterialien auszustatten, in denen das Medikament ohne Nutzenbelege und vor allem ohne FDA-Zulassung auch für Patienten empfohlen wurde, die ein anderes Organ implantiert bekommen hatten. Um Ärzte zu diesem so genannten "off label"-Einsatz überreden zu können, trainierte die Firma ihre Referenten speziell und offerierte ihnen für den Erfolgsfall auch spezielle finanzielle Anreize bzw. Bonusse. Die staatlichen Aufseher und Ermittler sahen darin nicht nur ein Verhalten, das den Firmengewinn "ahead of the health and safety of a highly vulnerable patient population dependent on life-sustaining therapy" stellte, sondern einen von 1998 bis 2009 reichenden fortgesetzten Verstoß gegen den "False Claims Act".
Weitere Einzelheiten können in der vom US-Justizministerium erstellten Presseerklärung Wyeth Pharmaceuticals agrees to pay $490,9 million for marketing the prescription drug Rapamune for unapproved uses" nachgelesen werden.
Bernard Braun, 9.8.13
"Within the coming days" oder wie aus Tagen Jahre werden können: Die "Tamiflu Campaign" 2003/2009 bis 2013 - und (k)ein Ende!?
 Seit 2009 führen die HerausgeberInnen des renommierten Medizinjournals "British Medical Journal (BMJ)" und Wissenschaftler der Influenza-Cochrane-Reviewergruppe eine zähe Auseinandersetzung um die tatsächliche Wirkung des zur Wirkstoffgruppe der Neuraminidasehemmer gehörenden Medikaments Tamiflu des Pharma-Großunternehmens Roche (siehe dazu u.a. den folgenden Tamiflu III-Betrag im forum-gesundheitspolitik).
Seit 2009 führen die HerausgeberInnen des renommierten Medizinjournals "British Medical Journal (BMJ)" und Wissenschaftler der Influenza-Cochrane-Reviewergruppe eine zähe Auseinandersetzung um die tatsächliche Wirkung des zur Wirkstoffgruppe der Neuraminidasehemmer gehörenden Medikaments Tamiflu des Pharma-Großunternehmens Roche (siehe dazu u.a. den folgenden Tamiflu III-Betrag im forum-gesundheitspolitik).
Nachdem die Cochrane-Reviewer in einem ersten Review an der vom Hersteller und in einer einzigen Metaanalyse diverser Einzelstudien durchweg positiv dargestellten Wirkung zweifelten und Zugang zu einer Vielzahl von Roche offensichtlich nicht veröffentlichten Wirkungsstudien forderten, begann eines der spannendsten und lehrreichsten Kapitel in der neueren Gesundheitspolitikgeschichte. Dies verhinderte aber nicht, dass Tamiflu und ein weiteres vergleichbares Mittel zeitweise von vielen Aerzten und Regierungen als präventives und kuratives Wundermittel gegen die Vogel- und zur Pandemie hochgejazzten Schweinegrippe gehalten und millionenfach steuerfinanziert eingelagert wurden und zu Milliardenumsätzen führten.
Dieses Kapitel ist vor allem durch das Nebeneinander von wiederholten Versprechungen Roche's geprägt, die Informationen zur Verfügung zu stellen, und dies gleichzeitig durch fintenreiche Manöver und ohne irgendeinen Täuschungsversuch auszulassen zu verhindern. Nachdem die ForscherInnen und die Oeffentlichkeit bis 2012 zwar von immer mehr unveröffentlichten Untersuchungen und Reports von Roche und anderen erfuhr, aber keinen Zugang zu ihnen erhielten, startete das BMJ eine einmalige so genannte "open data campaign", die das Ziel verfolgte "to achieve appropriate and necessary independent scrutiny of data from clinical trials. Working with others, we seek to highlight the problems caused by lack of access to data, and we welcome any suggestions on how to take things further."
Mit dem erneuten Versprechen, sämtliche ("full") anonymisierten Daten samt den unveröffentlichten Studien im April 2013 zu veröffentlichen, ist möglicherweise nach über vier Jahren die Basis geschaffen, die Wirkungen des zwischenzeitlich zu einem wahren Blockbuster gewordenen Tamiflu unabhängig zu überprüfen.
Wer das reich mit Originalkorrespondenzen zwischen Wissenschaftlern, dem BMJ, der WHO und der Firma Roche sowie einer Reihe von nationalen wie europäischen Aufsichts- und Zulassungsinstitutionen für Arzneimittel sowie frei zugänglichen Aufsätzen illustrierte Lehrstück überblicken und sich in sein Studium vertiefen will, findet den Zugang über die stetig aktualisierte BMJ-Website "Tamiflu campaign". Auf ihr findet sich auch eine interaktive Zeitschiene der pharmakologischen und medizinischen Untersuchungen über die erwünschten und unerwünschten Wirkungen von Tamiflu, die im Moment die Jahre 2003 bis 2013 umfasst. Dort gibt es auch eine Fülle von Links zu wichtigen vor allem im BMJ publizierten Tamiflu-Aufsätze.
Wer nachvollziehen will, warum manche Akteure dieser Debatte auch dem letzten Transparenzversprechen der Firma Roche nicht recht glauben wollen, sollte sich die vier Seiten umfassende Antwort von Peter Doshi auf die letzte Erklärung zur "Roche data transparency policy" vom 1. März 2013 durchlesen. Dort wird u.a. klar, wie eine unabhängige Forschung à la Roche aussieht. Die Firma schlägt in einer Art "samtenem" Junktim vor, die Datensichtung und -bewertung durch eine "Multiparty Group for Advice on Science" begleiten zu lassen, als einem "fair, transparent and independent way of adressing data transparency regarding Tamiflu". Laut Doshi zeigen aber eindeutige und auch per Link zugängliche Dokumente, dass wenigstens drei der vier von Roche ins Auge gefassten Leiter der Gruppe nicht unabhängig sind, sondern bis vor kurzem noch finanzielle Beziehungen zu Roche hatten.
Wer jemals wieder behauptet, mangelnde Transparenz über den Nutzen und den Schaden von Arzneimitteln, die signifikante Nichtveröffentlichung von negativen Studienergebnissen und zahlreiche weitere Methoden Transparenz über Arzneimittel zu verhindern, seien "Ausrutscher" oder das Werk einzelner "schwarzer Schafe", sollte sofort mittels der Internetadresse der "Tamiflu Campaign" und mit dem Beispiel der durchgeplanten Strategien eines der größten Pharmaunternehmen der Welt eines Besseren belehrt werden.
Bernard Braun, 7.4.13
Brustkrebs: Studienergebnisse häufig verfälscht und verzerrt
 Übertreibung des Nutzens und Verschweigen der unerwünschten Wirkungen sind weit verbreitet, so lautet das Fazit einer Analyse von 164 Studien zur Wirksamkeit der Behandlung von Brustkrebs. Die Folge: Ärzte und Patienten gründen Behandlungsentscheidungen auf falsche, schöngefärbte Vorstellungen.
Übertreibung des Nutzens und Verschweigen der unerwünschten Wirkungen sind weit verbreitet, so lautet das Fazit einer Analyse von 164 Studien zur Wirksamkeit der Behandlung von Brustkrebs. Die Folge: Ärzte und Patienten gründen Behandlungsentscheidungen auf falsche, schöngefärbte Vorstellungen.
Ein kanadische Arbeitsgruppe untersuchte 164 randomisierte kontrollierte Studien (RCTs) unter der Frage, ob die Ergebnisse in Fachzeitschriften wahrheitsgemäß oder verfälscht bzw. verzerrt wiedergegeben werden.
In RCTs geht es um die Frage, ob eine neue Therapiemethode, z.B. ein neues Medikament oder eine neue Operationstechnik, besser ist als die bis dahin für am Besten erachtete. Der Begriff "primärer Endpunkt" bezeichnet das Kriterium, an dem der Erfolg bzw. Misserfolg der Intervention gemessen wird, also z.B. die Überlebenszeit. Sekundäre Endpunkte (SE) sind Ergebnisse, die ebenfalls wissenswert sind, aber nicht den Erfolg einer Therapie ausmachen. Übertragen auf ein Fußballmatch ist die Anzahl der Tore der PE, die Anzahl der Ecken ein SE. Würde die nach Toren unterlegene Mannschaft die erzielten bzw. nicht erzielten Tore (PE) verschweigen und stattdessen das für sie günstige Eckenverhältnis (SE) angeben, entstünde ein falsches bzw. verzerrtes Bild davon, welche Mannschaft besser ist.
In die Analyse gingen 164 Studien aus den Jahren 1995 bis 2011 ein. 148 Studien befassten sich mit medikamentösen Therapien, 11 mit Bestrahlungstherapie und 5 mit operativer Behandlung. Zu gleichen Teilen ging es um Therapien zur Verbesserung der Heilungsaussichten (adjuvante Therapie) und um Therapien bei metastasiertem Brustkrebs, wo eine Verbesserung der Überlebenszeit möglich aber eine Heilung nicht zu erwarten ist.
Ein sicheres Erfolgskriterium für eine Krebstherapie ist das Gesamtüberleben (overall survival, OS). Unsicher sind hingegen Kriterien wie progressionsfreies Überleben (progession-free survival, PFS) oder krankheitsfreies Überleben (disease-free survival, DFS), weil z.B. eine längere Zeit ohne feststellbares Tumorwachstum häufig mit nicht verbesserter oder gar verkürzter Überlebenszeit einhergeht. Umso bemerkenswerter ist es, dass in 137 Studien mit PFS bzw. DFS unsichere PE zum Erfolgskriterium ausgewählt wurden und OS, also Gesamtüberleben, nur in 27 Studien (16,5%).
Verzerrungen (Bias) stellten die Forscher im Berichten der PEs in 33% und im Berichten der Toxizität in 67% fest. 92 der 164 Studien hatten ein negatives Ergebnis bezüglich des PE, die neue Therapie war also nicht besser als die herkömmliche Behandlung. In 59% dieser Studien wurde der eigentlich negative PE positiv dargestellt oder verschwiegen und stattdessen ein positiver SE berichtet. Hier wurde also Nutzen suggeriert, wo keiner war.
Die schwere und lebensbedrohliche Folgen der Therapie (Toxizität Grad 3 und 4) wurden nur in einem Drittel der Veröffentlichungen im Abstract angegeben.
30 der Studien waren im Studienregister ClinicalTrials.gov eingetragen. Der Vergleich der hier eingetragenen PE mit den in der Veröffentlichung aufgeführten PE zeigte, dass in 7 Studien der PE verändert wurde (im Sinne von Eckstöße statt Tore). In 130 Studien konnte dieser Vergleich nicht durchgeführt werden, weil sie nicht registriert waren.
Diese Studie ist ein weiterer Beleg für die gravierenden Missstände im Bereich der medizinischen Forschung.
So erscheint es inakzeptabel, dass Studien mit hochwirksamen Medikamenten durchgeführt werden, deren Erfolg an Kriterien gemessen wird, die zweifelsfrei unzulänglich sind. Hier sind die Ethikkommissionen, die Zulassungsbehörden und auch die Fachzeitschriften gefordert. Letztere könnten z.B. die Veröffentlichung derartiger Studien ablehnen.
Verfälschungen und Verzerrungen bei der Veröffentlichung von Studienergebnissen -nach wie vor eher die Regel als die Ausnahme - sind nur verhinderbar durch Transparenz: alle Informationen über eine Studie müssen überprüfbar gemacht werden. Dafür ist nicht nur die Registrierung aller Studien zu fordern sondern auch die Pflicht zur zeitnahen Veröffentlichung der Ergebnisse sowie der Einblick in das Studienprotokoll und die Möglichkeit zur unabhängigen Überprüfung der gewonnenen Daten.
Die Autoren haben folgerichtig ihre eigene Arbeit frei zugänglich gemacht.
Vera-Badillo FE, Shapiro R, Ocana A, Amir E, Tannock IF.
Bias in reporting of end points of efficacy and toxicity in randomized, clinical trials for women with breast cancer. Annals of Oncology 2013 Volltext der Studie
Zur Vertiefung des Themas hier ein Link auf die Website eines wissenschaftlichen Symposiums, das am 10. und 11.10.2012 in Freiburg stattgefunden hat mit dem Thema "ACT now: Accuracy, Completeness, and Transparency in health research reporting". Die Vorträge und Vortragsfolien sind abrufbar.
Ebenfalls zum Thema ein 13-minütiges sehenswertes Video von Ben Goldacre, das sich an die breite Öffentlichkeit wendet. Es wurde im September 2012 veröffentlicht und verzeichnet bislang 572.000 Aufrufe.
Ben Goldacre: What doctors don't know about the drugs they prescribe. Link
David Klemperer, 15.1.13
Resultate und Schlussfolgerungen von herstellergesponsorten Medikamenten- und Gerätestudien vielfach signifikant verzerrt
 Resultate aus klinischen Studien über Arzneimittel oder medizinische Geräte stellen zunehmend die verpflichtende (Stichwort: evidenzbasierte Leitlinien) Grundlage für das diagnostische und therapeutische Handeln von Ärzten und damit für die Qualität der Behandlung von Patienten dar: Evidenz statt Eminenz!
Resultate aus klinischen Studien über Arzneimittel oder medizinische Geräte stellen zunehmend die verpflichtende (Stichwort: evidenzbasierte Leitlinien) Grundlage für das diagnostische und therapeutische Handeln von Ärzten und damit für die Qualität der Behandlung von Patienten dar: Evidenz statt Eminenz!
Parallel hierzu werden aber aus verschiedenen Gründen immer mehr dieser Studien von den Herstellern dieser Produkte selber durchgeführt oder werden von diesen vollkommen oder teilweise gefördert. Frühere systematische Reviews aber auch Einzelbeobachtungen oder -Berichte haben immer wieder auf das potenzielle oder auch reale Risiko hingewiesen, dass solche herstellergesponsorte Studien verzerrte ("industry bias") Ergebnisse produzieren oder veröffentlichen, die viel mehr als in Studien, die anderweitig finanziert und organisiert sind, zugunsten der Produkte der Sponsoren ausfallen. Diesen systematischen Zusammenhang bestreiten die Hersteller und Sponsoren meist mit dem Hinweis, es handle sich um Einzelfälle oder "schwarze Schafe" oder um Altfälle.
Ein Ende 2012 von Mitgliedern der international besetzten "Cochrane Methodology Review Group", darunter Mitarbeiter des renommierten "Nordic Cochrane Centre" in Kopenhagen, als Update früherer Reviews vorgelegter Methodenreview von 48 Studien (darunter Querschnittsstudien, Kohortenstudien, systematische Reviews und Metaanalysen) aus den Jahren 1948 bis Sommer 2011, nimmt den genannten Verharmlosungsstrategien aber den meisten Wind aus den Segeln.
Der Vergleich von Ergebnissen der beiden Sponsorenschaftstypen zeigt Folgendes:
• Herstellergesponsorte Studien haben statistisch signifikant mehr für den Sponsor vorteilhafte Ergebnisse zur Wirkung der untersuchten Medikamente und medizinische Geräte (RR: 1,24), zu ihren möglichen Nachteilen oder Schadenspotenzial (RR: 1,87) und bei den gesamten Schlussfolgerungen (RR: 1,31).
• Von den 10 Papieren, die über die Wirkstärken der untersuchten Produkte und der Sponsorenschaft der Studien berichten, finden 5 Papiere im Vergleich beider Sponsorenschaftstypen in Herstellerstudien durchweg größere Wirkstärken. Die restlichen 5 Studien finden dagegen keine Unterschiede bei der berichteten Wirkstärke.
• Der nachgewiesene Zusammenhang von Sponsorenschaft und der Art der Schlussfolgerungen unterscheidet sich zwischen Arzneimittel- und Gerätestudien nicht bzw. zeigt sich in beiden Studienarten.
• In industriegesponsorten Studien gab es statistisch signifikant weniger Übereinstimmung zwischen den berichteten Resultaten und den Schlussfolgerungen (RR: 0,84).
• Bei den meisten Standardfaktoren, die das Risiko einer systematischen Verzerrung erhöhen, gibt es zwischen industriegesponsorten und anderweitig finanzierten Studien keinen Unterschied - mit Ausnahme der Verblindung, wo Industriestudien ein signifikant leicht erhöhtes Risiko (RR: 1,32) für dadurch induzierte Verzerrungen haben.
Die gerade zitierten Spuren des "industry bias" bei herstellergesponsorten Studien lassen sich nach Feststellung der Reviewer schließlich nicht mit der Wirkung anderer Standard-Verzerrungsfaktoren erklären.
Die Gesamtbewertung Wirkungen der Studienförderung durch die Hersteller lautet daher: "Sponsorship of drug and device studies by the manufacturing company leads to more favorable results … and conclusions than studies sponsored by other sources. Our analyses suggest the existence of an industry bias"
Für die Methodik der weiteren Erforschung dieses Bias lautet die Empfehlung der Reviewer so: "Consequently, our data suggest that industry sponsorship should be treated as bias-inducing and industry bias should be treated as a separate domain. There are many subtle mechanisms through which sponsorship may influence outcomes, and an assessment of sponsorship should therefore be used as a proxy for these mechanisms. Interestingly, the AMSTAR tool for methodological quality assessment of systematic reviews includes funding and conflicts of interest as a domain."
Von dem 85-seitigen Cochrane-Review "Industry sponsorship and research outcome" von Lundh A, Sismondo S, Lexchin J, Busuioc OA und Bero L. (Cochrane Database of Systematic Reviews 2012, Issue 12) gibt es kostenlos das ausführliche Abstract.
, 11.1.13
Ausgeprägte Interessenkonflikte bei der Erarbeitung des DSM-V
 Was eine psychiatrische Diagnose ist und was nicht, entscheiden Experten. Die Definitionsmacht liegt hier weitgehend bei der American Psychiatric Association (APA). Im Jahr 1952 erschien die erste Version ihres Diagnosekataloges "Diagnostic and Statistical Manual of Mental Disorders" (DSM). Im Mai 2013 soll die fünfte Version erscheinen. Da sich die Internationale Klassifikation der Krankheiten (ICD) der Weltgesundheitsorganisation im psychiatrischen Bereich am DSM orientiert, prägt der DSM die Psychiatrie weltweit.
Was eine psychiatrische Diagnose ist und was nicht, entscheiden Experten. Die Definitionsmacht liegt hier weitgehend bei der American Psychiatric Association (APA). Im Jahr 1952 erschien die erste Version ihres Diagnosekataloges "Diagnostic and Statistical Manual of Mental Disorders" (DSM). Im Mai 2013 soll die fünfte Version erscheinen. Da sich die Internationale Klassifikation der Krankheiten (ICD) der Weltgesundheitsorganisation im psychiatrischen Bereich am DSM orientiert, prägt der DSM die Psychiatrie weltweit.
Über die sich abzeichnende hochproblematische Ausweitung der psychiatrischen Diagnosekategorien habe wir berichtet (Medikalisierung der emotionalen Höhen und Tiefen - Neu ab 2013 im "Diagnostic and Statistical Manual of Mental Disorder" Link)
In einer Pressemitteilung zur Berufung der Steuerungsgruppe im Juli 2007 erklärte die APA, dass die Patienten ein Anrecht auf ein Manual hätten, das auf dem Stand der Wissenschaft und frei von Interessenkonflikten sei. Alle Mitglieder müssten ihre finanziellen Verbindungen zur Industrie offenlegen. Im Jahr 2007 und den Folgejahren durfte das Einkommen aus Industriequellen nicht mehr als 10.000 Dollar betragen mit Ausnahme von Studiensponsoring.
In einem Beitrag in PLoS Medicine untersuchten die amerikanischen Wissenschaftler Lisa Cosgrove und Sheldon Krimsky, inwieweit die Öffentlichkeit darauf vertrauen kann, dass die APA in der Erarbeitung des DSM-V ihrem Anspruch auf Objektivität und Freisein von finanziellen Interessenkonflikte gerecht wird.
Die Steuerungsgruppe besteht 29 Mitgliedern, von denen 19 (71%) einen finanziellen Interessenkonflikt (financial conflict of interest - FCOI) angeben.
Die 13 Arbeitsgruppen mit insgesamt 141 Mitgliedern sind verantwortlich für die Überarbeitung der diagnostischen Kategorien und für die Aufnahme neuer Störungen in eine diagnostische Kategorie. In den meisten Arbeitsgruppen stellen Mitglieder mit FCOI die Mehrheit. Am stärksten ausgeprägt sind die FCOI in den Arbeitsgruppen, die sich mit Krankheitsbildern befassen, die an erster Stelle mit Medikamenten behandelt werden. Mit anderen Worten: die Mehrheit der Arbeitsgruppen, die sich mit der Überarbeitung und der Definition der jeweiligen Störungen befassen, stellen Experten, welche finanzielle Beziehungen zu den Firmen haben, die Medikamente für genau diese Störungen herstellen, so z.B.
• 12 von 18 Experten in der Arbeitsgruppe Affektive Störungen
• 12 von 14 Experten in der Arbeitsgruppe Psychotische Störungen
• 7 von 7 Experten in der Arbeitsgruppe Schlaf-Wach-Störungen.
Bereits im Jahr 2006 hatte Lisa Cosgrove über die Interessenkonflikte in der DSM-IV-Gremien berichtet (Link). Da es zur Zeit der Erarbeitung des DSM-IV noch keine Verpflichtung zur Offenlegung von Interessenkonflikte gab, suchte man im Internet nach Publikationen, in denen die Interessenkonflikte erklärt werden mussten und fand heraus, dass 95 der damaligen 170 Arbeitsgruppen-Mitglieder (65%) finanzielle Beziehungen zur Industrie pflegten, in den Arbeitsgruppen Affektive Störungen und Psychotische Störungen jeweils 100%.
Die Autoren erkennen es als Fortschritt an, dass die APA mittlerweile die Offenlegung von Interessenkonflikten für Mitglieder des Steuerungskomitees und der Arbeitsgruppen verpflichtend vorschreibt, weist jedoch auf folgende Lücken hin:
• Eine Begrenzung der Einnahmen aus Industriequellen auf 10.000 Dollar pro Jahr sowie des Aktienbesitzes auf 50.000 Dollar ist willkürlich. Die Vorstellung, dass Interessenkonflikte erst oberhalb dieser Grenzen entstehen ist falsch.
• Industriegelder für Studien müssen nicht genannt werden, obwohl die Abhängigkeit der Studienergebnisse vom Sponsor ("funding effect") hinlänglich bekannt ist (wir berichteten).
• Die Mitglieder müssen die Geldbeträge, die sie von der Industrie erhalten, nicht nennen.
• Die Mitgliedschaft in sog. speakers' bureaus ist nicht explizit anzugeben sondern kann in der Kategorie "Vortragshonorare" verbucht werden. Speakers' bureaus sind Agenturen, die der Industrie Wissenschaftler als Referenten vermitteln. Die Kontrolle über die Inhalte liegen zumeist auf Seiten der Firma. Da es sich bei dieser Vortragstätigkeit um reines Marketing handelt, empfiehlt die Association of American Medical Colleges ihren Mitgliedern, mit diesen Agenturen nicht zu kooperieren (wir berichteten).
Tatsächlich gab kein einziges DSM-V- Arbeitsgruppen-Mitglied diese Art von Verbindung an, obwohl eine Internetrecherche der Autoren über die Jahre 2006 bis 2011 ergab, dass 15% der 141 Mitglieder an anderer Stelle angaben, Mitglied eines Speakers' Bureau oder eines Advisory Boards zu sein.
Die Autoren ziehen das Fazit, dass die bislang getroffenen Regeln nicht dazu ausreichen, die neue Version des psychiatrischen Diagnosemanuals vor der Einflussnahme der Industrie zu schützen, so wie es die APA zumindest verbal anstrebt ("… transparent process of development for the DSM, and …an unbiased, evidence-based DSM, free
from any conflicts of interest'').
Die Autoren empfehlen:
• Alle Arbeitsgruppenmitglieder sollten frei sein von finanziellen Interessenkonflikten
• Personen, die an Speakers Bureaus teilgenommen haben, sollen nicht an Arbeitsgruppen teilnehmen.
• Für den Fall, dass nicht ausreichend Personen mit der erforderlichen Expertise zu finden sind, die keinen Interessenkonflikt haben, sollen Personen mit Beziehungen zur Industrie in die Beratungen einbezogen werden, ohne jedoch an den Entscheidungsprozessen teilzunehmen.
Cosgrove L, Krimsky S. A Comparison of DSM V and DSM 5 Panel Members' Financial Associations with Industry: A Pernicious Problem Persists. PLoS Med 2012;9:e1001190 Volltext
Cosgrove L, Krimsky S, Vijayaraghavan M, Schneider L. Financial Ties between DSM-IV Panel Members and the Pharmaceutical Industry. Psychotherapy and Psychosomatics 2006;75:154-60 Abstract
Pressemitteilung der APA 23.7.2007: APA Names DSM-V Task Force Members Download
David Klemperer, 20.5.12
Offenlegung von Interessenkonflikten - unerwünschte Wirkungen möglich
 Interessenkonflikte finanzieller und nicht-finanzieller Art sind in der Medizin weit verbreitet. Als problematisch gelten sie, weil die Wahrnehmung und Bewertung von Sachverhalten beeinflussen und verzerren können. Beispiele zeigen, dass Wissenschaftler je nach Vorhandensein von Interessenkonflikte identische Daten gegensätzlich beurteilen (wir berichteten über das Beispiel Avandia Link).
Interessenkonflikte finanzieller und nicht-finanzieller Art sind in der Medizin weit verbreitet. Als problematisch gelten sie, weil die Wahrnehmung und Bewertung von Sachverhalten beeinflussen und verzerren können. Beispiele zeigen, dass Wissenschaftler je nach Vorhandensein von Interessenkonflikte identische Daten gegensätzlich beurteilen (wir berichteten über das Beispiel Avandia Link).
Als probates Gegenmittel wird die Offenlegung von Interessenkonflikten angesehen. In den USA wird gerade an der Umsetzung von weitreichenden Meldepflichten gearbeitet (wir berichteten: "Es werde Licht - Transparenzregelungen in den USA werden konkretisiert" Link).
Die amerikanischen Sozialwissenschaftler Loewenstein, Sah und Cain haben eine Reihe von Experimenten durchgeführt, die gezeigt haben, dass die Offenlegung von Interessenkonflikten unbeabsichtigte und unerwünschte Folgen haben kann (Quellen 1-4). Eine Zusammenfassung erschien kürzlich im Journal of the American Medical Association.
Die Offenlegung kann Ärzte dazu veranlassen, Informationen stärker zu verzerren, als es ohne Offenlegung der Fall wäre.
Zwei Mechanismen sind dafür ursächlich:
• Die strategische Übertreibung (strategic exaggeration): der Arzt stellt Sachverhalte z.B. stärker positiv verzerrt da, um der Korrektur entgegenzuwirken, die der Rezipient aufgrund seines Wissens um den Interessenkonflikt des Arztes durchführt.
• Die moralische Genehmigung (moral licensing): der Arzt hat das Gefühl, verzerrte Informationen geben zu dürfen, weil der zu Beratende ja gewarnt war.
Diese Ergebnisse wurden in Versuchsanordnungen erzielt, in der die Arzt-Patient-Beziehung nachgeahmt wurde. In den Versuchen musste eine Person (estimator) Mengen schätzen (z.B. Münzen in einem Glas), allerdings auf Grundlage unvollständiger Informationen. Die andere Person (advisor) hatte die Aufgabe, dem Schätzenden als Experte ergänzende Informationen zu geben. Der Berater hatte stets einen Informationsvorteil, indem er z.B. das Glas mit Münzen länger und aus kürzerer Distanz anschauen durfte. Der Schätzende erhielt eine Bezahlung bei möglichst genauer Schätzung. Für den Berater wurden unterschiedliche Anreize gesetzt.
Geprüft wurde nun das Verhalten des Beraters in Abhängigkeit eines Interessenkonflikts sowie das Verhalten des Schätzenden in Abhängigkeit seines Wissens bzw. Nicht-Wissens um den Interessenkonflikt des Beraters.
Kein Interessenkonflikt lag vor, wenn die Bezahlung des Beraters sich nach der Genauigkeit der Schätzung richtete.
Ein Interessenkonflikt wurde dadurch gesetzt, dass der Berater eine höhere Bezahlung erhielt, wenn die Schätzung möglichst hoch lag.
Das wenig überraschende Ergebnis lautet, dass der Berater dem Schätzenden höhere Werte angab, wenn er durch Überschätzung mehr Geld verdiente.
Bei Offenlegung des Interessenkonflikts gaben die Berater noch höhere Werte an als bei Nicht-Offenlegung - im Sinne der strategischen Übertreibung und der moralischen Lizensierung.
Die Schätzer konnten jedoch die verstärkte Verzerrung bei Offenlegung des Interessenkonflikts nicht entsprechend verrechnen. Sie nahmen zwar stärkere Verzerrung an, unterschätzten diese jedoch.
In beiden Studien verdienten die Schätzer bei Offenlegung als bei Nicht-Offenlegung weniger - die Berater genau umgekehrt. Die Verzerrung wurde auf Seiten des Schätzers (Patient) erhöht. Mit der Offenlegung wurde also genau das Gegenteil von dem erreicht, was Offenlegung bewirken soll.
In der Medizin dürfte das Problem nach Einschätzung der Autoren noch größer sein als in den künstlichen Experimenten (stylized eperiments). Patienten gehen zwar davon aus, dass die Informationen von Ärzten durch Interessenkonflikte verzerrt werden, sie vertrauen aber zumeist ihrem Arzt und meinen, dass er davon ausgenommen ist. Dies kann mit der Fehlannahme zusammenhängen, dass Bias das Ergebnis einer einer absichtlichen Täuschung ist.
Ein weiteres unerwünschtes Ergebnis von Offenlegung kann sein, dass Patienten dem Arzt weniger vertrauen und trotzdem unter erhöhtem Druck stehen, das zu machen, was dieser empfiehlt - ein Phänomen, das die Autoren als "insinuation anxiety" bezeichnen: weiß der Patient, dass eine bestimmte Entscheidung dem Arzt einen finanziellen Vorteil bringt, könnte die Ablehnung durch den Patienten eine neue Dimension in die Beziehung bringen, sie könnte dem Arzt signalisieren, dass der Patient ihn für korrupt hält. In diesem Fall mindert die Offenlegung das Vertrauen des Patienten und erhöht den Druck, dem Ratschlag des Arztes zu folgen.
Angesichts der hier dargelegten Erkenntnisse betonen die Autoren, dass sie auf unerwünschte Folgen der Offenlegung von Interessenkonflikten hinweisen und nicht etwa die Offenlegung in Frage stellen wollen. Es gehe darum sicherzustellen, die erwünschten Effekte der Offenlegung zu erzielen. Auch dafür haben die Autoren Experimente durchgeführt (3).
Zielführend könne z.B. eine unverzerrte, also nicht durch Interessenkonflikt beeinflusste Zweitmeinung sein. Hilfreich sei es auch, wenn der Interessenkonflikt durch eine dritte Person offengelegt wird, der Patient genügend Zeit für eine Entscheidung erhält und die Entscheidung in Abwesenheit des Arztes erfolgt.
Die stärkste Wirkung erziele die Pflicht zur Offenlegung von Interessenkonflikten vermutlich auf die Ärzte selbst. Analoge Beispiele aus anderen Bereichen zeigen, dass Personen das Eingehen von Interessenkonflikten vermeiden, wenn diese schwer vor Anderen zu rechtfertigen sind. Dies dürfte für die Annahme von Geschenken und die Finanzierung von ärztlicher Fortbildung durch die pharmazeutische Industrie durchaus zutreffen.
Loewenstein G, Sah S, Cain DM. The Unintended Consequences of Conflict of Interest Disclosure. JAMA: The Journal of the American Medical Association 2012;307:669-70 Link (Volltext kostenpflichtig)
Weitere Studien der Arbeitsgruppe
(1) Loewenstein G, Sah S, Cain DM. The Burden of Disclosure: Increased Compliance with Distrusted Advice, 2012 Download Volltext (noch nicht in einer Fachzeitschrift mit peer review erschienen)
(2) Sah S, Loewenstein G, Cain DM. How Doctors' Disclosures Increase Patient Anxiety. Download Volltext (noch nicht in einer Fachzeitschrift mit peer review erschienen)
(3) Cain DM, Loewenstein G, Moore DA. The Dirt on Coming Clean: Perverse Effects of Disclosing Conflicts of Interest. J Legal Studies 2005;34:1-25. Download Volltext
(4) Cain DM, Loewenstein G, Don AM. When Sunlight Fails to Disinfect: Understanding the Perverse Effects of Disclosing Conflicts of Interest. Journal of Consumer Research 2011;37:836-57 Download Volltext
David Klemperer, 24.2.12
Es werde Licht - Transparenzregelungen in den USA werden konkretisiert
 Licht ins Dunkle der Beziehungen zwischen Ärzten und Industrie sollen Regelungen bringen, die als Teil der US-amerikanischen Gesundheitsreform im Jahr 2009 verabschiedet wurden.
Licht ins Dunkle der Beziehungen zwischen Ärzten und Industrie sollen Regelungen bringen, die als Teil der US-amerikanischen Gesundheitsreform im Jahr 2009 verabschiedet wurden.
Der Patient Protection and Affordable enthält einen Teil Physician Payment Sunshine Provision. Darin ist grundsätzlich festgelegt, dass Zuwendungen der pharmazeutischen Industrie und der Geräteindustrie an Ärzte zu melden und in einer Datenbank zu veröffentlichen sind. Am 19.12.2011 haben die Centers for Medicare & Medicaid Services als zuständige Stelle einen 32-seitigen Vorschlag für die konkrete Umsetzung veröffentlicht.
Transparenz-Berichte ("transparency reports") sollen ab September 2013 auf einer öffentlichen Website veröffentlicht werden. Betroffen auf Seite der Gebenden sind alle Firmen, die Medikamente oder Medizinprodukte herstellen, die von Medicare bzw. Medicaid / Children's Health Insurance Program finanziert werden. Die Firmen haben alle Zahlungen und Zuwendungen an Ärzte und an "teaching hospitals" zu melden, worunter solche Krankenhäuser zu verstehen sind, die Zahlungen von Medicaid für Fortbildungszwecke erhalten. Darüber hinaus müssen Firmen die Ärzte melden, die Besitzer Firmenanteilen besitzen oder in die Firma investiert haben.
Die Industrie muss alle Beträge ab 10 Dollar melden. Summieren sich Beträge von weniger als 10 Dollar von einer Firma an einen Arzt pro Jahr auf mehr als 100 Dollar, ist auch dies zu melden. Zu melden ist auch das Arzneimittel bzw. das Medizinprodukt, auf das sich die Zahlung bezieht.
Auch indirekte Zuwendungen sind zu melden, wenn sie letzten Endes Ärzten zugute kommen, so Zahlungen an medizinische Fachgesellschaften, Auftragsforschungsinstitute und Firmen, die ärztliche Fortbildung anbieten.
Um eine eindeutige Identifikation der Ärzte zu gewährleisten, werden sie nach ihrer Nationalen Arztnummer (National Provider Identifier) gelistet.
Als Anforderungen an die Datenbank gilt, dass sie durchsuchbar sowie klar und verständlich sein muss. Die Daten müssen ohne Mühe aggregierbar und herunterzuladen sein.
Die Veröffentlichung von Zahlungen darf bis zur Zulassung des betroffenen Produktes oder maximal 4 Jahre hinausgeschoben werden, wenn es die Geschäftsinteressen der Firma schädigen würde. Dessen unbenommen, müssen die Zahlungen aber gemeldet werden.
Bevor die gemeldeten Daten veröffentlicht werden, stehen sie den Firmen und Ärzten 45 Tage zur Stellungnahme und Korrektur zur Verfügung.
Die zu meldenden Daten sollten ursprünglich ab 1.1.2012 gesammelt, am 31.3.2013 erstmals übermittelt und am 1.9.2013 erstmals veröffentlicht werden. Daten, die vor erscheinen der Endversion der Regelungen anfallen, werden die Firmen jedoch nicht übermitteln müssen..
Stellungnahmen zu diesem Vorschlag der Centers for Medicare & Medicaid Services sind bis zum 17.2.2012 möglich. Die Endversion wird Mitte 2012 erwartet.
Centers for Medicare & Medicaid Services. Transparency Reports and Reporting of Physician Ownership or Investment Interests Download
Physician Payment Sunshine Provision Download Gesetzestext
"Transparency Reports" on Industry Payments to Physicians and Teaching Hospitals. Journal of the American Medical Association. Online first 14.2.2012 Volltext
Patient Protection and Affordable Care Act Download Volltext
Forum-Beitrag zum Gesamtpaket der amerikanischen Gesundheitsreform Link
David Klemperer, 16.2.12
"Tamiflu III": Warum ein Review auf Daten von 68% der durchgeführten Studien zum Grippe-Blockbuster verzichten muss?
 Wäre das Ganze ein Hollywoodfilm, finge spätestens jetzt die Kritik an von einem überzogenen, tendenziösen oder ideologischen Plot von notorischen Pharmagegnern und Halbwissenschaftlern zu reden. Das sprachlich etwas sperrige "Drehbuch" zur jüngsten Inszenierung des Themas "Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children" stammt aber weder aus Hollywood noch von dortigen Drehbuchschreibern, sondern von Mitgliedern der "Cochrane Acute Respiratory Infections Group" u.a. aus Rom (dort arbeitet der Leiter der Gruppe, Tom Jefferson). Auch wenn manche Aspekte filmreif sind, gibt es keine Bilder, sondern 217 ausnahmsweise frei zugängliche Seiten des neuesten, am 18. Januar 2012 veröffentlichten Band der "Cochrane Library". Wer mehr und fundiertere Informationen zum Thema vorsätzlicher Blockaden von Erkenntnissen über den Nutzen und die Wirksamkeit von Medikamenten durch Pharmakonzerne sucht, wird hier umfassend fündig.
Wäre das Ganze ein Hollywoodfilm, finge spätestens jetzt die Kritik an von einem überzogenen, tendenziösen oder ideologischen Plot von notorischen Pharmagegnern und Halbwissenschaftlern zu reden. Das sprachlich etwas sperrige "Drehbuch" zur jüngsten Inszenierung des Themas "Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children" stammt aber weder aus Hollywood noch von dortigen Drehbuchschreibern, sondern von Mitgliedern der "Cochrane Acute Respiratory Infections Group" u.a. aus Rom (dort arbeitet der Leiter der Gruppe, Tom Jefferson). Auch wenn manche Aspekte filmreif sind, gibt es keine Bilder, sondern 217 ausnahmsweise frei zugängliche Seiten des neuesten, am 18. Januar 2012 veröffentlichten Band der "Cochrane Library". Wer mehr und fundiertere Informationen zum Thema vorsätzlicher Blockaden von Erkenntnissen über den Nutzen und die Wirksamkeit von Medikamenten durch Pharmakonzerne sucht, wird hier umfassend fündig.
Sachlich geht es um die Enzymfamilie der Neuraminidase, die Wirkstoffe Oseltamivir (Roche) und Zanamivir (GlaxoSmithKline) sowie das von der Firma Roche produzierte Medikament Tamiflu. Spätestens seit der vermeintlich Millionen von Menschen tödlich bedrohenden Schweinegrippe-Pandemie wurde vor allem Tamiflu als "das" Wundermittel zur Prävention und Kuration dieser und anderer Grippeerkrankungen propagiert, was die öffentlichen Arzneimittel-Vorratslager für den Ernstfall füllte und der Firma einen kräftigen Gewinn bescherte.
Bereits früh meldeten Virologen wie T. Jefferson und Gesundheitswissenschaftler Zweifel an der Wirksamkeit und der Seriosität bzw. Korruptionsfreiheit der unverhohlenen Empfehlungen des Präparats durch die Weltgesundheitsorganisation (WHO) und nationale Public Health-Institutionen sowie Gesundheitsministerien an.
Zu den Highlights dieser Phase ("Tamiflu I und II") gehörte
• das hartnäckige Ignorieren der Bitten von Cochrane-Reviewern nach mehr Informationen über einige der schon damals bekannten unveröffentlichten Studien und Primärdaten. Die methodisch versierten Anfrager wurden mit Tabellen vertröstet und durch Ankündigungen von mehr Transparenz ruhig zu stellen versucht, die nach dem bekannten Veröffentlichungstermin im seriösen "British Medical Journal (BMJ)" lagen. Von den versprochenen, frei zugänglichen Daten war und ist "natürlich" nichts zu sehen.
• die Tatsache, dass einige Experten, die an den offiziellen Empfehlungen der WHO zugunsten des Wirkstoffs und von Tamiflu mitwirkten, mehr oder weniger üppig bezahlt mit der Firma Roche zusammengearbeitet hatte oder sonstige finanzielle Vorteile genossen hatte. Der Skandal im Skandal: Die betreffenden Wissenschaftler hatten diese Interessenkonflikte offen der WHO gemeldet, was diese aber nicht davon abhielt, sie genau zum Einsatz von Tamiflu weiter als Berater und Empfehlungsgeber agieren zu lassen. Wer mehr über diese vergangenen Höhepunkte erinnern oder erfahren will, kann dies mit einem umfangreichen Beitrag im Forum-Gesundheitspolitik beginnen.
Der aktuelle Höhepunkt ist durch eine mindestens bis zum April 2011 (dem Redaktionsschluss für den jetzt veröffentlichten Cochrane Review) anhaltende Informationsvernebelung und -blockade vor allem des Tamifluherstellers Roche geprägt. Dass aber die Studientransparenz auch nach dem April 2011 nicht besser wurde, sei der Vollständigkeit halber festgehalten. Schon früh hatten die Reviewer den Eindruck, dass es einen enormen so genannten "publication bias" und in der Folge einen "reporting bias" vor allem durch nicht veröffentlichte Studien gab. So waren und sind 60% aller Patientendaten aus Phase III-Studien zur Wirksamkeit der Behandlung mit Oseltamivir nicht veröffentlicht. Dies und weitere Funde veranlassten die Reviewer zum Background der aktuellen Version ihres Reviews zu folgender deprimierenden Äußerung: "Our confidence in the conclusions of previous versions of this review has been subsequently undermined."
Trotz zahlreicher Versuche (darunter zwischen Juni 2010 und Februar 2011 fünf offizielle Bitten an die Firma Roche), möglichst viele Studienergebnisse berücksichtigen und bewerten zu können und dann evtl. eine Metaanalyse durchführen zu können und trotz der Veröffentlichung einer ersten, weitgehend resonanzfreien kritischen Bewertung im Dezember 2010, konnten die WissenschaftlerInnen 42 ihnen bekannte Studien nicht berücksichtigen und mussten sich auf "nur" 25, sämtlich von den Herstellern finanzierte Studien (darunter 15 Oseltamivir-Studien) stützen.
Trotz der relativen kleinen und methodisch dazu noch oft eingeschränkten Basis von 38% der bekannten Studien, kommt der Review zu mehreren wichtigen Ergebnissen:
• Die Wirkstoffe verkürzen gegenüber Placebos statistisch signifikant die symptomreiche Leidenszeit nach dem Eintritt der Erkrankung um 21 Stunden.
• Für positive Effekte auf die Häufigkeit einer Krankenhauseinweisung und -"behandlung liefern die Studien keinerlei signifikanten Beleg.
• Ob Oseltamivir in der Lage ist, Komplikationen einer Grippeerkrankung zu verhindern, konnte angesichts der Materiallage nicht bewertet werden
• In einer nachträglichen Zusatzanalyse zeigte sich bei Angehörigen der Interventionsgruppe eine signifikant geringere Wahrscheinlichkeit, als grippekrank diagnostiziert zu werden. Hier wie an anderen inhaltlich unklaren Punkten sind auch die durchweg sachkundigen Reviewer unsicher oder zur Spekulation gezwungen. Wer oder was hier helfen könnte, sagen sie dann aber auch: "We expect full clinical study reports containing study protocol, reporting analysis plan, statistical analysis plan and individual patient data to clarify outstanding issues. These full clinical study reports are at present unavailable to us."
• Auf die längst überfällige und auch für die öffentliche Gesundheit und die Finanzen der Krankenversicherungen und Staaten notwendige Metaanalyse verzichten die Reviewer angesichts der systematischen Entöffentlichung von 62% der durchgeführten Untersuchungen.
• Um die offensichtlich permanente Informationsblockade von Roche und möglichen Nachahmern umgehen zu können, überlegen Jefferson et al. sich künftig stärker auf Materialien zu stützen, die den staatlichen Zulassungsbehörden (in den USA die "US Food and Drug Administration (FDA)") von den Herstellern zur Verfügung gestellt und von ihnen auch häufig umfangreich kommentiert werden. Ob diese zum Teil sehr umfangreichen "clinical study reports" und "regulatory informations" aber wirklich für Metaanalysen genutzt werden können und möglicherweise deren Ergebnisse unkontrollierbar verändern, wird in den Reihen der Cochrane Collaboration intensiver als in der Vergangenheit diskutiert werden.
Der komplett 217 Seiten umfassende Cochrane-Intervention Review "Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children" von Jefferson T, Jones MA, Doshi P, Del Mar CB, Heneghan CJ, Hama R und Thompson MJ. (Cochrane Database of Systematic Reviews 2012, Issue 1) ist kostenlos erhältlich.
Das Editorial Neuraminidase inhibitors for influenza: methods change, principles don't von Lasserson T, Tovey D. ist ebefalls kostenlos erhältlich. Es beschäftigt sich vor allem mit der Frage der von Roche und möglichen Nachahmern betriebenen Informationsblockade, der Gefahr von Publikations-Verzerrungen und der Vor- und Nachteile des Ausweichens auf Materialien der Zulassungsbehörden. Zu den Schlüsselprinzipien der Cochrane Collaboration, die sich nicht ändern sollen,zählt "to identify and minimise bias".
Erste Reaktionen der Firma Roche (Tenor: Das stimmt alles nicht) können Serienfreunde freudig stimmen: "Tamiflu IV" wird kommen!!
Bernard Braun, 20.1.12
Avastin: Zulassungsverlust in den USA wegen Unwirksamkeit und Nebenwirkungen?! "Geld-zurück"-Vermarktungsstrategie in Deutschland!
 Die Verordnung des unter dem Markennamen Avastin seit einigen Jahren u.a. zur Behandlung eines bestimmten Brustkrebstyps (Her2-negativ-Typ mit Metastasen) eingesetzten Antikörpers Bevacizumab ist wegen empirisch bestätigtet erheblicher Zweifel an seiner Wirksamkeit und seinen zahlreichen schweren Nebenwirkungen in den USA spätestens seit Sommer 2010 massiv in die fachwissenschaftliche Kritik geraten. Die Kritik reicht so weit, dass seit Ende 2010 eine Expertengruppe der für die Zulassung von Arzneimittel in den USA zuständigen "Food and Drug Administration (FDA)" beraten hat, ob diese Zulassung nicht zurück genommen werden sollte. Im Juni 2011 haben die Experten der FDA in einer offenen Abstimmung einstimmig (6:0) empfohlen, diesen Schritt zu tun. Die Zulassung zur Behandlung anderer schwerer Krebserkrankungen wie Lungen-, Nieren- und Hirntumoren war davon nicht betroffen. Trotz dieses eindeutigen Votums und der ihm zugrunde liegenden Fakten, hat sich die FDA bisher (Ende Oktober 2011) nicht zu diesem Schritt entschieden.
Die Verordnung des unter dem Markennamen Avastin seit einigen Jahren u.a. zur Behandlung eines bestimmten Brustkrebstyps (Her2-negativ-Typ mit Metastasen) eingesetzten Antikörpers Bevacizumab ist wegen empirisch bestätigtet erheblicher Zweifel an seiner Wirksamkeit und seinen zahlreichen schweren Nebenwirkungen in den USA spätestens seit Sommer 2010 massiv in die fachwissenschaftliche Kritik geraten. Die Kritik reicht so weit, dass seit Ende 2010 eine Expertengruppe der für die Zulassung von Arzneimittel in den USA zuständigen "Food and Drug Administration (FDA)" beraten hat, ob diese Zulassung nicht zurück genommen werden sollte. Im Juni 2011 haben die Experten der FDA in einer offenen Abstimmung einstimmig (6:0) empfohlen, diesen Schritt zu tun. Die Zulassung zur Behandlung anderer schwerer Krebserkrankungen wie Lungen-, Nieren- und Hirntumoren war davon nicht betroffen. Trotz dieses eindeutigen Votums und der ihm zugrunde liegenden Fakten, hat sich die FDA bisher (Ende Oktober 2011) nicht zu diesem Schritt entschieden.
Die Umstände vor und nach der Entscheidung sind ein Lehrstück über die Schwierigkeiten, rationale und patientenorientierte Erkenntnisse gegen die mit der Behandlung einer der häufigsten Krebserkrankungen von Frauen verbundenen wirtschaftlichen Interessen durchzusetzen. Deutlich wird dabei auch, dass Herstellerfirmen, wirtschaftlich abhängige Wissenschaftler, einige Patienten, die sich erfolgreich behandelt fühlten (so genannte "super-responders") und möglicherweise auch wirtschaftlich interessierte Leistungserbringer eigentlich vor nichts zurück schrecken, um am Markt zu bleiben und dabei grundsätzlich "die Patienten" aus dem Sinn verlieren.
Dies zeigt u.E. die folgende unvollständige Übersicht wichtiger Etappen der Ver- und Entmarktung von Avastin und des Einfallsreichtums der Herstellerfirma Roche:
• Avastin wurde in den USA 2008 zur Behandlung des o.g. Brustkrebstyps aufgrund des Ergebnisses einer einzi-gen Studie der Herstellerfirma Genentech im Schnellverfahren zugelassen. In dieser Studie versprach das allein eingesetzte Mittel gegenüber dem alleinigen Einsatz eines anderen Mittels (Paclitaxel/Taxol) eine um 5,5 Monate längere progressions-freie Überlebenszeit als (11,3 Monate versus 5,8 Monate). Die beiden Mittel wurden auch gemeinsam verordnet und hatten Wirkungen auf beim Brustkrebs gezeigt. Die FDA verband diese Zulassung mit der Hersteller-Auflage, die Wirksamkeit und die Sicherheit/Nebenwirkungsfreiheit von Avastin durch weitere Studien zu untermauern. Dem folgte Genentech weitgehend nicht, und auch die Herstellerstudien AVADO und RIBBON-1 versagten aus Sicht aller FDA-Gutachter beim Versuch doch noch einen Nutzen für Avastin zu belegen. Andere Studien zeigten allerdings auch, dass der Nutzen höchstens durchschnittlich 0,8 Monate betrug und diese gewonnene progressionsfreie Überlebenszeit noch durch schwere, behandlungsbedürftige Nebenwirkungen, wie beispielsweise innere Blutungen und Magengeschwüre belastet wurde. Ob sich diese Art der Überlebenszeit aber auch auf die gesamte Überlebenschance der Erkrankten auswirkt war und ist ungeklärt. Der am 4. Oktober 2011 in den "Annals of Oncology 2011" veröffentlichte systematische Review samt Meta-Analyse der Ergebnisse von 5 RCTs "Adverse events risk associated with bevacizumab addition to breast cancer chemotherapy: a meta-analysis" von Cortes et al. belegt für vier unerwünschte Wirkungen ein vielfach erhöhtes Risiko (odds ratio): Das Risiko einer Proteinurie, d.h. einer übermäßigen Konzentration von Eiweiß im Urin, war unter einer Avastinbehandlung um das 27-Fache erhöht, das eines zu hohen Blutdrucks um das 3-Fache, das einer Fehlfunktion der linken Herzkammer um mehr als das Doppelte und das von diversen Blutungen um das 4-Fache. Dem während des FDA-Entscheidungsprozesses von behandelnden Onkologen bemühten Argument, die Nebenwirkungen seien deshalb hinzunehmen, weil die "disease is so terrible" konnten die Gutachter nichts abgewinnen, weil dies nur erwägenswert wäre, wenn das Medikament überhaupt etwas Positives schaffe. Die meisten hier geschilderten Ereignisse und noch ein paar mehr Hintergründe können in dem längeren Beitrag von Emily Walker "FDA Panel votes to yank Avastin's breast cancer indication" auf der Website "Medpage today" vom 29. Juni 2011 nachgelesen werden. Hier könnte u.U. eine kurze Anmeldung als LeserIn notwendig sein, die aber nach den Erfahrungen des Autors nicht zu Spam- oder Werbefluten führt.
• Der Empfehlung der Gutachter folgt eine Flut von Reaktionen und Ereignissen, deren Hintergründe sicherlich noch Gegenstand weiterer kritischer Nachforschungen sein werden. Einige, insbesondere private Krankenversicherunternehmen bezahlten selbst ohne eine endgültige Entscheidung der FDA ihren Versicherten die monatlich 8.000 US-Dollar kostende Behandlung nicht mehr. Die staatlichen Versicherungen Medicare und Medicaid bezahlen die Leistung weiter und kündigen auch an sie trotz einer möglichen Entscheidung der FDA gegen Avastin weiter zu bezahlen. Zahlreiche Onkologen und ihre Fachverbände erklärten außerdem, sie würden Avastin, wenn es weiter für die Behandlung der anderen Krebserkrankungen zugelassen bliebe, weiter und dann eben "off-label" zur Behandlung von Brustkrebspatienten verschreiben.
Dass dies keine spontanen Einzelmeinungen waren, zeigt eine von September bis November 2010 durchgeführte Mailbefragung von 3.000 Ex-TeilnehmerInnen eines Krebskongresses in Dubai. Von den 564 Antwortenden, also einer wahrscheinlich nicht repräsentativen Gruppe von praktizierenden Onkologen, vertrat die Mehreheit die Meinung, bei den FDA-Überlegungen ginge es vor allem um Kostenersparnis und außerdem würde damit die Entwicklung künftiger Medikamente gegen Brustkrebs be- oder verhindert. 46,5% der Befragten betrachteten die Verordnung von Avastin bei Personen, die an einem Her2-3x-negativen Brustkrebs erkrankt sind, als nützlich. 44,7% sagten, sie würden das Antikörperpräparat bei diesem Brustkrebstyp trotz aller FDA-Argumente mit Vorrang ("first line") weiter verordnen. 52% sagten schließlich, sie würden Avastin in der Regel zusammen mit Taxol als Therapeutikum einsetzen. Zu erwarten ist also, dass sehr viele Ärzte bei einer Streichung des Anwendungsgebiets Brustkrebs weiterhin "off-label" (Verordnung eines nicht zur Behandlung einer bestimmten Krankheit zugelassenen Medikaments) Avastin verordnen. Der Aufsatz "The use of bevacizumab among women with metastatic breast cancer: A survey on clinical practice and the ongoing controversy" von Dawood u.a. ist gerade online in der Fachzeitschrift "Cancer" erschienen und enthält neben weiteren Einzelheiten zur Entwicklungs- und Zulassungsgeschichte des Antikörpers differenziertere Ergebnisse der Befragung. Kostenlos ist nur das Abstract erhältlich.
• Auf dem 2011-"European Multidisciplinary Cancer Congress" in Stockholm hob eine deutsche Forschergruppe hervor, dass eine Subgruppenanalyse von Daten einer an Brustkrebs erkrankten Personengruppe aus onkologischen Praxen in Deutschland sowohl bei der Gesamtsterblichkeit als auch der progressionsfreien Überlebenszeit einen Nutzen der kombinierten Behandlung mit Avastin und Taxol zeige. Bevacizumab gälte daher in DEutschland zu Recht als "first line"-Präparat zur Behandlung des bereits mehrfach charakterisierten Brustkrebstyps. Anders als die der FDA-Experten-Empfehlung zugrunde liegenden Studien verglichen die deutschen Forscher aber nicht die Avastin/Taxol-Intervention mit einer anderen Interventionsform, sondern verglichen das Überleben einer dreifach-negativen Krankengruppe mit einer, die nicht an dieser Variante von Brustkrebs litten. Neben den um mehrere Monate längeren Überlebenszeiten in der Avastin/Taxol-Gruppe, konnten die ForscherInnen auch nur wenige der schweren unerwünschten Wirkungen beobachten. Ein Bericht über ihre Präsentation schloß daher auch mit den Worten "that the regimen is active in patients with triple-negative disease and is well-tolerated in routine practice."
Was an Wichtigem zu berichten übrigbleibt ist Folgendes: Die Studie wurde von der Firma Roche, also dem Hersteller von Avastin, gesponsert, was aber die AutorInnen nicht daran hinderte anzugeben, sie hätten "no conflicts of interest" gehabt. Einzelheiten zu den Ergebnissen der Präsentation "Bevacizumab combined with paclitaxel as first-line therapy for metastatic triple-negative breast cancer" von Schneeweiss et al auf dem ECCO-ESMO-Kongress 2011 (Abstract 5073) finden sich in einer kostenlosen Zusammenfassung auf einer der vielen Brustkrebs-Spezial-Websites. Ob die mündliche Präsentation jemals in einer Fachzeitschrift mit einem "peer review"-Verfahren erscheinen wird, verdient angesichts ihrer in diesem Zusammenhang eigentümlichen Methodik und ihren speziellen Ergebnissen besondere Aufmerksamkeit
• Dass die Firma Roche nicht nur offen Kongressbeiträge unterstützt, sondern auch noch andere Strategien verfolgt, zeigt sich an einer seit wenigen Tagen bekannten Vertragsstrategie des Konzerns gegenüber Krankenhäusern in Deutschland. Wie die "Süddeutsche Zeitung (SZ)" am 24.10.2011 in dem komplett kostenlos erhältlichen Beitrag "Rabatt bei Misserfolg" von Christina Berndt berichtet, bietet Roche Krankenhäusern einen so genannten "pay for performance"-Vertrag an, der folgendes Angebot enthält: Wenn in einem Krankenhaus Avastin zur Erstbehandlung fortgeschrittener Tumore des Darms, der Lunge, der Nieren und der Brust eingesetzt wird, was in Deutschland etwa 3.300 Euro pro Monat kostet, und der Krebs nicht zu wachsen aufhört, erhalten die Krankenhäuser das aufgewandte Geld zurück. Diese wohl einmalige "Geld-zurück"-Garantie kommentiert das pharmakritische "Arznei-Telegramm" in einem demselben Thema gewidmeten Beitrag in der leider nicht frei bzw. kostenlos zugänglichen neuesten Ausgabe (a-t 2011; 42: 83-4) so: "Die Regelung lädt geradezu ein, auch Patienten mit Bevacizumab zu behandeln, bei denen die Wahrscheinlichkeit gering ist, dass es ihnen nützt." Noch folgenreicher für Patienten ist, dass den Avastin-Patientinnen möglicherweise eine wirksamere Therapien mit weniger attraktiven finanziellen Anreizen vorenthalten wird. Der Clou der "P4P"-Verträge ist nämlich, dass die Krankenhäuser Kostenerstattungen angeboten werden, hinter denen gar keine Ausgaben stehen. Die Behandlung mit Avastin bezahlen nämlich die Krankenkassen. In dem SZ-Artikel wird dann auch ein AOK-Vertreter zitiert, der meint, solche Preisvorteile müssten an die Kassen weitergegeben werden. Ein Überblick über die 12 in den letzten Jahren u.a. zu Avastin im "Arznei-Tegramm" erschienenen ebenfalls mehrheitlich nicht kostenlos zugänglichen Beiträge zeigt, dass der Nutzen des Medikaments schon seit längerem auch in Deutschland bezweifelt wird.
Unabhängig von legitimen und legalen Finanzierungsdetails bleibt die Frage, warum nach Bekanntwerden des Angebots Krankenkassen und Krankenhäuser nicht auf der Basis der bisherigen Erkenntnisse über Avastin gemeinsam ein solches Angebot grundsätzlich als inhuman, patientengefährdend und unethisch ablehnten.
Nachtrag vom 20. November 2011: In einer FDA-Presseerklärung vom 18. November 2011 kündigte die FDA-Leiterin Margret A. Hamburg an, die Zulassung des Medikaments Avastin bzw. seines Wirkstoffs zur Behandlung von Brustkrebspatientinnen werde in den USA zurückgezogen.
Die der Entscheidung zugrundeliegende Abwägung von Vor- und Nachteilen lautet: "This was a difficult decision. FDA recognizes how hard it is for patients and their families to cope with metastatic breast cancer and how great a need there is for more effective treatments. But patients must have confidence that the drugs they take are both safe and effective for their intended use." Und: "After reviewing the available studies it is clear that women who take Avastin for metastatic breast cancer risk potentially life-threatening side effects without proof that the use of Avastin will provide a benefit, in terms of delay in tumor growth, that would justify those risks. Nor is there evidence that use of Avastin will either help them live longer or improve their quality of life."
Ob und wie sich die europäischen und deutschen Zulassungsinstitutionen dieser Entscheidung anschließen, kann man hoffentlich nicht allzu lange beobachten.
Bernard Braun, 30.10.11
Was müde Maultiere mit Strafzahlungen der pharmazeutischen Industrie in Milliardenhöhe zu tun haben
 Lahme Gäule, müde Maultiere, defekte Gewehre, verdorbene Lebensmittel - skrupellose Händler betrogen die Nordstaatenarmee im Sezessionskrieg (1861-1865) auf jede nur erdenkliche Weise. Der "False Claim Act" (FCA) von 1863 sollte den Betrügern Einhalt gebieten. Durch dieses Bundesgesetz haften seitdem Personen und Firmen, welche den Staat durch falsche Behauptungen oder falsche Angaben finanziell schädigen. Ein bis heute wichtiger Aspekt ist das Recht von Privatpersonen, ihnen bekannte Fälle von Betrug zur Anklage zu bringen und dafür einen Teil der Schadenssumme als Belohnung zu erhalten ("whistleblower").
Lahme Gäule, müde Maultiere, defekte Gewehre, verdorbene Lebensmittel - skrupellose Händler betrogen die Nordstaatenarmee im Sezessionskrieg (1861-1865) auf jede nur erdenkliche Weise. Der "False Claim Act" (FCA) von 1863 sollte den Betrügern Einhalt gebieten. Durch dieses Bundesgesetz haften seitdem Personen und Firmen, welche den Staat durch falsche Behauptungen oder falsche Angaben finanziell schädigen. Ein bis heute wichtiger Aspekt ist das Recht von Privatpersonen, ihnen bekannte Fälle von Betrug zur Anklage zu bringen und dafür einen Teil der Schadenssumme als Belohnung zu erhalten ("whistleblower").
Wie in einer Studie in den Archives of Internal Medicine berichtet, mussten pharmazeutische Firmen im Zeitraum von 1996 bis 2010 in 31 Strafverfahren im Rahmen des FCA insgesamt 12 Mrd. Dollar als Strafe und zum Vergleich an die Bundesregierung und die Bundesstaaten zahlen.
Zumeist handelte es sich um Vergehen gegen die Marketing-Regeln, wie Off-Label-Marketing, betrügerisches Marketing, falsche Bezeichnungen von Chargen und betrügerische Preisauszeichnungen.
Den höchsten Betrag - 2,3 Mrd. Dollar - musste die Firma Pfizer 2009 im Zusammenhang mit der Vermarktung des inzwischen vom Markt genommenen Rheumamittels Bextra (Substanz Valdecoxib) zahlen wegen falscher Bezeichnung (misbranding), illegalem Marketing und der Zahlung von Bestechungsgeldern (kickbacks) an Ärzte. Wirklich weh getan hat Pfizer diese Summe bei einem weltweiten Jahresumsatz von 55,6 Mrd. Dollar im Jahr 2010 (IMS Health, Top 20 Global Corporations 2010) wohl eher nicht.
Den zweithöchsten Betrag - 1,4 Mrd. Dollar - zahlte Eli Lilly 2009 wegen der Off-Label-Vermarktung des Antipsychotikums Zyprexa (Substanz: Olanzapin). Zyprexa ist für die Behandlung der Bipolaren Störung und der Schizophrenie zugelassen. Eli Lilly bekannte sich des Versuchs schuldig, Ärzten gegenüber Werbung betrieben zu haben für den off-label-Einsatz bei Kindern und auch bei alten Menschen - bei Letzteren z.B. für die Behandlung von Demenz, Depression, Angst, Schlafproblemen und Verhaltensproblemen, insbesondere bei Bewohnern von Pflegeheimen. Die Strafzahlung von 515 Mio. Dollar war die höchste bis dahin jemals verhängte Zahlung (Department of Justice 2009).
Unter den wegen Betrugs verurteilten pharmazeutischen Firmen sind alle großen Namen vertreten einige sogar mehrfach.
Die vollständige Liste findet sich in der Studie, deren Volltext leider nicht frei zugänglich ist.
Qureshi ZP, Sartor O, Xirasagar S, Liu Y, Bennett CL. Pharmaceutical Fraud and Abuse in the United States, 1996-2010. Arch Intern Med 2011;171(16):1503-06
Link zu den ersten 150 Wörtern der Studie
Larry D. Lahman. Bad Mules. A Primer on the Federal False Claims Act. Link
Department of Justice. Presseerklärung 15.1.2009: Eli Lilly and Company Agrees to Pay $1.415 Billion to Resolve Allegations of Off-label Promotion of Zyprexa Link
New York Times 2.9.2009. Pfizer Pays $2.3 Billion to Settle Marketing Case Link
David Klemperer, 28.10.11
52% der Verfasser von Cholesterin- und Diabetes-Leitlinien in Nordamerika haben offen und verdeckt finanzielle Interessenkonflikte
 Klinische Leitlinien für das Screening, die Behandlung oder beide Aktivitäten spielen eine zunehmende Rolle in der medizinischen Versorgungspraxis. Umso wichtiger ist, dass sie sich ausschließlich am wissenschaftlich gesicherten Stand des Wissens über den patientenbezogenen Nutzen und die Schädigungsfreiheit der diagnostischen und therapeutischen Verfahren und Interventionen orientieren und nicht an den Interessen der Hersteller oder der behandelnden Ärzte und Nicht-Ärzte.
Klinische Leitlinien für das Screening, die Behandlung oder beide Aktivitäten spielen eine zunehmende Rolle in der medizinischen Versorgungspraxis. Umso wichtiger ist, dass sie sich ausschließlich am wissenschaftlich gesicherten Stand des Wissens über den patientenbezogenen Nutzen und die Schädigungsfreiheit der diagnostischen und therapeutischen Verfahren und Interventionen orientieren und nicht an den Interessen der Hersteller oder der behandelnden Ärzte und Nicht-Ärzte.
Wie verschiedene Studien aber seit Jahren zeigen, versuchen immer mehr Gesundheitsprodukteanbieter über finanzielle und organisatorische Angebote bis hin zu Beteiligungen an den Unternehmen offen oder verborgen Einflussnahme auf einzelne Studienergebnisse und am besten auch auf Behandlungsleitlinien zu nehmen.
Wie groß bereits der Umfang der offenen Einflussnahmen ist lässt sich u.a. an den zunehmend geforderten öffentlichen Erklärungen von finanziellen und anderen Interessenkonflikten der Forscher oder Mitglieder der Expertenteams für spezifische Leitlinien ablesen.
Wie viele der Verfasser von 14 zwischen 2000 und 2010 in den USA und Kanada von nationalen Fachgesellschaften publizierten relevanten Leitlinien für die Behandlung eines hohen Cholesterinspiegels und von Diabetes, also häufigen Erkrankungen bzw. Risikofaktoren, selber finanzielle Interessenkonflikte angaben und wohl auch hatten, analysierte jetzt eine Gruppe von us-amerikanischen Wissenschaftlern.
Die wesentlichen Ergebnisse sehen so aus:
- An der Entwicklung dieser Leitlinien waren insgesamt 288 Experten beteiligt. Bei 5 der Leitlinien waren Erklärungen über Interessenkonflikten überhaupt nicht vorgesehen.
• Von den Mitgliedern der Expertenteams gaben 138 oder 48% an, zum Zeitpunkt der Leitlinienbearbeitung Interessenkonflikte gehabt zu haben. Die restlichen 52% der Leitlinienverfasser erklärten, entweder keine Konflikte gehabt zu haben oder sie nicht erklären konnten.
• Unter den 73 Experten, die formal erklärten, keine Konflikte gehabt zu haben, zeigte sich bei genauerer Recherche, dass 8 bzw. 11% mindestens einen, wenn nicht sogar mehrere Konflikte gehabt hatten.
• Insgesamt hatte also mehr als die Hälfte der Panelmitglieder, nämlich 52% oder 150 Personen einen Interessenkonflikt - 138 erklärter Maßen und 12 unerklärt.
• Angehörige von regierungsgetragenen Expertenteams hatten wesentlich weniger seltener Interessenkonflikte als ihre KollegInnen, deren Arbeit aus Nicht-Regierungstöpfen finanziert und organisiert worden waren. Der Anteil von Mitgliedern mit Interessenkonflikten betrug in den regierungsgetragenen Teams 16% und in den von der Pharma- oder Medizintechnikindustrie gesponsorten Teams 69%.
Der 8 Seiten umfassende Aufsatz "Prevalence of financial conflicts of interest among panel members producing clinical practice guidelines in Canada and United States: cross sectional study" von Jennifer Neuman, Deborah Korenstein, Joseph Ross und Salomeh Keyhani ist am 11. Oktober 2011 in der renommierten Fachzeitschrift "British Medical Journal" erschienen (BMJ 2011; 343: d5621) und ist kostenlos erhältlich.
Bernard Braun, 13.10.11
Gegen ghost writing. Die Herkunft von Studien offen legen - schwierig aber notwendig
 Die pharmazeutische Industrie initiiert die überwiegende Mehrzahl der Arzneimittelstudien (wir berichteten mehrfach, z.B. Link). Dabei verfolgen sie sowohl wissenschaftliche als auch kommerzielle Ziele. Die kommerziellen Ziele wirken sich häufig verzerrend und verfälschend auf die Studienergebnisse aus (wir berichteten mehrfach, z.B. Link).
Die pharmazeutische Industrie initiiert die überwiegende Mehrzahl der Arzneimittelstudien (wir berichteten mehrfach, z.B. Link). Dabei verfolgen sie sowohl wissenschaftliche als auch kommerzielle Ziele. Die kommerziellen Ziele wirken sich häufig verzerrend und verfälschend auf die Studienergebnisse aus (wir berichteten mehrfach, z.B. Link).
Daher ist es wenig verwunderlich - wenn auch nicht akzeptabel - dass die Industrie die kommerziellen Aspekte ihrer Studien verbirgt oder herunterspielt. Eine Methode dafür ist die ghost authorship - ein professioneller Schreiber verfasst den Artikel ("ghost author") ohne als Autor genannt zu werden und ein neutral erscheinender Wissenschaftlers erscheint als Autor ("guest author"), obwohl Mitarbeiter bzw. Beauftrage des Unternehmens die entscheidenden Arbeiten in der Konzipierung der Studie, dem Studiendesign, der Datenanalyse, der Interpretation und dem Schreiben geleistet haben (wir berichteten mehrfach, z.B. Link).
Diese Art der Verschleierung des Ursprungs einer Studie gilt mittlerweile als Verstoß gegen akademische Standards. In einem Beitrag in PLoS Medicine legt Alastair Matheson dar, wie Firmen in perfekter Einhaltung der Leitlinien des International Committee of Medical Journal Editors (ICMJE) weiterhin ihren Einfluss auf eine Studie verbergen können.
Um als Autor einer Arbeit zu gelten, sind den ICMJE-Leitlinien zufolge drei Kriterien zu erfüllen:
1) Substantieller Beitrag zu Konzeption und Design oder der Erfassung der Daten oder Analyse und Interpretation der Daten
2) Entwurf oder inhaltliche Überarbeitung des Artikels und
3) Verantwortlichkeit für die Freigabe des Manuskripts
Somit ist es mit den Leitlinie vereinbar, dass ein oder mehrere Mitarbeiter eines pharmazeutischen Unternehmens oder von ihr beauftrage Personen oder Firmen die Hauptarbeit für die Kriterien 1 und 2 leisten, aber nicht als Autor genannt werden, wenn sie keine Verantwortung für die Freigabe des Manuskripts tragen. Anders herum qualifiziert sich ein Wissenschaftler als Autor, wenn er zu Kriterium 1 einen Beitrag geleistet hat, dem er oder jemand anders die dehnbare Bezeichnung "substantiell" verpasst, an einem vorformulierten Artikel einige Änderungen vornimmt und dann formal den Artikel zum Druck frei gibt. Der Mitarbeiter des Unternehmens erscheint im veröffentlichten Artikel entweder gar nicht im Kleingedruckten als "contributor".
Matheson bezeichnet die Leitlinine des ICJME daher nicht als Hindernis sondern als Vehikel zur Vertuschung des Ursprungs einer Studie und ihrer Autorschaft für Marketingzwecke.
Zur Abhilfe empfiehlt er eine grundlegende Revision der ICMJE-Leitlinien mit dem Ziel, die Urheberschaft von Studien und die Beiträge aller Personen und Organisationen wahrheitsgemäß darzustellen.
In derselben Ausgabe von PLoS Medicine argumentieren Simon Stern und Trudo Lemmens, dass es sich bei ghost bzw guest authorship sowohl von Seiten des guest authors als auch von Seiten der Industrie rechtlich um Betrug handelt, was entsprechend bestraft werden sollte.
In einem Editorial fordern die Herausgeber des PLoS Medicine entschiedene Maßnahmen gegen die Verschleierung der Urheber- und Autorenschaft, weisen aber auch darauf hin, dass die derzeitige Situation der Ausdruck einer gewachsenen Kultur der Einflussnahme der Industrie ist, von der nicht nur die Industrie und die Autoren, sondern auch die Fachzeitschriften profitieren - industriegesponserte Studien werden häufiger zitiert als anderweitig finanzierte Studien und erhöhen damit den Impact Factor (wir berichteten) - eines der wichtigsten Kriterien für das Ansehen einer Zeitschrift.
Matheson A. How Industry Uses the ICMJE Guidelines to Manipulate Authorship- And How They Should Be Revised. PLoS Med 2011;8(8):e1001072 Link
Stern S, Lemmens T. Legal Remedies for Medical Ghostwriting: Imposing Fraud Liability on Guest Authors of Ghostwritten Articles. PLoS Med 2011;8(8):e1001070. Link
Editorial. The PLoS Medicine Editors. Ghostwriting Revisited: New Perspectives but Few Solutions in Sight. PLoS Med 2011;8(8):e1001084. Link
David Klemperer, 3.9.11
Fortbildungssponsoring durch die Industrie: Ärzte erkennen das Problem aber nicht die Lösung
 In den USA wird - wie in Deutschland - ein erheblicher Anteil der ärztlichen Fortbildung durch die Industrie finanziert, in den USA 2006 laut Jahresbericht 2009 der Akkreditierunsstelle für Fortbildung zu 60%.
In den USA wird - wie in Deutschland - ein erheblicher Anteil der ärztlichen Fortbildung durch die Industrie finanziert, in den USA 2006 laut Jahresbericht 2009 der Akkreditierunsstelle für Fortbildung zu 60%.
Für die Industrie ist das Sponsoring ärztlicher Fortbildung Teil ihres Marketing mit dem Ziel, die Umsätze ihrer Produkte zu erhöhen. In zahlreichen Untersuchungen ist belegt, dass die Qualität der Informationen leidet, wenn die Industrie direkt oder indirekt an ihrer Erstellung oder Vermittlung beteiligt ist. Darüber berichten wir fortlaufend in der Rubrik "Einflussnahme der Pharma-Industrie".
Angesichts des Wissens um Bias, also die Verzerrung von Informationen, hat das Institute of Medicine in seinem wegweisenden Bericht über Interessenkonflikte in der Medizin (wir berichteten) ein Fortbildungssystem gefordert, das frei von kommerziellem Einfluss ist, das Vertrauen der Öffentlichkeit verdient und hohe Qualität bietet.
In einer kürzlich veröffentlichten Studie wurden die Teilnehmer von 5 Fortbildungsveranstaltungen zu AIDS-Themen zum einen danach befragt, ob die Finanzierung durch die Industrie ihrem Eindruck nach zu Bias führt; zum anderen wurde nach der Bereitschaft gefragt, selbst mehr für Fortbildung zu zahlen oder eine Minderung des Komforts im Kauf zu nehmen, um die Unabhängigkeit zu gewährleisten. 55% der 770 Befragten waren Ärzte, 35% Angehörige von Pflegeberufen oder anderen in der Versorgung von AIDS-Patienten beteiligten Berufsgruppen.
Die Stärke des wahrgenommenen Bias korrelierte mit dem Ausmaß der Industriefinanzierung - je größer der Anteil an der Gesamtfinanzierung desto größer der Bias. Beispielsweise gehen bei 100%iger Industriefinanzierung 86% der Ärzte von einem mäßigen bis starken Bias aus, bei 20% noch 33%; bei unabhängiger Finanzierung sehen 93% keinen oder nur minimalen Bias. Sponsoring durch eine Firma geht mit größerer Bias-Gefahr her als durch 2 oder mehr Firmen.
Ärzte schätzten den Bias durchgehend etwas höher ein als Angehörigen anderer Berufe.
Erhöhte Teilnahmegebühren als ein Weg zur Minderung des Industrieeinflusses - dieser Vorschlag trifft bei den Ärzten auf ein geteiltes Echo: etwas weniger als die Hälfte stimmt dem zu, etwas mehr als die Hälfte nicht. Etwas mehr als die Hälfte hält das Sponsoring der Fortbildung durch die Industrie für essentiell und spricht sich gegen die Abschaffung aus, 83% sprechen sich explizit gegen die Abschaffung aus oder antworten neutral, nur 17% sind explizit für die Elimination des Industriesponsoring.
Auch die Vorschläge für Kostensenkungen spalten die Ärzteschaft: jeweils 50% würden auf kostenloses Essen verzichten bzw. auch weniger attraktive Veranstaltungsorte akzeptieren. Gegen weniger Themen und weniger Vortragende sowie weniger Fortbildung überhaupt sprechen sich jedoch jeweils etwa 90% aus.
Wenig überraschend ist es, dass diejenigen, die den Sponsoring-Bias höher einschätzen einer Erhöhung der Teilnahmegebühren und einer Elimination des Sponsoring eher zustimmen.
Zusammenfassend lässt sich sagen, dass viele Ärzte die Probleme des Sponsoring von Fortbildung durch die Industrie erkennen. Auch gibt es eine gewisse Bereitschaft zu kostensenkenden Maßnahmen und zur Zahlung erhöhter Teilnahmegebühren. Die Zustimmung zur vollständigen Unabhängigkeit durch Elimination des Sponsoring befürwortet in dieser Studie jedoch nur eine Minderheit von 17%.
Vergleichbare Daten liegen für Deutschland bislang leider nicht vor.
Tabas JA, Boscardin C, Jacobsen DM, Steinman MA, Volberding PA, Baron RB. Clinician Attitudes About Commercial Support of Continuing Medical Education: Results of a Detailed Survey. Arch Intern Med 2011;171:840-46
Abstract
Der Report des Institute of Medicine "Conflict of Interest in Medical Research, Education, and Practice" kann seit Kurzem nach einer unkomplizierten Registrierung kostenlos heruntergeladen werden.
Website
David Klemperer, 10.7.11
USA: Wie der rein kommerzielle Verkauf von Rezeptdaten an die Pharmaindustrie zum Verfassungsrecht auf "freie Rede" wird.
 Am 26. Mai 2011 warnten drei Herausgeber des renommierten "New England Journal of Medicine" davor, dass der Oberste Gerichtshof der Vereinigten Staaten unter dem Deckmantel der Redefreiheit die patient- und arztbezogene Aufbereitung von Rezeptinformationen durch so genannte "data mining"-Firmen für die Vertriebsinteressen der Pharmaindustrie (dem so genannten "detailing") für zulässig erklärt. Dem Rechtsstreit lag ein Gesetz des Bundesstaates Vermont zugrunde, das die Weitergabe derartiger Daten für diese kommerziellen Zwecke (ausdrücklich aber nicht für Forschungszwecke) verboten hatte und sich positive Effekte zur Senkung der Arzneimittelausgaben und Sicherung der Arzneimittelsicherheit erhofft hatte.
Am 26. Mai 2011 warnten drei Herausgeber des renommierten "New England Journal of Medicine" davor, dass der Oberste Gerichtshof der Vereinigten Staaten unter dem Deckmantel der Redefreiheit die patient- und arztbezogene Aufbereitung von Rezeptinformationen durch so genannte "data mining"-Firmen für die Vertriebsinteressen der Pharmaindustrie (dem so genannten "detailing") für zulässig erklärt. Dem Rechtsstreit lag ein Gesetz des Bundesstaates Vermont zugrunde, das die Weitergabe derartiger Daten für diese kommerziellen Zwecke (ausdrücklich aber nicht für Forschungszwecke) verboten hatte und sich positive Effekte zur Senkung der Arzneimittelausgaben und Sicherung der Arzneimittelsicherheit erhofft hatte.
Der Datenhandel läuft so, dass sämtliche Rezeptdaten, die bei Apotheken zusammenlaufen, also Informationen über die Art und Menge von Verordnungen, der Arztname und soziodemografische Angaben zum Patienten, von diesen an Firmen weiterverkauft werden, die diese Daten so aufbereiten, dass sie von den Außendienstmitarbeitern der Pharmaunternehmen für die Direktwerbung oder die wie auch immer geartete Einflussnahme auf das Verordnungsverhalten einzelner Ärzte genutzt werden können. Zur Aufbereitung gehören patient- wie arztbezogene Verschreibungsgeschichten. Durch die Kenntnis des konkreten Arztes können die "data mining"-Firmen dem Verkaufsdatensatz durch einen Link zum Masterfile der "American Medical Association" (AMA) u.a. auch noch Informationen über die Ausbildung des Arztes und Praxisdetails hinzufügen. Das Ganze gleicht also einer Art Marketing-"Schlaraffenland" für die Pharmaindustrie, das die Empfänger der Rezepte, ohne dass sie einen Nutzen davon haben, letztlich über die Medikamentenpreise bezahlen.
Gegen das Gesetz, das dies zumindest Vermont verboten hatte, klagte u.a. die auch in Deutschland aktive Firma IMS Health. Sie sah in ihm eine Einschränkung der mit dem First Amendement zur US-Verfassung zum unverzichtbaren Kern der Verfassung gezählten Redefreiheit.
Die NEJM-Herausgeber wiesen dagegen sehr darauf hin, dass es hier nicht um den Schutz eines Verfassungsrecht geht, sondern um schlichte Geschäftemacherei ohne jeglichen Verfassungsrang: "As medical journal editors committed to the open communication of medical knowledge, we are strong proponents of First Amendment protection for speakers who attempt to communicate important evidence-based health information or advocate for patients and physicians' rights. But, the doctor-patient relationship is a sacred trust, and the sale of physicians' confidential prescribing information puts pa-tients' highly private medical information at risk. Why should this information be sold to data-mining and drug companies as a commodity, when it offers no benefit to patients and their physicians? This undesirable practice is nothing more than commercial conduct — not speech — and it is not in the best interest of the health of the American people." Sie wiesen ferner darauf hin, dass überhaupt nur 3% der Ärzte eine der wenigen Möglichkeiten kennt, einen Teil ihrer sie identifizierenden Daten zu verbergen oder nicht weitergeben zu lassen.
Trotz dieser und ähnlicher Einwände erklärte der "Supreme Court" am 23. Juni 2011 mit eine rMehrheit von sechs zu drei Stimmen das Gesetz zu einem Verstoß gegen die in der US-Verfassung durch den ersten Zusatz verankerte und auch sehr hoch geachtete Redefreiheit. Damit haben die Apotheken, die "data mining"-Unternehmen und die Pharmaunternehmen auch in Vermont wieder alle Freiheiten über die Daten von Ärzten und PatientInnen miteinander "zu reden" und brauchen auch nicht zu fürchten, dass andere Bundesstaaten das Gesetz übernehmen. Zugleich wurde damit zum ersten Mal in einem demokratischen Land die Vorbereitung und die Abwicklung rein kommerzieller und zum Teil auch qualitativ fragwürdiger Geschäfte zu einem schützenswerten Verfassungsgut höchstrichterlich aufgehübscht und gegen praktische Kritik immunisiert. Fragwürdig meint z.B. die nicht selten an Drückermethoden erinnernden "Beratungstätigkeiten" von Pharmavertretern bei den mittels dieser Daten identifizierten ärztlichen Wenigverordnern von Medikamenten.
Sieht man sich, sensibilisiert durch den Rechtsstreit in den USA an, was die deutsche Dependanz der Firma IMS Health an Dienstleistungen vor allem für die hiesigen "detailer" der Pharmaindustrie anbietet, fällt die geringe Transparenz über die Gewinnung der dazu genutzten Daten auf.
IMS bietet beispielsweise folgende Leistungen an:
• "Sales Optimization: Die IMS Sales Optimization Lösungen schaffen regionale Transparenz über die Vertriebs- und Verschreibungsaktivitäten in allen wichtigen Distributionskanälen. Damit können sowohl Führungskräfte in Vertrieb und Marketing als auch die einzelnen Außendienstmitarbeiter Potenziale und Ziele besser erkennen und ihre Aktivitäten auf einer verlässlichen Basis planen und kontrollieren."
• Das Leistungspaket "IMS Disease Analyzer liefert retrospektive Analysen tatsächlicher Therapie- und Krankheitsverläufe auf Patientenebene in deutschen Arzt-Praxen. Die erhobenen Daten erlauben eine Verknüpfung zwischen Arzt, Patient, Diagnose und Therapie. IMS Disease Analyzer bietet Entscheidungshilfen zu Fragen in allen Phasen des Produktlebenszyklus und unterstützt eine optimierte Produktpositionierung und Potenzialbestimmung. Als Datenquelle dienen Patientenkonsultations-Daten aus Praxiscomputern von mehr als 1.000 deutschen Arztpraxen (internationale Daten aus 3 weiteren europäischen Ländern stehen zusätzlich zur Verfügung). Insgesamt liegen Informationen zu mehr als 8 Mio. Patienten mit über 100 Mio. Verordnungen über einen Zeitraum von 12 Jahre vor."
Hier stellt sich die Frage, ob es sich nicht um Daten handelt, die primär für andere Zwecke und vor allem auf Kosten der Krankenversicherten generiert und gesammelt wurden. Mit Sicherheit werden diese Daten also nicht deshalb produziert, damit sie Firmen wie IMS wie auch immer aufbereitet weiterverkaufen können und dabei keinen erkennbaren substantiellen Nutzen für Patienten und Ärzte verfolgen.
Das 53 Seiten-Urteil des Supreme Court of the United States ist kostenlos erhältlich. Lohnenswert zu lesen sind sowohl das Mehrheits- als auch das Minderheitsvotum der mehrheitlich von den beiden Bush-Administrationen berufenen obersten Bundesrichter.
Bernard Braun, 24.6.11
Pharmavertreter und Medizinstudenten - eine verhängnisvolle Affäre
 Die meisten Medizinstudenten haben von Beginn ihres Studiums an Kontakt zu Pharmavertretern und nehmen gerne Einladungen zu Mahlzeiten und kleine Geschenke an. Dies und mehr fanden amerikanische Forscher in einer systematischen Übersichtarbeit heraus, in sie der Frage nach Kontakten von Medizinstudenten mit Pharmavertretern und ihrer Haltung gegenüber den Marketingpraktiken der Industrie nachgingen. Die Ergebnisse stützen sich auf 32 Studien, zumeist Befragungen, aus den Jahren 1971 bis 2010 mit insgesamt 9.850 Studenten an 76 Kliniken bzw. Lehrkrankenhäusern.
Die meisten Medizinstudenten haben von Beginn ihres Studiums an Kontakt zu Pharmavertretern und nehmen gerne Einladungen zu Mahlzeiten und kleine Geschenke an. Dies und mehr fanden amerikanische Forscher in einer systematischen Übersichtarbeit heraus, in sie der Frage nach Kontakten von Medizinstudenten mit Pharmavertretern und ihrer Haltung gegenüber den Marketingpraktiken der Industrie nachgingen. Die Ergebnisse stützen sich auf 32 Studien, zumeist Befragungen, aus den Jahren 1971 bis 2010 mit insgesamt 9.850 Studenten an 76 Kliniken bzw. Lehrkrankenhäusern.
Die häufigsten Interaktionen sind Industrie-gesponserte Fortbildung, Einladungen zum Essen, Geschenke wie Kugelschreiber und Tassen, Lehrbücher und Fortbildungsmaterialien, Sonderdrucke von Studien, Arzneimittelmuster und "social events", womit Einladungen in Restaurants, Konzerte, Theater und Sportereignisse gemeint sein dürften. Im vorklinischen Teil des Studiums waren die einzelnen Interaktionen teils selten - so gab es keine Einladungen zu feinem Essen - addierten sich aber auf, so dass fast alle Studenten Kontakt zur Industrie hatten. Im Verlauf des Studiums wurden die Kontakte mit jedem Semester häufiger.
Die Haltungen der Studenten bezüglich der Marketing-Praktiken unterschieden sich und waren teils gegensätzlich. Viele hielten Mahlzeiten, kleine Werbegeschenke und Lehrbücher bzw. Informationsmaterialien für akzeptabel, weniger Zustimmung fanden social events und Reisen. Geschenke anzunehmen rechtfertigten sie mit Geldknappheit und damit, dass es die anderen ja auch täten. Die Zustimmungsraten zur Annahme von Geschenken durch Studenten stiegen von der vorklinischen zur klinischen Phase des Studiums an, ebenso wie die Zustimmung zur Annahme von Geschenken durch Ärzte. Die große Mehrheit (85%) meinte hingegen, dass es für Regierungsbeamte unangemessen sei, Geschenke anzunehmen.
Die meisten Studenten (je nach Studie bis zu 92%) gingen davon aus, dass die Informationen der Industrie verzerrt sind. Nicht alle, aber viele Studenten waren trotzdem der Meinung, dass die Informationen nützlich für ihre Ausbildung sind. 2/3 waren der Meinung, gegenüber den Beeinflussungsversuchen der Industrie immun zu sein. Die meisten hielten ihre Mit-Studenten - im Gegensatz zu sich selbst - für beeinflussbar.
Je ausgeprägter die Kontakte zur Industrie waren, desto seltener hielten die Studenten die Kontakte für unangemessen, die Informationsmaterialien für verzerrt und generell die Marketing-Praktiken für negativ.
Deutliche Auswirkungen zeigte die jeweilige Lernumgebung. Manche Fakultäten bzw. Lehrkrankenhäuser beschränken oder unterbinden die Aktivitäten von Pharmavertretern. In diesen Einrichtungen waren die Interaktionen der Studenten mit Pharmavertretern deutlich seltener, ihre Einstellungen kritischer und die Einschätzung der Werbebotschaften skeptischer.
Befragt nach ihrer Einstellung zu Reformen lehnten es die meisten Studenten ab, den Pharmavertretern den Zugang zur Klinik zu verwehren. Die Mehrheit wünscht jedoch mehr Fortbildung in Fragen der Interaktion von Ärzten und Industrie.
Zusammenfassend entsprechen die Ergebnisse dieser Studie über Medizinstudenten dem, was man aus anderen Studien über Ärzte weiß:
• Die Mehrheit zeigt eine unkritische Haltung gegenüber den Marketinganstrengungen der Industrie.
• Die Mehrheit erkennt die Unzuverlässigkeit der Informationen der Industrie und hält sie trotzdem für wertvoll
• Die meisten halten sich für immun gegenüber den Beeinflussungsversuchen der Industrie, seine Kollegen nicht.
An anderer Stelle haben wir Studien referiert, die aufgezeigt haben,
• dass Ärzte in ihrem Verschreibungsverhalten durch das Marketing der Industrie beeinflusst werden mit dem Ergebnis einer schlechteren Arzneimittelversorgung (Link) und
• dass es keine Immunität gegenüber "weapons of influence" wie Reziprozität und Freundschaft gibt Link.
Austad KE, Avorn J, Kesselheim AS. Medical Students' Exposure to and Attitudes about the Pharmaceutical Industry: A Systematic Review. PLoS Med 2011;8(5):e1001037, Volltext kostenlos Link
Studie über Ärzte:
Lieb K, Brandtönies S. Eine Befragung niedergelassener Fachärzte zum Umgang mit Pharmavertretern. Dtsch Arztebl 2010;107(22):392-8. Link
dazu Forum Gesundheitspolitik: Ärzte und Pharmavertreter - eine verhängnisvolle Affäre Link
David Klemperer, 21.6.11
Die gar nicht so wettbewerblichen Methoden der US-Markenmedikamenthersteller, den Verkauf von Generika zu behindern!
 Die staatliche "Federal Trade Commission" (FTC) der USA und ihr "Bureau of Competition" berichten in einem aktuellen Verwaltungsbericht, dass 2010 die Anzahl der Deals der pharmazeutischen Industrie, mit denen mit allen Mitteln der Zugang zu preisgünstigeren und gleichwertigen Generika-Arzneimittel möglichst lange verzögert werden soll, gegenüber 2009 um 60% (von 19 auf 31 Fällen) gestiegen ist.
Die staatliche "Federal Trade Commission" (FTC) der USA und ihr "Bureau of Competition" berichten in einem aktuellen Verwaltungsbericht, dass 2010 die Anzahl der Deals der pharmazeutischen Industrie, mit denen mit allen Mitteln der Zugang zu preisgünstigeren und gleichwertigen Generika-Arzneimittel möglichst lange verzögert werden soll, gegenüber 2009 um 60% (von 19 auf 31 Fällen) gestiegen ist.
Die dem FTC und dem Justizministerium für das Jahr 2010 offiziell mitgeteilten 131 Patentverzögerungen beruhten in 31 Fällen auf direkten Zahlungen der Hersteller von Original-Arzneimittelherstellern an den Generikaproduzenten und auf diversen Einschränkungen ihrer Vermarktungsfähigkeiten. 66 finale Verzögerungen erschwerten die Fähigkeit des Generikaproduzenten sein Produkt zu vermarkten. Was dies im Einzelnen wirklich heißt und wie hoch die Dunkelziffer ist, bleibt leider auch in den veröffentlichten Berichten im Dunkeln. Geschützt werden sollten damit aber eindeutig und ausschließlich die wirtschaftlichen Interessen der Hersteller von 22 verschiedenen Originalpräparate mit einem Marktpreisvolumen von 9,3 Mrd. bis 20 Mrd. US-$.
Der Chef der FTC, Jon Leibowitz, fasste die Effekte dieser organisierten Verzögerungen des Markteintritts von Generika so zusammen: "The increasing number of these deals is a win-win proposition for the pharmaceutical industry, but a lose-lose for everyone else."
Und was "win-win" und "lose-lose" konkret bedeutet, wird von der FTC so quantifiziert:
• Die Stillhalteprämien zwischen den Markenmedikamente- und Generikahersteller führten in den vergangenen Jahren zu einem durchschnittlich 17 Monate späteren Markteintritt des Generikums.
• Durch den dadurch längeren wettbewerbsfreien Verbleib von Originalpräparaten auf dem Arzneimittelmarkt zahlen die us-amerikanischen Krankenversicherungen bzw. die Patienten jährlich mindestens 3,5 Mrd. US-$ mehr als sie bei vorhandenem Wettbewerb mit Generika bezahlen müssten.
Eine Presseerklärung vom 5. Mai 2011 mit der Überschrift "FTC Staff Report Finds 60 Percent Increase in Pharmaceutical Industry Deals That Delay Consumers' Access to Lower-Cost Generic Drugs" gibt es kostenlos. Ebenso den Report des "Bureau of Competition"Agreements Filed with the Federal Trade Commission under the Medicare Prescription Drug, Improvement, and Modernization Act of 2003 Overview of Agreements Filed in FY 2010".
Für die vergleichbare Praxis vor 2010 und einige normative Grundlagen für diese Art von Wettbewerbsbehinderung gibt der im Januar 2010 ebenfalls von der FTC veröffentlichte 16-Seiten-Bericht "Pay-for-Delay: How Drug Company Pay-Offs Cost Consumers Billions. An FTC Staff Study" Auskunft. Auch dieser Bericht steht kostenlos zur Verfügung.
Bernard Braun, 10.5.11
Amerikanische kardiologische Leitlinien: kann man ihnen vertrauen?
 Leitlinien fassen das Wissen vieler Studien zu einem Krankheitsbild zusammen. Sie sollen dazu beitragen, die in Studien gewonnene Evidenz den Patienten zugute kommen zu lassen. Die Empfehlungen in Leitlinien können über den wirtschaftlichen Erfolg eines Arzneimittels oder Medizinproduktes entscheiden. Daher ist die Glaubhaftigkeit, Neutralität und Unabhängigkeit von Leitlinien von besonderer Bedeutung. Interessenkonflikte der Leitlinienersteller durch Beziehungen zur Industrie sind problematisch, weil sie die Unabhängigkeit gefährden und zu verzerrten Urteilen führen können.
Leitlinien fassen das Wissen vieler Studien zu einem Krankheitsbild zusammen. Sie sollen dazu beitragen, die in Studien gewonnene Evidenz den Patienten zugute kommen zu lassen. Die Empfehlungen in Leitlinien können über den wirtschaftlichen Erfolg eines Arzneimittels oder Medizinproduktes entscheiden. Daher ist die Glaubhaftigkeit, Neutralität und Unabhängigkeit von Leitlinien von besonderer Bedeutung. Interessenkonflikte der Leitlinienersteller durch Beziehungen zur Industrie sind problematisch, weil sie die Unabhängigkeit gefährden und zu verzerrten Urteilen führen können.
Eine amerikanische Studie ging der Frage der Unabhängigkeit von Leitlinien zu Herz-Kreislauf-Krankheiten nach. Dafür wurden Art und Ausmaß der Interessenkonflikte untersucht, welche die Ersteller der Leitlinien selbst angegeben haben. Diese Angaben wurden im Rahmen der Leitlinienerstellung nicht verifiziert, weswegen das tatsächliche Ausmaß von Interessenkonflikten bei der Leitlinienerstellung eher noch höher sein dürfte.
17 Leitlinien des American College of Cardiology (ACC) bzw. der American Heart Association (AHA) aus den Jahren 2004 bis 2008 wurden analysiert. Die Erklärungen der Autoren über ihre Interessenkonflikte wurden ausgewertet. Die Autoren von ACC/AHA-Leitlinien müssen seit einigen Jahren ihre Interessenkonflikte schriftlich angeben und dabei auch die Unternehmen und Institutionen nennen, die Art der Verbindung sowie die finanzielle Größenordnung (10.000 Euro oder weniger bzw mehr als 10.000 Euro). Die Verbindungen zu pharmazeutischen Firmen oder Herstellern von Medizinprodukten werden in vier Kategorien eingeteilt: Annahme von finanzieller Unterstützung für Forschung, Vorträge, Aktienbesitz, Beratung (Research Grants, Honoraria/Speakers' Bureau, Stock/Other Ownership, Consultant/Advisory Board).
An der Erarbeitung der 17 Leitlinien waren 498 Personen beteiligt. 277 der 498 Personen (56%) gaben einen Interessenkonflikt an. Als "Episode" wurde die Teilnahme einer Person an einer Leitlinie definiert. Gezählt wurden 651 Episoden, weil einige Personen an mehr als einer Leitlinie beteiligt waren. Bei 365 der 651 Episoden (56%) lag ein Interessenkonflikt vor. Die Zahl der Episoden pro Leitlinie lag zwischen 15 und 58, der Anteil Episoden mit Interessenkonflikt pro Leitlinie zwischen 13% und 60%.
Unter "normalen" Mitgliedern von Leitliniengruppen betrug der Anteil derjenigen mit Interessenkonflikt 63%, bei Gegenlesern (peer reviewer) 51%. Bei den Vorsitzenden lag in 81% ein Interessenkonflikt vor.
Insgesamt bestanden unter den Autoren der 17 Leitlinien Beziehungen zu 581 Firmen und zu 18 nicht-kommerziellen Institutionen. Für jede Leitlinie wurde die Firma ermittelt, die am häufigsten einen Interessenkonflikt verursachte. Eine Firma (Medtronic, ein Hersteller von Herzschrittmachergeräten) war in 7 der 17 Leitlinien die am häufigsten genannte.
Forschungsunterstützung, Vorträge und Beratung standen zahlenmäßig im Vordergrund der Interessenkonflikttypen. Während diese zumindest noch im Zusammenhang mit Wissenschaft stehen, gilt dies für den vierten Typ, den Besitz von Aktien oder Geschäftsanteilen nicht. Der Anteil dieses Interessenkonflikts beträgt - bezogen auf die Episoden einer Leitlinie - bis zu 17%.
Zusammenfassend ist festzustellen, dass die Leitlinien der großen amerikanischen kardiologischen Fachgesellschaft ACC / AHA zu erheblichen Teilen von Personen mit Interessenkonflikten erarbeitet werden. Besonders problematisch erscheint der hohe Anteil von Leitliniengruppenvorsitzenden mit Interessenkonflikt. Die Wahrscheinlichkeit von Bias - Überschätzung des Nutzens einer Technologie und Unterschätzung der Schäden - ist somit hoch.
Dies ist ein deutlicher Hinweis auf die Notwendigkeit, Interessenkonflikte nicht nur transparent zu machen sondern auch zu regulieren.
Das Deutsche Netzwerk Evidenzbasierte Medizin hat kürzlich ein Diskussionspapier veröffentlicht, in dem die internationale Entwicklung zur Regulierung von Interessenkonflikten dargestellt wird. Das Papier soll die Debatte um Interessenkonflikte und deren Regulierung in Deutschland fördern. Stellungnahmen sind erwünscht.
Mendelson TB, Meltzer M, Campbell EG, Caplan AL, Kirkpatrick JN.
Conflicts of Interest in Cardiovascular Clinical Practice Guidelines.
Arch Intern Med 2011;171(6):577-84.
Abstract
Diskussionspapier des Deutschen Netzwerks evidenzbasierte Medizin e. V. (DNEbM):
Interessenkonfliktregulierung: Internationale Entwicklungen und offene Fragen.
Autoren: Daniel Strech, David Klemperer, Hannes Knüppel, Ina Kopp, Gabriele Meyer, Klaus Koch
Website
Download
David Klemperer, 30.4.11
Lücken in der Transparenz: Meta-Analysen zumeist ohne Angaben von Interessenkonflikten
 Angaben über Finanzierungsquellen und Interessenkonflikten von Autoren der zugrundeliegenden Studien sind in Meta-Analysen eher rar.
Angaben über Finanzierungsquellen und Interessenkonflikten von Autoren der zugrundeliegenden Studien sind in Meta-Analysen eher rar.
Dies ist das Ergebnis einer im Journal of the American Medical Association erschienenen Studie. Die Autoren suchten dafür in medizinischen Fachzeitschriften mit hohem Impact-Factor und in der Cochrane-Datenbank Systematischer Übersichtsarbeiten nach jeweils drei Meta-Analysen über pharmakologische Themen mit dem jüngsten Erscheinungsdatum. Ausgewertet wurden 29 Meta-Analysen.
Bei Meta-Analysen und Systematischen Übersichtsarbeiten handelt es sich um "Studien über Studien", d.h. um die Zusammenfassung der Ergebnisse der verfügbaren Primärstudien zu einer Frage. Die Primärstudien werden "nach expliziten Methoden identifiziert, ausgewählt und kritisch bewertet und die Ergebnisse extrahiert und deskriptiv (Systematische Übersicht) oder mit statistischen Methoden quantitativ (Meta-Analyse) zusammengefasst " (EBM-Glossar, Deutsches Netzwerk Evidenzbasierte Medizin).
Die 29 Meta-Analysen umfassten insgesamt 509 randomisierte kontrollierte Studien (RCTs). Nur in 2 der Meta-Analysen wurde über die Finanzierung der ausgewerteten RCTs berichtet. Verbindungen von Autoren zur Industrie oder Mitarbeiterstatus wurden von den Autoren der Meta-Analyse gar nicht mitgeteilt.
Eine Analyse aller 509 RCTs ergab Folgendes:
• in 318 Studien (63%) wurde die Finanzierungsquelle genannt
• 219 (69% bezogen auf 318 Studien) Studien waren von der Industrie finanziert
• in 132 RCTs wurden die finanziellen Verbindungen der Autoren veröffentlicht, in 91 Studien hatte ein oder mehr als ein Autor Verbindungen zur Industrie
• in 7 der 29 Meta-Analysen lag bei allen eingeschlossenen RCTs mindestens ein Interessenkonflikt vor, aber nur 1 dieser 7 Meta-Analysen berichtete über die Finanzierungsquellen und keine über die Verbindungen der Autoren zur Industrie.
Die Autoren weisen darauf hin, dass die Notwendigkeit einer vollständigen und transparenten Darlegung von Interessenkonflikten allgemein anerkannt und in vielen Bereichen Standard ist. So fordert das CONSORT (Consolidated Standards of Reporting Trials) statement die Nennung der Finanzierungsquelle und die Beschreibung der Rolle des Sponsors. Die im International Committee of Medical Journal Editors (ICMJE) zusammengeschlossenen Herausgeber medizinischer Fachzeitschriften fordern von ihren Autoren die Angabe materieller und anderer Interessenkonflikte.
Das PRISMA Statement (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) fordert für Systematische Übersichtsarbeiten und Meta-Analysen die Offenlegung ihrer Finanzierung. Nicht gefordert wird hier jedoch die Einbeziehung der Finanzierungsquellen und Interessenkonflikte der Einzelstudien, die in die Analyse einbezogenen werden.
Die somit vorhandene Lücke ist besonders schwerwiegend, weil Systematische Übersichtsarbeiten und Meta-Analysen Evidenz der höchsten Stufe darstellen und für Behandlungsentscheidungen aber auch für die Leitlinienerstellung genutzt werden. Die Verzerrungen, die in Industrie-gesponserten Studien häufig zu finden sind, können zur Folge haben, dass der Nutzen von Arzneimitteln überschätzt und die möglichen Schäden unterschätzt werden, was für den Patienten eine Gefährdung darstellen kann - eine Sammlung von Beiträgen im Forum findet sich hier.
Roseman M, Milette K, Bero LA, Coyne JC, Lexchin J, Turner EH, et al. Reporting of Conflicts of Interest in Meta-analyses of Trials of Pharmacological Treatments. JAMA: The Journal of the American Medical Association 2011;305:1 Abstract
David Klemperer, 3.4.11
Zur gar nicht kleinen Rolle öffentlicher Einrichtungen bei der Entdeckung und Entwicklung neuer und hoch wirksamer Medikamente.
 Die Arzneimittelindustrie verweist auf die Frage nach ihren zum Teil insgesamt oder auch nur in Ländern wie Deutschland sehr teuren Produkten gerne auf den hohen Forschungs- und Entwicklungsaufwand für hoch wirksame Arzneimittel. Dies mag zum Teil so sein und der durch mehrstufige Erprobungsverfahren hohe und teure Aufwand ist auch notwendig und seinen Preis wert. Trotzdem verweist ein genauerer Blick auf das Forschungs- und Entwicklungsgeschehen einen nicht geringen Anteil dieses Aufwandes in den Bereich der interessierten Legendenbildung.
Die Arzneimittelindustrie verweist auf die Frage nach ihren zum Teil insgesamt oder auch nur in Ländern wie Deutschland sehr teuren Produkten gerne auf den hohen Forschungs- und Entwicklungsaufwand für hoch wirksame Arzneimittel. Dies mag zum Teil so sein und der durch mehrstufige Erprobungsverfahren hohe und teure Aufwand ist auch notwendig und seinen Preis wert. Trotzdem verweist ein genauerer Blick auf das Forschungs- und Entwicklungsgeschehen einen nicht geringen Anteil dieses Aufwandes in den Bereich der interessierten Legendenbildung.
In einer gerade im renommierten "New England Journal of Medicine" veröffentlichten Studie schauten sich Wissenschaftler nämlich gründlicher als andere ForscherInnen in der Vergangenheit die Entwicklung neuer Arzneimittel in den USA während der letzten 40 Jahre an. Sie wollten wissen, was an der alten aber immer noch weit verbreiteten Vorstellung stimmt, im öffentlichen Wissenschaftsbereich würde Grundlagenforschung über Krankheiten und ihre Ansatzpunkte und Mechanismen zur Heilung (so genannter "upstream") gemacht und in privaten Unternehmen sei vor allem die angewandte Forschung zur Entwicklung und Vermarktung von Arzneimittel (so genannter "downstream") verortet.
Dass daran nichts oder relativ wenig stimmt, machen die AutorInnen an den folgenden Funden fest:
• 153 von der Arzneimittelzuzahlungsbehörde FDA der USA im Betrachtungszeitraum zugelassenen neuen Arzneimnittel, Impfstoffe oder neuen Anwendungsindikationen bereits entwickelter Mittel wurden durch öffentliche Forschungseinrichtungen entdeckt und auch zum Teil bis zur Marktreife entwickelt worden. Darunter stellten Mittel zur Krebsprävention und zur Prävention von Infektionserkrankungen aber auch Mittel gegen seltene Erkrankungen den größeren Anteil dar.
• Der Anteil aller in öffentlichen Forschungseinrichtungen entdeckter Behandlungsmöglichkeiten und Arzneimittel an den zwischen 1990 und 2007 neu zugelassenen medikamentösen Behandlungsmöglichkeiten bewegt sich zwischen 9,3 % und 21,2 %.
• Den therapeutisch-klinisch wichtigen Effekt der im öffentlichen Bereich entdeckten Arzneimittel halten die AutorInnen für überproportional groß.
Eine wichtige Ergänzung ihrer Recherchen wäre der Nachweis der Weiter-oder Wiederexistenz von Tendenzen gewesen, dass die mit Steuer- oder anderen öffentlichen Mitteln entdeckten Therapeutika weit unter Wert von privaten Pharmahersteller erstanden und nicht selten als so genannte "Blockbuster" zur Marktreife gelangen, ohne dass ein nennenswerter "return of investment" für die öffentlichen Einrichtungen erfolgt.
Der Aufsatz "The Role of Public-Sector Research in the Discovery of Drugs and Vaccines" von Ashley J. Stevens et al. ist im "New England Journal of Medicine" (2011;364: 535-41) erschienen und komplett kostenlos erhältlich.
Eine bereits im November letzten Jahres veröffentlichte Studie über insgesamt 252 Arzneimittel, deren Zulassung durch die FDA im wesentlich kürzeren und jüngeren Zeitraum zwischen 1998 und 2007 erfolgte, hatte vergleichbare Ergebnisse geliefert. Robert Kneller von der Universität Tokio verglich dabei den Anteil der Beiträge von Pharmaunternehmen, Biotech-Firmen und öffentlichen Forschungsinstituten an der Entwicklung neu zugelassener Medikamente. In dem Artikel The importance of new companies for drug discovery: origins of a decade of new drugs errechnet Kneller, dass 58 % der Neuentwicklungen auf das Konto der Pharmaindustrie und 18 % auf das von Biotech-Firmen gingen; bei insgesamt 24 % der Innovationen hatten öffentliche Einrichtungen wesentliche Vorarbeiten geleistet, die in zwei Drittel der Fälle Biotech-Firmen und in den übrigen Fällen Pharmaunternehmen zur Marktreife weiterentwickelten.
Bezieht man nun den erwarteten therapeutischen Nutzengewinn in die Betrachtung ein, geht der Anteil der von der Pharmaindustrie auf weniger als die Hälfte zurück (46 %) und der von Biotech-Firmen bleibt nahezu konstant gegenüber der Gesamtschau (23 %), während der Beitrag öffentlicher Einrichtungen immerhin bei fast einem Drittel der real innovativen Neuzulassungen liegt (30 %). Das bedeutet, dass nach Knellers Berechnungen nahezu jede dritte wichtige Entwicklung im Arzneimittelsektor auf die Leistungen öffentlicher Forschungseinrichtungen zurückgeht. Insgesamt stammen etwa die Hälfte aller von der FDA zwischen 1998 und 2007 zugelassenen, wissenschaftlich innovativen Arzneimittel und jedes Medikamente, das bis dahin nicht bestehende therapeutische Möglichkeiten eröffnete, von Biotechnologiefirmen und von Universitäten, die ihre Entdeckungen solchen kleineren Unternehmen übertrugen.
Enorme regionale Unterschiede bestehen bei den Forschungserfolgen der Pharmaindustrie, denn die großen Pharmafirmen liefern in den USA nicht mehr als 38 % der Erfindungen während in Deutschland 86 % der neuartigen Arzneimittel aus der Pharmaindustrie stammen. Offenbar spielt die öffentliche Forschung in Deutschland im Vergleich zu den USA eine weniger bedeutsame Rolle: Nur fünf der insgesamt 252 neuen Medikamenten entstanden an deutschen Hochschulen oder mit ihrer Beteiligung.
Von dem Artikel The importance of new companies for drug discovery: origins of a decade of new drugs steht nur das Abstract kostenfrei zur Verfügung.
Kostenfrei zugänglich ist hingegen ein auf diesen beiden Studien beruhender deutschsprachiger Beitrag zur Bedeutung der öffentlichen Pharma-Forschung und der nicht-traditionellen Pharmahersteller findet sich in der Januar-Ausgabe der Pharma-Briefs der Buko Pharmakampagne. Dieser Beitrag, den Sie hier auch einzeln herunterladen können, betont auch den Aspekt der so genannten Orphan-Drugs, also der Medikamente gegen seltene Erkrankungen, und beleuchtet zusätzlich die Frage der Forschung für typische Krankheiten in Entwicklungsländern, wo öffentliche Forschung eine noch größere Bedeutung hat.
Bernard Braun, 4.3.11
"Wes Brot ich ess', des Nutzen ich preis'": Arzneimittelanzeigen in Fortbildungsmedien für Ärzte fördern Mittel-Empfehlungen
 Die oftmals kostenlos als Mittel zum Transfer wissenschaftlicher Erkenntnisse in die Praxis angebotenen und genutzten Zeitschriften, die sich u.a. mit Werbeanzeigen für Arzneimittel finanzieren, neigen zu einer deutlich unkritischeren Berichterstattung bis hin zu geballten Empfehlungen der beworbenen Mittel als andere und anderweitig finanzierte Fortbildungszeitschriften ohne Werbung.
Die oftmals kostenlos als Mittel zum Transfer wissenschaftlicher Erkenntnisse in die Praxis angebotenen und genutzten Zeitschriften, die sich u.a. mit Werbeanzeigen für Arzneimittel finanzieren, neigen zu einer deutlich unkritischeren Berichterstattung bis hin zu geballten Empfehlungen der beworbenen Mittel als andere und anderweitig finanzierte Fortbildungszeitschriften ohne Werbung.
Dies ist das Ergebnis der systematischen Analyse sämtlicher Ausgaben von 11 derartiger Zeitschriften (darunter die Ärztezeitung, Medical Tribune, Der Hausarzt, Deutsches Ärzteblatt und das Arznei Telegramm) im Jahr 2007 durch eine internationale Forschergruppe um die Marburger Mediziner Becker und Donner-Banzhoff.
In den insgesamt 465 Ausgaben fanden die ForscherInnen 638 Anzeigen für neue ("innovative") Arzneimittel und 497 redaktionelle Beiträge, die sich genau mit diesen Arzneimitteln befassten. In 297 Artikeln wurden klare Empfehlungen für oder gegen den Gebrauch der Arzneimittel gegeben.
Eine inhaltsanalytische Sichtung der redaktionellen Beiträge führten zu eindeutigen Ergebnissen:
• In den Zeitschriften, die von bezahlter Werbung leben, fanden sich 257 Empfehlungs-Artikel. 91,8 % dieser Artikel sprachen sich auf einer Skala von -2 bis +2 maximal für den Gebrauch der entsprechenden Arzneimittel aus. Bei zwei der untersuchten Zeitschriften verdoppelt sich sogar die Wahrscheinlichkeit einer therapeutischen Empfehlung, wenn eine Anzeige geschaltet war.
• In den Zeitschriften, die von Abonnementeinnahmen leben, gab es 34 Empfehlungs-Artikel. Von ihnen empfahlen 8,8 % den Gebrauch der Arzneimittel, 8,8 % waren unentscheiden und 82,3 % sprachen sich mehr oder weniger stark gegen die Nutzung der Arzneimittel aus.
• Nicht mehr verwunderlich ist es dann, wenn praktisch kein Autor solcher redaktionellen Beiträge etwas zu seinen möglichen Interessenkonflikten erwähnt, also sie auch nicht ausschließt. Einige Zeitschriften werben geradezu mit dem engen Nebeneinander und möglichen Miteinander von Anzeigen und Texten.
Wenn man zusätzlich beachtet, dass beispielsweise für die Ärzte in Kanada nachgewiesen ist, dass sie mehr als die Hälfte ihrer Informationen aus kostenlosen Zeitschriften beziehen, wird die Relevanz des Zusammenhangs von Werbeanzeigen und Verordnungsempfehlungen für die Gesundheit und den Geldbeutel der Patienten noch offenkundiger.
Vielleicht sollten Patienten demnächst auch ihren Arzt oder Apotheker nach seinen Informationsquellen fragen und nicht blind darauf vertrauen, dass der sich schon in guten und ja durchaus auch bezahlbaren Fachjournalen informiert!?
Der fünfseitige materialreiche Aufsatz "The association between a journal's source of revenue and the drug recommendations made in the articles it publishes" von Annette Becker, Fatma Dörter, Kirsten Eckhardt, Annika Viniol, Erika Baum, Michael M. Kochen, Joel Lexchin, Karl Wegscheider und Norbert Donner-Banzhoff ist in der Februarausgabe 2011 der kanadischen Fachzeitschrift "Canadian Medical Association Journal (CMAJ)" (Can. Med. Assoc. J., Feb 2011) erschienen und komplett kostenlos erhältlich.
Bernard Braun, 1.3.11
Von Pharmawerbung beeinflusste Ärzte verschreiben häufiger, qualitativ schlechter und teurer
 In einzelnen Studien der letzten Jahre war bereits deutlich geworden, dass Marketing und Werbung von Pharmaunternehmen eigene Zielsetzungen sehr wohl erreicht und das Verordnungsverhalten von Ärzten zu eigenen Gunsten zu beeinflussen vermag. Eine jetzt in der Open-Access-Zeitschrift "PLOS Medicine" veröffentlichte Meta-Analyse unter Einbezug von 58 schon veröffentlichten Studien hat diese Einzelergebnisse noch einmal bestätigt: Mediziner, die auf unterschiedlichen Wegen (Pharma-Referenten, Fortbildungs-Veranstaltungen, Broschüren usw.) häufiger Informationen von Pharma-Unternehmen aufnehmen, zeigen im Rahmen ihrer Medikamentenverordnung ein anderes Verhalten: Sie verschreiben mehr Medikamente, von der Indikation her weniger sinnvolle Arzneien und auch teurere Arzneien.
In einzelnen Studien der letzten Jahre war bereits deutlich geworden, dass Marketing und Werbung von Pharmaunternehmen eigene Zielsetzungen sehr wohl erreicht und das Verordnungsverhalten von Ärzten zu eigenen Gunsten zu beeinflussen vermag. Eine jetzt in der Open-Access-Zeitschrift "PLOS Medicine" veröffentlichte Meta-Analyse unter Einbezug von 58 schon veröffentlichten Studien hat diese Einzelergebnisse noch einmal bestätigt: Mediziner, die auf unterschiedlichen Wegen (Pharma-Referenten, Fortbildungs-Veranstaltungen, Broschüren usw.) häufiger Informationen von Pharma-Unternehmen aufnehmen, zeigen im Rahmen ihrer Medikamentenverordnung ein anderes Verhalten: Sie verschreiben mehr Medikamente, von der Indikation her weniger sinnvolle Arzneien und auch teurere Arzneien.
"Viele Ärzte", so erklärte Joel Lexchin, einer der Autoren in einer Pressemitteilung der Universität York, "behaupten von sich, dass die Informationen von Pharma-Unternehmen sie in ihren Entscheidungen nicht beeinflussen. Unsere Forschungsergebnisse zeigen jedoch ganz klar, dass es einen deutlichen - und zwar negativen - Einfluss gibt."
Etwa ein Viertel ihrer Einnahmen investieren US-Pharmafirmen in Werbung und Marketing für ihre Produkte, im Jahr 2004 waren es knapp 58 Milliarden Dollar. Dass diese Ausgaben sich rechnen, hat ein Bericht der Los Angeles Times gezeigt: Jeder zusätzliche Werbedollar, der für ein Arzneimittel ausgegeben wird, bringt etwa 5 Dollar zusätzlichen Umsatz, für Ausgaben im Bereich des Sponsoring von Bildungsveranstaltungen ist der Ertrag mit 3,56 $ nicht ganz so hoch. (vgl. "In Short, Marketing Works: By Targeting Consumers and Doctors").
In der jetzt durchgeführten Meta-Analyse eines siebenköpfigen australischen Forschungsteams wurde nun noch einmal bestätigt, dass dieser Effekt leider nur zu Gunsten des jeweiligen Pharma-Unternehmens besteht, aber eher zu Ungunsten von Patienten und Krankenkassen. 58 Studien wertete das Team noch einmal aus, Studien, in denen einerseits unterschiedliche Formen der Information durch Pharmafirmen erfasst waren, andererseits bestimmte Aspekte des Verordnungsverhaltens. In einigen Studien wurden mehrere der im Folgenden angeführten Merkmale untersucht. Wesentliche Ergebnisse waren dann:
• Zehn Studien hatten die Qualität des Verschreibungsverhaltens überprüft, und zwar mit unterschiedlichen Methoden, zum Beispiel Befolgung von Therapie-Leitlinien auf der Basis der Diagnose oder durch Vorgabe von klinischen Fallbeispielen mit der Aufforderung, passende Arzneimittel zu benennen. Vier Studien kamen zu dem Ergebnis, dass sich kein Zusammenhang finden lässt zur Intensität der Aufnahme medizinischer Informationen von der Pharma-Industrie, 5 Studien fanden heraus, dass sich das Verschreibungsverhalten dadurch verschlechtert, in einer Studie ergab sich eine Verbesserung.
• Von 51 Studien, die den Zusammenhang von Pharma-Informationen und Menge der verschriebenen Medikamente untersuchten, fand keine Untersuchung eine niedrigere Verordnungsmenge, 13 fanden keinen Zusammenhang, 38 stellten fest, dass mit der Intensität und Häufigkeit von Informationen durch die Pharma-Industrie auch die Menge verordneter Arzneien steigt.
• Damit hängt auch direkt zusammen, dass von 10 Studien, die die verursachten Arzneimittel-Kosten berücksichtigten, 5 Studien höhere Kosten ermittelten, 1 Studie niedrigere Ausgaben und 4 Studien keinen Zusammenhang fanden.
Die Wissenschaftler betonen, dass ihre Ergebnisse zwar einen eindeutigen Trend benennen. Da es sich bei den Studien aber nicht um randomisierte Kontrollstudien handelt (mit entsprechenden Kontrollgruppen von Ärzten) könne man nicht ausschließen, dass die Werbebotschaften der Pharmaindustrie in Einzelfällen doch einen positiven Effekt haben. Die Studie ist kostenlos im Volltext verfügbar: Geoffrey K. Spurling et al: Information from Pharmaceutical Companies and the Quality, Quantity, and Cost of Physicians' Prescribing: A Systematic Review
In einer 2008 in Deutschland durchgeführten Befragung von Fachärzten für Neurologie/Psychiatrie, Allgemeinmedizin und Kardiologie (den Facharztgruppen mit den höchsten Kosten für Arzneimittelverordnungen pro Arzt) hatte sich das paradoxe Ergebnis gezeigt, dass Ärzte zwar einen Einfluss der Werbung wahrnehmen. Aber dies nur bei Kollegen, nicht bei sich selbst. Drei von vier Ärzten gehen zunächst einmal davon aus, dass Pharmavertreter sie darin beeinflussen wollen, welche Medikamente sie verschreiben. Jedoch über 90% halten sich für völlig oder weitgehend immun gegenüber den Beeinflussungsversuchen: 9% der Befragten glauben, überhaupt nicht beeinflussbar zu sein, weitere 83% geben an, nur selten oder gelegentlich beeinflusst zu werden. Ihre Kollegen betrachten die Ärzte andererseits jedoch als beeinflussungsgefährdet: 21% glauben, dass diese den Beeinflussungsversuchen der Pharmavertreter häufig oder immer erliegen. (Ärzte und Pharmavertreter - eine verhängnisvolle Affäre) Diese deutsche Befragung bestätigt damit Befunde einer US-Studie aus dem Jahr 2007 (Physicians and Drug Representatives: Exploring the Dynamics of the Relationship
Kritische Worte kommen zu diesem Thema vom Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen. In seinem Gutachten 2005: "Koordination und Qualität im Gesundheitswesen" kommt der Rat unter der Überschrift "Detailing" auch zu der Feststellung, dass die Einflussnahme der Pharmaindustrie (durch Pharma-Referenten) auf das Verschreibungsverhalten der Ärzte durchaus erfolgreich und nachhaltig ist. Dort heißt es: "Je häufiger Ärzte Vertriebsagenten sehen,
• desto eher sind sie geneigt, Arzneimittel in Fällen einzusetzen, in denen eine nichtmedikamentöse Therapie die beste Option ist,
• desto häufiger vertreten sie Ansichten, die eher den Angaben aus der Werbung als denen in wissenschaftlichen Publikationen entsprechen,
• desto wahrscheinlicher ist es, dass sie Antibiotika unangemessen verschreiben,
• desto unwahrscheinlicher ist es, dass sie Generika206 rezeptieren und
• desto wahrscheinlicher verordnen sie teure Medikamente auch dann, wenn vergleichbar wirksame, aber billigere verfügbar sind.
Ärzte sind sich zwar der werbenden, verzerrenden Darstellung der produktbezogenen Informationen bewusst. Sie leugnen jedoch - trotz gegenteiliger empirischer Befunde - häufig, dass diese ihr Verhalten beeinflussen. Sie glauben vielfach an ihre persönliche Immunität gegenüber den Marketingmaßnahmen der Industrie. Allerdings korreliert die Zahl entgegengenommener Werbegeschenke empirisch positiv mit der Wahrscheinlichkeit einer solchen Einstellung." (SVR: Koordination und Qualität im Gesundheitswesen, Seite 650)
Gerd Marstedt, 15.11.10
Industriegesponserte Studien sind einträglicher - Interessenkonflikte bei Herausgebern von Fachzeitschriften
 Fachzeitschriften können von der Veröffentlichung von Studien über den Anstieg des Impact Factor und über die Einnahmen aus Sonderdrucken profitieren. Diese Faktoren können die Entscheidung des Herausgebers über die Annahme oder die Ablehnung der Veröffentlichung einer Studie beeinflussen und stellen somit einen Interessenkonflikt dar.
Fachzeitschriften können von der Veröffentlichung von Studien über den Anstieg des Impact Factor und über die Einnahmen aus Sonderdrucken profitieren. Diese Faktoren können die Entscheidung des Herausgebers über die Annahme oder die Ablehnung der Veröffentlichung einer Studie beeinflussen und stellen somit einen Interessenkonflikt dar.
Medizinisches Wissen und Handeln gründet auf den Ergebnissen von Studien. Wichtigster Ort für die Veröffentlichung von Studien sind Fachzeitschriften - auch in Zeiten des Internet. Der Herausgeber einer Fachzeitschrift trifft die letzte Entscheidung darüber, ob eine eingereichte Studie angenommen oder abgelehnt wird. Diese Entscheidung sollte der Herausgeber im Idealfall ausschließlich aufgrund der Relevanz und Qualität der Studie treffen.
Die Autoren untersuchten die in den Zeiträumen 1995-1996 und 2005-2006 veröffentlichten randomisierten kontrollierten Studien in sechs renommierten medizinischen Journalen (Annals of Internal Medicine, Archives of Internal Medicine,
British Medical Journal / BMJ, Journal oft he American Medical Association / JAMA, The Lancet, New England Journal of Medicine /NEJM). Für diese Studien wurde die Finanzierungsquelle ermittelt und die Anzahl der Arbeiten, in denen die Studien zitiert wurden. Die Anzahl der zitierenden Arbeiten geht in den sog. Impact Factor ein, der als ein Maß für die Bedeutung einer Fachzeitschrift gilt - auch wenn dieses Maß fragwürdig ist (siehe z.B. Beitrag in Wikipedia).
Der Anteil der Arbeiten, die allein von der Industrie finanziert wurde betrug im Zeitraum 2005-2006
• 7% im BMJ,
• 19% in den Annals of Internal Medicine
• 15% in den Archives of Internal Medicine
• 26% im JAMA
• 22% im Lancet
• 32% im NEJM.
Die durchschnittliche Zahl der zitierenden Arbeiten liegt bei Industrie-finanzierten Studien allgemein höher. So wurden Industrie-finanzierte Studien aus dem NEJM im Durchschnitt 82,2 Mal zitiert, hingegen Studien ohne Industrieunterstützung 47,3 Mal.
Erfolgreiche Studien streuen Firmen gerne weltweit in Form von Sonderdrucken, die sie von den Verlagen für Beträge bis über 1 Mio. Dollar kaufen, wie Richard Smith, der frühere Herausgeber des BMJ mitteilte. Die Autoren befragten die Herausgeber der sechs Fachzeitschriften per Email, welchen Anteil ihrer Einnahmen Anzeigen, Sonderdrucke und Industrie-gesponserte Beilagen in den Jahren 2005-2006 ausmachten.
Antworten erhielten sie nur vom BMJ und vom Lancet - JAMA, NEJM sowie die Archives bzw. Annals of Internal Medicine verweigerten die Informationen.
Das BMJ erzielte 16% seiner Einnahmen aus Anzeigen und 3% aus den 967.930 verkauften Sonderdrucken. Der Lancet erzielte 1% seiner Einnahmen aus Anzeigen und 41% aus 11.514.137 Sonderdrucken. Aufgrund öffentlich zugänglicher Daten berechneten die Autoren für das NEJM den Einnahmenanteil aus Anzeigen auf 23% sowie für die Archives und das JAMA den Anteil aus Anzeigen auf 53% und aus Sonderdrucken auf 12%.
Diese Studie bestätigt deutlich, worauf Richard Smith schon 2005 (und früher) hingewiesen hat: mit der Annahme oder Ablehnung einer Industrie-gesponserten Studie entscheidet ein Herausgeber sowohl über den Impact Factor seines Journals als auch über die Einnahme oder Nicht-Einnahme von sechs- bis siebenstelligen Dollarbeträgen.
Deutlicher kann ein Interessenkonflikt nicht sein. Für den Umgang mit diesen Interessenkonflikten bestehen bislang keine anerkannten Regeln. In einem begleitenden Editorial weist Harvey Marcovitch auf die langjährigen und intensiven Bemühungen der Herausgeber im Umgang mit Interessenkonflikten von Autoren hin. Als Paradox bezeichnet er den Umstand, dass ausgerechnet Fachzeitschriften, die an diesem Aspekt wissenschaftlicher Integrität Pionierarbeit geleistet haben (insbesondere JAMA und NEJM), Offenheit und Transparenz verweigern, wenn es um ihre eigenen Interessenkonflikte geht.
Marcia Angell, bis 2001 Herausgeberin des NEJM, hat im Jahr 2009 festgestellt: "It is simply no longer possible to believe much of the clinical research that is published, or to rely on the judgment of trusted physicians or authoritative medical guidelines. I take no pleasure in this conclusion, which I reached slowly and reluctantly over my two decades as an editor of TheNew England Journal of Medicine."
Entschiedene Schritte scheinen erforderlich, damit die medizinischen Fachzeitschriften ihre Glaubwürdigkeit wiedererlangen. Verzerrte Studienergebnisse führen zur Überschätzung des Nutzens und Unterschätzung des Schadens von Arzneimitteln - dies gefährdet Menschenleben, wie es sich zuletzt am Beispiel des Diabetes-Medikaments Avandia (Rosiglitazon) gezeigt hat (wir berichteten).
Lundh A, Barbateskovic M, Hrobjartsson A, Götzsche PC. Conflicts of Interest at Medical Journals: The Influence of Industry-Supported Randomised Trials on Journal Impact Factors and Revenue. A Cohort Study. PLoS Med 2010;7(10):e100035 Link zum Volltext
Richard Smith (2005). Medical journals are an extension of the marketing arm of pharmaceutical companies. PLoS Med 2005;2(5):e138. Link zum Volltext
Marcia Angell. Drug companies and doctors: A story of corruption. New York Review of Books 2009. Link zum Volltext
David Klemperer, 7.11.10
Künftige Arzneimittel-Romanschreiber werden es schwer haben, die Wirklichkeit bei GlaxoSmithKline zu übertreffen.
 Noch am Fuße der Presseerklärung, in der die Firma GlaxoSmithKline (GSK), also einer der weltweit führenden Pharmakonzerne, erklären muss, Strafgelder von insgesamt 750 Millionen US-Dollar für die wissentliche jahrelange Duldung schwerster Qualitätssicherheitsmängel und den Weiterverkauf möglicherweise gefährlich kontaminierter Arzneimittel zu zahlen, steht offentlich unbeeindruckbar das Selbstlob: "is committed to improving the quality of human life by enabling people to do more, feel better and live longer."
Noch am Fuße der Presseerklärung, in der die Firma GlaxoSmithKline (GSK), also einer der weltweit führenden Pharmakonzerne, erklären muss, Strafgelder von insgesamt 750 Millionen US-Dollar für die wissentliche jahrelange Duldung schwerster Qualitätssicherheitsmängel und den Weiterverkauf möglicherweise gefährlich kontaminierter Arzneimittel zu zahlen, steht offentlich unbeeindruckbar das Selbstlob: "is committed to improving the quality of human life by enabling people to do more, feel better and live longer."
Bei dem damit öffentlich bekanntwordenen und ausführlich in der Ausgabe der New York Times vom 26. Oktober 2010 dargestellten Arzneimittelsicherheitsskandal geht es kurz gefasst um Folgendes:
• In einer der weltweit größten Produktionsanlagen der Firma, Cidra bei San Juan in Puerto Rico (USA), mit einem zu Hochzeiten jährlichen Umsatz von 5,5 Milliarden US-Dollar wurden bis 2009 u.a. 20 Arzneimittel hergestellt, darunter Blockbuster wie Avandia oder Tagamet.
• In dieser Fabrikanlage gab es eine Kumulation von Verseuchungsrisiken, das von der vollkommen verschmutzten betriebseigenen Wasseranlage bis zu einem Belüftungssystem reichte, das verseuchte Luft, Keime und gefährliche Mikroorganismen im gesamten Betrieb verteilte.
• Der Verdacht über derartige Zustände war der staatlichen US-Arzneimittelzulassungsbehörde FDA bereits Anfang 2002 gekommen und sie teilte ihn der Firma GSK auch mit. Diese schickte dann im August 2002 eine Spezialistin nach Puerto Rico und ließ die dortigen Verhältnisse von insgesamt 100 Qualitätsexperten untersuchen. Diese entdeckte selber, dass die dortige Qualitätskontrolle eine "einzige Schweinerei" war. Neben der verkeimten Wasseranlage und dem maroden Belüftungssystem entdeckte sie z.B. noch, dass Arzneimittel wegen überfüllter spezieller Lagerräume in gemieteten Kraftfahrzeugen gelagert wurden, dass die Fabrik auch nicht die Sterilität von intravenösen Krebsmedikamenten gewährleisten konnte und Pillen unterschiedlicher Stärke manchmal in ein und derselben Dose landeten.
• Obwohl die Expertin führenden Mitgliedern des GSK-Managements die eindeutigen Probleme berichtete und auch empfahl damit zu beginnen die unsicheren und meist gesundheitsgefährdenden Medikamente zurückzurufen, passierte praktisch nichts. Im Mai 2003 wurde ihr Arbeitsverhältnis unter Hinweis auf Arbeitsmangel ("redundancy") beendet.
• Sie beschwerte sich bei Vorstandsmitgliedern von GSK und drohte dabei sogar, ihre Ergebnisse der FDA mitzuteilen, ohne dass GSK mit der Beendigung der bekannten Zustände begann.
• Daraufhin machte die Spezialistin mit ihrer Ankündigung ernst, informierte die FDA und verklagte die Firma auch auf Schadenersatz.
• Die FDA startete darauf eine Kriminaluntersuchung und ließ 2005 durch hunderte von bewaffneten Polizisten in der Fabrik in Puerto Rico Produkte im Wert von nahezu 2 Milliarden US-Dollar beschlagnahmen.
• Unfähig, an den Sicherheitsproblemen in der Fabrik etwas zu ändern, schloss GSK sie im Jahr 2009. In ihrer Presseerklärung vom 25. Oktober 2010 brachte ein Topmanager des Unternehmens diese Unfähigkeitserklärung auf den Punkt: "We regret that we operated the Cidra facility in a manner that was inconsistent with current Good Manufacturing Practice (cGMP) requirements and with GSK's commitment to manufacturing quality. GSK worked hard to resolve fully the manufacturing issues at the Cidra facility prior to its closure in 2009 and we are committed to continuous improvement in our manufacturing processes."
Die eingangs erwähnte Summe von einer dreiviertel Milliarde US-Dollar umfassende Strafe bezahlt GSK nach eigenem Bekunden u.a. um weitere straf- und zivilrechtliche Verfahren vor mehreren US-Gerichten zu stoppen und auch weitere Aktivitäten von so genannten "whistle-blower" zu verhindern.
Die in der genannten Presserklärung des Unternehmens enthaltene abwiegelnde Bemerkung, es gäbe seit 2001 keinen vergleichbaren Warnhinweis des FDA, ist angesichts der fast ein Jahrzehnt dauernden Unfähigkeit oder des konstant fehlenden Willens nach dem Bekanntwerden des Problems substantiell Abhilfe zu verschaffen, eigentlich nicht beruhigend.
Der ausführliche Artikel in der New York Times vom 26. Oktober 2010 ist kostenlos und evtl. mit geringem Anmeldeaufwand erhältlich.
Und natürlich gilt dies auch für die GSK-Pressemitteilung zur Zahlung der Strafe. Und selbst angesichts dieses Schaustücks über Vertuschung und billigendem Inkaufnehmen von lebensgefährlichen Auswirkungen eigener Qualitätsmängel auf kranke Menschen, offenbart der Pharmakonzern ein seltsames oder fragwürdiges Verständnis von Transparenz. Er startet seine Pressemitteilung nämlich öffentlich mit der Bemerkung: "This press release is intended for business journalists and analysts/investors. Please note that this release may not have been issued in every market in which GSK operates."
Bernard Braun, 29.10.10
Free the data! Verheimlichte Daten führen zu falscher Bewertung. Das Beispiel Reboxetin.
 Veröffentlichte Arzneimittelstudien, die von der Industrie gesponsert werden, führen häufig zu einer Überschätzung des Nutzens und einer Unterschätzung der Schäden. Dies ist verschiedenen Manipulationsmethoden geschuldet, deren Anwendung durch industrielle Sponsoren in zahlreichen Fällen erwiesen ist. Wir berichten dazu in der Rubrik "Einflussnahme der Pharma-Industrie". Eine der Methoden besteht darin, Studien mit unerwünschten Ergebnissen nicht zu veröffentlichen, was zu einer verzerrten Bewertung führt, dem sog. Publikationsbias.
Veröffentlichte Arzneimittelstudien, die von der Industrie gesponsert werden, führen häufig zu einer Überschätzung des Nutzens und einer Unterschätzung der Schäden. Dies ist verschiedenen Manipulationsmethoden geschuldet, deren Anwendung durch industrielle Sponsoren in zahlreichen Fällen erwiesen ist. Wir berichten dazu in der Rubrik "Einflussnahme der Pharma-Industrie". Eine der Methoden besteht darin, Studien mit unerwünschten Ergebnissen nicht zu veröffentlichen, was zu einer verzerrten Bewertung führt, dem sog. Publikationsbias.
Ein aktuelles Beispiel wird in einer Studie dargelegt, die jetzt im British Medical Journal erschienen ist. Darin geht es um die Substanz Reboxetin, die unter den Markennamen Edronax und Solvex gegen Depression eingesetzt wird. Im Jahr 2009 wurden in Deutschland noch 13,3 Mio. Tagesdosen an gesetzlich Krankenversicherte verschrieben (Arzneimittelreport 2010, S. 815), was einem eher kleinen Anteil an der Gesamtverschreibung von Antidepressiva (1.580 Mio. Tagesdosen) ausmacht.
Im Jahr 2009 sollte das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) den Nutzen von Reboxetin und anderen Antidepressiva bewerten. Dabei wurde deutlich, dass der Hersteller Pfizer nicht alle durchgeführten Studien veröffentlicht hat. Pfizer weigerte sich anfangs, die nicht veröffentlichten Studien dem IQWiG zur Verfügung zu stellen, gab aber in der Folge aufgrund öffentlichen Drucks nach (wir berichteten).
Der Zugang zu den bislang unveröffentlichten Studien zu Reboxetin ermöglicht den Vergleich der Nutzenbewertung mit und ohne Einbezug der unveröffentlichten Studien. Insgesamt werteten die Wissenschaftler des IQWiG 13 Studien zur Akutbehandlung der Depression mit 4.098 Patienten aus. Acht dieser 13 Studien waren nicht veröffentlicht. Damit waren bislang die Daten von 3.033 Patienten nicht berücksichtigt. Pfizer hatte somit 74% der vorhandenen Daten zurückgehalten.
In den 13 Studien wurde die Wirkung von Reboxetin im Vergleich zu Plazebo bzw. zu anderen Antidepressiva untersucht. Das Ergebnis lautet, dass Reboxetin ineffektiv bezüglich der erwünschten depressionsmindernden Wirkung und somit zur Behandlung der Depression ungeeignet ist. Patienten, die Reboxetin einnahmen, gaben mehr unerwünschte Wirkungen an als Patienten, die ein anderes Antidepressivum oder Plazebo erhielten.
Die veröffentlichten Studien überschätzten die erwünschten Wirkungen im Vergleich zu Plazebo um 115%, im Vergleich zu anderen Antidepressiva um 23% und sie unterschätzten die unerwünschten Wirkungen.
Somit hat der Hersteller die Zulassungsbehörden, die Ärzte und die Patienten mit einem geschönten Bild dieses im Jahr 1997 zugelassenen Arzneimittels getäuscht.
Aus diesem Sachverhalt leiten verschiedene Kommentatoren eine Reihe von Forderungen ab, wie z.B. das Recht von Prüfinstitutionen (wie z.B. das IQWiG) auf Erhalt aller Daten und das Recht von den Herausgebern von Fachzeitschriften, in Zweifelsfällen Einblick in die Rohdaten einer Studie nehmen zu können.
Lesenswert ist eine aktuelle Meldung von Pfizer, in der es blauäugig heißt: "Auch dem IQWiG liegen alle verfügbaren und bekannten Studien zu Reboxetin vor. Nachdem das IQWiG zu dem Ergebnis gekommen war, dass weitere Daten für die Bewertung des Nutzens des Präparats erforderlich seien, hat Pfizer diese zur Verfügung gestellt." Das Pfizer die Herausgabe erst verweigert hat, wird hier dreist unterschlagen.
Eyding D, Lelgemann M, Grouven U, Härter M, Kromp M, Kaiser T, et al. Reboxetine for acute treatment of major depression: systematic review and meta-analysis of published and unpublished placebo and selective serotonin reuptake inhibitor controlled trials. BMJ 2010;341.
Volltext kostenlos.
Editorial der Herausgeberinnen des British Medical Journal:
Godlee F, Loder E. Missing clinical trial data: setting the record straight. BMJ 2010;341. Volltext kostenlos
Kommentar von zwei früheren Herausgebern des New England Journal of Medicine.
Steinbrook R, Kassirer JP. Data availability for industry sponsored trials: what should medical journals require? BMJ 2010;341. Volltext kostenlos
Kommentar
Gigerenzer G, Wegwarth O, Feufel M. Misleading communication of risk. BMJ 2010;341. Volltext kostenlos
David Klemperer, 15.10.10
Wie Pharmaunternehmen die Krankheit der "weiblichen sexuellen Dysfunktion" konstruierten
 Bereits vor sieben Jahren veröffentlichte der amerikanische Wissenschaftsjournalist Ray Moynihan im "British Medical Journal" einen Aufsatz, in dem er die Erfindung der "weiblichen sexuellen Dysfunktion" als vielleicht deutlichstes Beispiel für das sogenannte "Disease Mongering" ausführlich beschrieb: "The making of a disease: female sexual dysfunction". Im Rahmen der Recherchen für sein jetzt erschienenes neues Buch "Sex, Lies and Pharmaceuticals" ist er auf eine große Zahl von Informationen gestoßen, die konkret deutlich machen, wie Pharmaunternehmen vorgegangen sind, um in der Öffentlichkeit den Eindruck zu erwecken, man habe nicht nur eine neue, unter Frauen weit verbreitete Krankheit entdeckt, sondern auch schon Arzneimittel bereit, die Abhilfe gegen dieses Übel bieten.
Bereits vor sieben Jahren veröffentlichte der amerikanische Wissenschaftsjournalist Ray Moynihan im "British Medical Journal" einen Aufsatz, in dem er die Erfindung der "weiblichen sexuellen Dysfunktion" als vielleicht deutlichstes Beispiel für das sogenannte "Disease Mongering" ausführlich beschrieb: "The making of a disease: female sexual dysfunction". Im Rahmen der Recherchen für sein jetzt erschienenes neues Buch "Sex, Lies and Pharmaceuticals" ist er auf eine große Zahl von Informationen gestoßen, die konkret deutlich machen, wie Pharmaunternehmen vorgegangen sind, um in der Öffentlichkeit den Eindruck zu erwecken, man habe nicht nur eine neue, unter Frauen weit verbreitete Krankheit entdeckt, sondern auch schon Arzneimittel bereit, die Abhilfe gegen dieses Übel bieten.
Zusammenfassend schreibt Moynihan in seinem jetzt ebenfalls im British Medical Journal veröffentlichten Aufsatz: "Im Rückblick auf das letzte Jahrzehnt ist deutlich geworden, dass Pharma-Unternehmen nicht nur wissenschaftliche Arbeiten zur neuen Krankheit als Sponsor interstützt haben; verschiedentlich haben sie sogar geholfen, sie zu konstruieren. Unternehmens-Mitarbeiter haben mit bezahlten Meinungsführern zusammengearbeitet, um eine eigenständige Krankheit zu entwickeln. Sie haben epidemiologische Studien durchgeführt, um zu zeigen, dass die Krankheit weit verbreitet ist. Und sie halfen dabei, die diagnostischen Instrumente zu entwickeln, um Frauen zu überzeugen, dass ihre sexuellen Probleme einen medizinischen Namen und eine medizinische Behandlung verdienen."
Unter anderem berichtet Moynihan über folgende Details, auf die er bei seinen Recherchen gestoßen ist:
• Im Jahre 2005 "enthüllte" eine Studie mit fast 30 Tausend Teilnehmern überaus hohe Quoten sexueller Probleme weltweit: Danach hatte ein Drittel der beteiligten Frauen in Europa kein Interesse an Sex, in Südostasien kamen 40% der Frauen nicht zum Orgasmus. Die Studie "Sexual problems among women and men aged 40-80 y" war von Pfizer finanziert, ein Beschäftigter des Unternehmens war Mitglied im Forschungsteam. Die Studie - so der Leiter des Projekts, Prof. Ed Laumann von der University of Chicago - sollte Pfizer helfen, in verschiedenen Ländern Interesse an den beschriebenen Sexualproblemen zu erwecken.
• Weitere Studien, die etwa von Procter & Gamble oder Boehringer Ingelheim gefördert wurden, behaupteten ähnliche Befunde. Danach betrug die Unterentwicklung des sexuellen Verlangens bei Frauen nach der Menopause ("hypoactive sexual desire disorder") zwischen 9 und 26% ("Hypoactive sexual desire disorder in postmenopausal women"). In der anderen Studie ermittelte man eine Häufigkeit sexueller Probleme (alle Arten, Punkt-Prävalenz, also Vorlkommen zu einem bestimmten einzelnen Zeitpunkt) von rund 43%: ("Sexual problems and distress in United States women: prevalence and correlates."). In beiden Studien waren Unternehmens-Mitarbeiter an der Studie beteiligt. Zum gleichen Zeitpunkt kamen andere, nicht von Pharmaunternehmen geförderte Studien jedoch zu deutlich abweichenden Ergebnissen, wonach beispielsweise ein über sechs Monate andauerndes sexuelles Desinteresse bei Frauen überaus selten vorkommt.
• Mehrere Unternehmen der Pharmaindustrie engagierten sich auch in der Entwicklung diagnostischer Instrumente und Fragebögen, um die neu entwickelte Krankheit auch in der Praxis nachzuweisen: So entstand der "19 item female sexual function index", der "sexual function"-Fragebogen und 2009 kündigte Boehringer Ingelheim den "decreased sexual desire screener" an, der es Ärzten erlauben sollte, innerhalb weniger Minuten die Störung der "sexuellen Dysfunktion" zu diagnostizieren.
Moynihan berichtet auch noch über weitere Aktivitäten, etwa von Pfizer im Rahmen der ärztlichen Weiterbildung, und kommt abschließend in seinem Aufsatz zur Diskussion der Frage, ob es nicht neuer Regeln bedarf, um festzulegen, was als behandlungsbedürftige Krankheit gelten soll und was nicht und wie man diese Entscheidung von kommerziellen Interessen befreien könnte.
Leider ist zum Essay nur eine kurze Zusammenfassung kostenfrei verfügbar: Ray Moynihan: Merging of marketing and medical science: female sexual dysfunction (BMJ 2010; 341:c5050; doi: 10.1136/bmj.c5050 (Published 30 September 2010)
Vgl. zum Thema "Disease Mongering" auch die Artikel im "Forum Gesundheitspolitik":
• "Medikament sucht Krankheit": Die Bedeutung von Krankheitserfindung, Medikalisierung oder "disease mongering" im Gesundheitswesen
• Das Geschäft mit der Krankheit
Gerd Marstedt, 5.10.10
Europäische Arzneimittelbehörde: Rosiglitazon soll vom Markt
 Die Zulassung für das Diabetesmittel Rosiglitazon (Avadia®) aufheben, lautet die am 23.9. ausgesprochene Empfehlung des Ausschusses Humanarzneimittel (CHMP) der Europäische Arzneimittelzulassungsbehörde (EMA) an die Europäische Kommission. Das Bundesinstitut für Arzneimittel und Medizinprodukte hat noch am selben Tag bekannt gegeben, dass Rosiglitazon ab 1. November in Deutschland nicht mehr verkauft werden darf. Ebenfalls am selben Tag hat der Hersteller GlaxoSmithKline einen sog. Rote-Hand Brief an alle Ärzte in Deutschland verschickt.
Die Zulassung für das Diabetesmittel Rosiglitazon (Avadia®) aufheben, lautet die am 23.9. ausgesprochene Empfehlung des Ausschusses Humanarzneimittel (CHMP) der Europäische Arzneimittelzulassungsbehörde (EMA) an die Europäische Kommission. Das Bundesinstitut für Arzneimittel und Medizinprodukte hat noch am selben Tag bekannt gegeben, dass Rosiglitazon ab 1. November in Deutschland nicht mehr verkauft werden darf. Ebenfalls am selben Tag hat der Hersteller GlaxoSmithKline einen sog. Rote-Hand Brief an alle Ärzte in Deutschland verschickt.
Die Zulassungsbehörden begründen ihre Entscheidung mit einer Neubewertung der Nutzen-Risiko-Relation auf Grund kürzlich veröffentlichter Studien.
Damit gelangt eine Angelegenheit zu einem vorläufigen Ende, die in mehrfacher Hinsicht die Gefahren derzeitiger Arzneimittelregelungen für die Patienten aufgezeigt hat. Wir berichteten mehrfach. Hier einige Aspekte:
• Rosiglitazon wurde 1999 in den USA und im Juli 2000 in Deutschland als Avandia® zur Behandlung des Diabetes mellitus zugelassen, weil es den Blutzucker zu senken vermag. Der Nachweis für eine Minderung von Mortalität und / oder Morbidität wurde nie erbracht. Vielmehr lagen bereits vor der Zulassung deutliche Hinweise für ein erhöhtes Risiko für Herzschwäche und für Herzinfarkte vor.
• Das Fazit des arzneimittel-telegramms zu Rosiglitazon am 21. Juli 2000 lautete folgendermaßen:
"Das neue Diabetes-Mittel Rosiglitazon (AVANDIA) ist wegen Wirkschwäche nur als Zusatztherapeutikum zugelassen. Es handelt sich unseres Erachtens um ein bedenkliches Arzneimittel. Rosiglitazon kann lebensbedrohliche Herzinsuffizienz und Leberversagen auslösen. (...) Diesen gefährlichen Risiken steht kein adäquater Nutzen gegenüber. Deshalb täuscht die Werbung - 'sehr gut vertraeglich' - Anwender und Patienten. Die Marktzulassung des Mittels können wir nicht nachvollziehen."
• Der Hersteller hat vor und nach der Zulassung Daten zur (Un-) Sicherheit von Rosiglitazon nicht veröffentlicht. Dies ist durch interne Dokumente zweifelsfei belegt (Committe on Finance, 12.7.2010 und Januar 2010, Forum Gesundheitspolitik).
• Die Europäische Zulassungsbehörde verpflichtete den Hersteller GlaxoSmithKline zu einer Studie, in der die Herz-Kreislauf-Komplikationen überprüft werden sollten, die sog. RECORD-Studie. Dabei akzeptierte die Behörde ein defizitäres Studiendesign - eine nicht verblindete randomisierte kontrollierten Studie. Die Ergebnisse dieser Studie sind aus verschiedenen Gründen nicht glaubhaft.
• Interessenkonflikte beeinflussen die Bewertung der vorliegenden Daten in hohem Maße. Wissenschaftler, die finanzielle Zuwendungen vom Hersteller erhielten, schätzten die Risiken von Rosiglitazon zumeist viel niedriger ein als unabhängige Wissenschaftler (Forum Gesundheitspolitik).
Mit einer durch Interessenkonflikte verzerrten Urteilsfähigkeit lässt sich möglicherweise erklären, warum die Deutsche Diabetes Gesellschaft (DDG) sich noch Ende Juni in einer Erklärung vehement gegen die vom Gemeinsamen Bundesausschuss (GBA) geforderte Beendigung der Erstattungsfähigkeit von Rosiglitazon ausgesprochen hat. Die Hinweise der DDG, die Beschlüsse des GBA in den letzten 2 Jahren hinsichtlich der Therapie des Diabetes mellitus Typ 2
- würden die Therapie auf den Stand der frühen 80iger Jahre zurückwerfen,
- stünden im Widerspruch zu den Leitlinien der Deutschen Diabetes Gesellschaft und zu internationalen Leitlinien,
- stünden im Widerspruch zu den Maßgaben der nationalen und internationalen Zulassungsbehörden
entbehren nicht einer gewissen Ironie. Wenige Wochen nach dieser Beschimpfung des GBA durch die DDG revidierte die Europäische Zulassungsbehörde ihr Urteil im Sinne des GBA.
Die Zulassung und Rücknahme von Rosiglitazon ist ein Lehrbeispiel (das hier nur skizziert werden kann) für
• die fehlende Orientierung der Arzneimittelzulassung an den Patienteninteressen,
• die Möglichkeiten der Industrie, Daten zur Sicherheit zu unterdrücken oder gar nicht erst zu generieren,
• die lange Dauer zwischen dem Auftreten gravierender Sicherheitsbedenken und dem Handeln der Zulassungsbehörden,
• die unselige, wenn nicht verwerfliche Rolle einiger Meinungsführern innerhalb der Diabetes-Community sowie von Diabetes-Fachgesellschaften, die mit einer unkritisch-befürwortenden Haltung wesentlich zur Zulassung und Verbreitung von Rosiglitazon beigetragen haben,
• die industriefreundliche und Verbraucher-gefährdende Haltung einer Patientengruppe, wie z.B. dem Deutschen Diabetiker Bund, wie sie sich z.B. in dieser Pressemitteilung vom 30.6.2010 zeigt,
• die unzureichende Bedeutung des Verbraucherschutzes, die sich noch im Widerspruch des Bundesgesundheitsministeriums vom 4.8.2010 (Schreiben des BMG) gegen den Beschluss des Gemeinsamen Bundesausschusses vom 17.6.2010 (Beschlusstext) zum Ausschluss der Verordnungsfähigkeit von Rosiglitazon zu Lasten der Gesetzlichen Krankenversicherung zeigt.
Rosiglitazon hätte nie zugelassen werden dürfen und hat bei fehlendem Nutzennachweis vielen Patienten Krankheit und Tod gebracht.
Vertiefung:
Forum Gesundheitspolitik:
"These data should not see the light of day to anyone outside of GSK". Risikowissen vorsätzlich durch Hersteller unterdrückt! Link
Täuschen, leugnen, desinformieren und einschüchtern - Strategien von GlaxoSmithKline zur Vermarktung ihres Diabetes-Blockbusters Link
Lehrstück "Rosiglitazone und Herzinfarktrisiko" zum Zweiten - Assoziation von finanziellen Interessenskonflikten und Bewertung. Link
Gar nicht rosig. Ein Diabetesmittel, das es nicht geben dürfte Download
Committee on Finance. Staff Report on GlaxoSmithKline and the Diabetes Drug Avandia Download
Steven Nissen. Setting the RECORD Straight. JAMA, 24.3.2010 Download
besonders lehrreich und mit internen Aussagen aus den Zulassungsbehörden gespickt:
Cohen D. Rosiglitazone: what went wrong? BMJ 2010 6.Sept 2010 Download Volltext (kostenlos)
David Klemperer, 26.9.10
Offenlegung von Interessenkonflikten: gravierende Lücken bei hohen Beträgen
 In mehr als der Hälfte der Artikel von Autoren, die mehr als 1 Mio. Dollar in einem Jahr von der Industrie erhielten, wurde der Interessenkonflikt verschwiegen. Dies ist das Ergebnis einer Untersuchung, die jetzt in den Archives of Internal Medicine erschienen ist.
In mehr als der Hälfte der Artikel von Autoren, die mehr als 1 Mio. Dollar in einem Jahr von der Industrie erhielten, wurde der Interessenkonflikt verschwiegen. Dies ist das Ergebnis einer Untersuchung, die jetzt in den Archives of Internal Medicine erschienen ist.
Im Rahmen von Strafverfahren wegen illegaler Zahlungen haben US-amerikanische Hersteller orthopädischer Produkte (künstliche Hüft- und Kniegelenke) ihre Zahlungen öffentlich gemacht. Daraus ergibt sich die Möglichkeit zu überprüfen, ob in nachfolgenden Publikationen der Empfänger die Zahlungen bzw. die Industrieverbindungen genannt wurden oder nicht.
Grundlage der Studie sind die Angaben von fünf Herstellern orthopädischer Produkte (Biomet, DePuy Orthopedics, Smith & Nephew, Stryker und Zimmer) aus dem Jahr 2007. Im Jahr 2007 zahlten diese fünf Firmen insgesamt 248 Mio. US-Dollar an 1.654 Einzelpersonen. Die Studie fokussiert auf Zahlungen von mehr als eine Million Dollar an Einzelpersonen.
Mehr als eine Mio. Dollar erhielten 40 Einzelpersonen - 38 Ärzte und 2 nichtärztliche Forscher. Ein Arzt erhielt von 2 Firmen jeweils mehr als eine Mio. Dollar. Die Beträge reichten von 1.042.238 Dollar bis zu 8.862.500 Dollar (Mittelwert 2.781.866 Dollar). Die Zahlungsempfänger wurden als Berater (consultant) geführt, der nähere Anlass der Zahlung ist nicht vermerkt.
Zwischen dem 1.1.2008 und dem 15.1. 2009 veröffentlichten 32 der 40 Zahlungsempfänger insgesamt 151 Aufsätze mit orthopädischem Thema - im Durchschnitt 5, maximal 11 Aufsätze. Dabei handelte es sich um klinische Studien, Literaturübersichten und Metaanalysen.
Die Zahl der ausgewerteten Aufsätze pro Autor wurde beschränkt, so dass letztlich 95 Aufsätze untersucht wurden.
44 der 95 Publikationen nannten den Interessenkonflikt (46%). Von den 27 Autoren mit mehr als einen Aufsatz gaben 4 (15%) die geldgebende Firma stets an, 14 Autoren (52%) mal ja mal nein, 9 Autoren (33%) nie. Journale mit strengeren Regelungen schnitten bei der Offenlegung nicht besser ab. Die tatsächliche Summe wurde dem Leser in keinem Fall mitgeteilt.
Auch wenn anzunehmen ist, dass in den meisten Fällen der Autor den Interessenkonflikt dem Herausgeber der Fachzeitschrift verschwiegen hat, ist auch denkbar, dass in Einzelfällen der Herausgeber den ihm gegenüber erklärten Interessenkonflikt den Lesern vorenthalten hat.
Besserung ist in Sicht: Teil der amerikanischen Gesundheitsreform (the Patient Protection and Affordable Care Act) ist die Einrichtung einer nationalen, öffentlich zugänglichen Datenbank, in der pharmazeutische Firmen und Medizingerätehersteller ab 2013 jede Zahlungen an Ärzte eintragen müssen, die höher ist als 10 Dollar. Die Datenbank wird den Namen, die Adresse und das Fachgebiet des Zahlungsempfängers enthalten sowie den Betrag, das Datum, den Anlass der Zahlung sowie das Produkt, das mit der Zahlung im Zusammenhang steht.
Chimonas S, Frosch Z, Rothman DJ. From Disclosure to Transparency: The Use of Company Payment Data. Arch Intern Med 2010:archinternmed.2010.341
Download Volltext (kostenlos)
David Klemperer, 15.9.10
Studienregister - kein Schutz vor manipulierten Studien
 Die Integrität biomedizinischer Forschung gilt als gefährdet. So ist z.B. die Nicht-Veröffentlichung ganzer Studien oder der Teile, die den Interessen industrieller Sponsoren widersprechen, gängige Praxis (Rubrik "Einflussnahme der Industrie").
Die Integrität biomedizinischer Forschung gilt als gefährdet. So ist z.B. die Nicht-Veröffentlichung ganzer Studien oder der Teile, die den Interessen industrieller Sponsoren widersprechen, gängige Praxis (Rubrik "Einflussnahme der Industrie").
Eine Reaktion der Politik auf die Missstände sind Studienregister, in denen vor Beginn bestimmte Angaben über die jeweilige Studie hinterlegt werden sollen. So hat das International Committe of Medical Journal Editors die Registrierung von Studien vor ihrem Beginn ab 2005 zur Voraussetzung der Veröffentlichung gemacht.
Die amerikanische Regierung hat mit ClinicalTrals.gov im Jahr 1999 ein öffentlich zugängliches Register für Studien über Arzneimittel und Hilfsmittel geschaffen, die in den USA zugelassen werden sollen.
Eine Studie untersuchte jetzt, wie es sich bei registrierten Studien mit dem Zusammenhang von Sponsor und der Studie verhält.
Hierfür wurden die in clinicaltrial.gov registrierten Studien aus folgenden 5 Arzneimittelkategorien herangezogen: Lipidsenker, Antidepressiva, Neuroleptika, Protonenpumpen-Inhibitoren und Vasodilatantien. Der Beginn der Studien lag nach dem 1.1.2000, das Ende vor dem 31.12.2006. So konnte auch geprüft werden, ob die Studien drei Jahre nach ihrer Beendigung veröffentlicht waren oder nicht.
Die Studien bezogen sich auf die Wirksamkeit, Sicherheit bzw. Nicht-Unterlegenheit (non-inferiority trials) der Arzneimittel.
Unterschieden wurde die drei Kategorien Sponsoring der Industrie, des Staates sowie Non-profit nicht-staatlich.
Gefunden wurde 546 Studien, die folgendermaßen finanziert waren:
• 346 (63%) von der Industrie
• 74 (15%) staatlich
• 126 (23%) non-profit / nicht-staatlich
Die Industrie war weiterhin beteiligt an
• 3 (4 %) der staatlichen Studien
• 126 (48%) der non-profit /nicht-staatlichen Studien
Der Anteil der positiven Ergebnisse unterschied sich je nach Sponsor:
• Industrie 85,4%
• Staat 50%
• nicht-staatlich / non-profit 71,9%
Studien aus der 3. Kategorie mit Industriebeteiligung fielen zu 85,0% positiv aus, ohne zu 61,2%.
Die Veröffentlichungsraten 24 Monate nach Beendigung lag insgesamt bei 39,7% und je nach Sponsor bei
• 32,4% Industrie
• 53,7% Staat
• 56,2% nicht-staatlich / non-profit insgesamt und
• 39,0% nicht-staatlich / non-profit mit Industriebeteiligung.
Diese Studie belegt, dass auch bei registrierten Studien die Ergebnisse den kommerziellen Interessen des industriellen Sponsors folgen. Über die Methoden, mit denen Studien manipuliert werden können, haben wir berichtet.
Bourgeois, F. T., S. Murthy, et al. (2010). "Outcome Reporting Among Drug Trials Registered in ClinicalTrials.gov." Annals of Internal Medicine 153(3): 158-166.
Abstract der Studie
David Klemperer, 19.8.10
"These data should not see the light of day to anyone outside of GSK". Risikowissen vorsätzlich durch Hersteller unterdrückt!
 Der damals für die Arzneimittel-Richtlinien verantwortliche Bundesausschuss der Ärzte und Krankenkassen (also eine Art Vorläufer des heutigen Gemeinsamen Bundesausschuss [G-BA]) hat in seiner Sitzung am 3. Mai 2001 den Therapiehinweis nach Ziffer 14 Arzneimittel-Richtlinien für Thiazolidindione ("Glitazone") beschlossen, der zum Beispiel für die Wirkstoffe Pioglitazon und Rosiglitazon gilt. Der Wirkstoff wurde u.a. in den Mitteln Actos und Avandia der Arzneimittelunternehmen Takeda und GlaxoSmithKline (GSK) galt.
Der damals für die Arzneimittel-Richtlinien verantwortliche Bundesausschuss der Ärzte und Krankenkassen (also eine Art Vorläufer des heutigen Gemeinsamen Bundesausschuss [G-BA]) hat in seiner Sitzung am 3. Mai 2001 den Therapiehinweis nach Ziffer 14 Arzneimittel-Richtlinien für Thiazolidindione ("Glitazone") beschlossen, der zum Beispiel für die Wirkstoffe Pioglitazon und Rosiglitazon gilt. Der Wirkstoff wurde u.a. in den Mitteln Actos und Avandia der Arzneimittelunternehmen Takeda und GlaxoSmithKline (GSK) galt.
Zu den Risiken heißt es unter anderem:
• "Über die Sicherheit der Thiazolidindion-Medikation wird erst eine Langzeitanwendung Aufschluss geben."
• Und: "Eine Herzinsuffizienz kann durch Thiazolidindione ausgelöst bzw. eine bestehende Herzinsuffizienz verschlechtert werden. Thiazolidindione sind daher bei allen Graden der Herzinsuffizienz kontraindiziert. Eine erhöhte Inzidenz von Herzinsuffizienz wurde im Rahmen klinischer Studien, bei denen Rosiglitazon in Kombination mit Insulin verwendet wurde, beobachtet. Die Kombination von Rosiglitazon mit Insulin ist deshalb kontraindiziert."
• Außerdem: "Entsprechend der Zulassung und im Hinblick auf die Nebenwirkungen kommt Thiazolidindionen derzeit nur ein limitierter Einsatzbereich zu; es handelt sich um eine Untergruppe von Diabetespatienten, für die das therapeutische Potential von Metformin bzw. Sulfonylharnstoffen ausgeschöpft ist und die keiner Insulinbehandlung bedürfen. Die langfristigen Vorteile einer Therapie mit Thiazolidindionen wurden nicht nachgewiesen. Das gilt insbesondere für die bei Diabetes relevanten Endpunkte Mikro-/Makroangiopathie oder kardiovaskuläre bzw. Gesamt-Mortalität."
Am 17. Juni 2010 beschloss der G-BA, die Wirkstoffklasse der Glitazone aus der Erstattungsfähigkeit durch die GKV wegen des seit Jahren durch mehrere Studien nachgewiesenen Überwiegens des möglichen gesundheitlichen Schadens - durch Herzprobleme bis zum Tode und Knochenbrüche - gegenüber dem nachweisbaren Nutzen herauszunehmen und damit Arzneimittel wie Avandia von GSK vom Markt verschwinden zu lassen. Dass GSK dies angesichts des weltweit mit diesem Mittel erzielten Umsatzes von jährlich 1,2 Milliarden US-Dollar als "nicht gerechtfertigt" und "stark fehlerbehaftet" bewertet, und eine entgültige Entscheidung verhindern will, verwundert nicht.
Ein Großteil der derzeitigen öffentlichen Debatte pro und contra der GKV-Erstattungsfähigkeit und eines sogar gerechtfertigten Verbots der Wirkstoffe stützt sich auf die seit 2007 in aller Breite in den USA geführte Debatte. Wie der Mai/Juni 2010-Ausgabe des für dieses Themenfeld wie immer exzellenten "Pharma-Brief" der BUKO Pharma-Kampagne u.v.a. zu entnehmen ist, schätzte die "Federal DRug Administration (FDA)" der USA bereits im Juli 2007 auf der Basis mehrerer Studien (darunter der Studie von Nissen und Wolski im "New England Journal of Medicine" aus dem Jahr 2007), dass Rosiglitazone, also der Wirkstoff von Avandia seit seiner Zulassung 83.000 zusätzliche Herzinfarkte allein in den USA ausgelöst hat. Trotz dieses gesicherten Beitrags zur Herz-Kreislauf-Morbidität und -Mortalität passierte weder in den USA noch in Europa zunächst etwas.
Für den Umgang der Pharmahersteller mit erkannten Gesundheitsrisiken ihrer Produkte ist aber interessant, dass die Herz-Kreislauf-Risiken von Avandia bereits seit 1999 bekannt waren. Wie der auch bereits im "forum-gesundheitspolitik" vorgestellte Bericht eines US-Senatsausschusses im Januar 2010 dokumentierte, sprach GSK selber damals bereits von "increased risk of ischemic events, ranging from 30 % to 43 %" aus fremden aber auch eigenen Studien.
Noch direkter offenbart aber ein am12. Juli 2010 in der "New York Times" veröffentlichter Vorgang, die Bereitschaft von GSK, vorsätzlich kritische Erkenntnisse zu unterdrücken. Hier sieht man nicht nur die "rauchenden Colts", sondern auch das "Laden der Waffen".
Als Ergebnis einer eigenen Studie, welche Avandia mit Actos verglich, stand fest, dass Actos einen höheren Nutzen hatte und dass die Einnahme von Avandia mit erhöhten Herz-Kreislaufrisiken verbunden war. Das erschreckend Neue des Artikels der NYT ist der Beleg, dass dieses Ergebnis von GSK vorsätzlich unveröffentlicht blieb. In einer E-Mail vom 29. März 2001 heißt es von einem GSK-Verantwortlichen dazu: "Per Sr. Mgmt request, these data should not see the light of day to anyone outside of GSK."
Und wenig später antwortet ein GSK-Manager am 20 Juli 2001 einer Mitarbeiterin auf die Frage, ob die ebenfalls nicht vorteilhaften Ergebnisse eines weiteren Vergleichs von Rosiglitazone veröffentlicht werden sollten, so: "Rhona — Not a chance. These put Avandia in quite a negative light when folks look at the response of the RSG monotherapy arm … It is a difficult story to tell and we would hope that these do not see the light of day."
Dass sich GSK im Umgang mit Arzneimittelsicherheitsbehörden einer "minimal language" rühmt, und nicht nur Studienergebnisse verbirgt, sondern auch beweisbar unerwünschte Ereignisse in Studien löschte, wundert in dem gesamten Lehrstück nicht mehr.
Die Frage ist allerdings nur, warum es so lange brauchte bis erste Zulassungsinstitutionen wie z.B. der G-BA reagierten und warum die von industrienahen Diabetesorganisationen rasch angezettelte Debatte, die Herausnahme des Wirkstoffes und der entsprechenden Medikamente aus der Erstattungfähigkeit durch die GKV zum Teil zu verhindern, öffentliches Gehör findet?
Der von Jörg Schaaber verfasste, sehr informative Artikel "Gar nicht rosig. Ein Diabetesmittel, das es nicht geben dürfte" über Avandia ist im "Pharma-Brief" Nr. 4-5 (Mai/Juni 2010) abgedruckt, der komplett und kostenlos heruntergeladen werden kann.
Eine Reihe der internen Belege für die Unterdrückung bekannter Risiken von Avandia findet man unter der Überschrift "Avandia and Its Risks" auf einer Website der NYT.
Bernard Braun, 13.7.10
Ist es sporadisch und selten, wenn in Japan 99,7 % der Schweinegrippeviren gegen Tamiflu resistent sind? Die WHO meint ja!
 Die interessierte Welt hat durch einen Aufsatz in renommierten Medizinjournal "British Medical Journal (BMJ)" (vgl. dazu auch eine Zusammenfassung der Aussagen dieses Aufsatzes und anderer Texte im "forum-gesundheitspolitik") erfahren, dass mehrere Experten mit der WHO bekannten finanziellen Verbindungen zu Pharmafirmen, die finanzielle Interessen an einer bestimmten medikamentösen Art der Schweinegrippebekämpfung hatten, bei der Abfassung von WHO-Richtlinien beteiligt waren, die z.B. allen Nationalstaaten empfahlen, bestimmte antivirale Medikamente millionenfach anzuschaffen und kurativ und prophylaktisch im Kampf gegen die Vogelepidemie und Schweinegrippe-Pandemie einzusetzen.
Die interessierte Welt hat durch einen Aufsatz in renommierten Medizinjournal "British Medical Journal (BMJ)" (vgl. dazu auch eine Zusammenfassung der Aussagen dieses Aufsatzes und anderer Texte im "forum-gesundheitspolitik") erfahren, dass mehrere Experten mit der WHO bekannten finanziellen Verbindungen zu Pharmafirmen, die finanzielle Interessen an einer bestimmten medikamentösen Art der Schweinegrippebekämpfung hatten, bei der Abfassung von WHO-Richtlinien beteiligt waren, die z.B. allen Nationalstaaten empfahlen, bestimmte antivirale Medikamente millionenfach anzuschaffen und kurativ und prophylaktisch im Kampf gegen die Vogelepidemie und Schweinegrippe-Pandemie einzusetzen.
Dabei war u.a. auch der WHO stets die Gefahr bewusst, eine allzu häufige und vor allem prophylaktische Einnahme der Wirkstoffe Oseltamivir (die bekannteste und verbreiteste Arzneimittelmarke ist Tamiflu von der Firma Roche) und Zanamivir (bekannt durch das allerdings seltener eingesetzte Markenmedikament Relenza der Firma GlaxoSmithKline) könne zur raschen Resistenzbildung führen und damit die weitere Bekämpfung des Virus eher erschweren. In der WHO-Empfehlung "Antiviral use and the risk of drug resistance. Pandemic (H1N1) 2009 briefing note 12" vom 25. September 2009 wird dies auch bereits im Titel zum Ausdruck gebracht.
Die noch immer uneingeschränkt (geprüft am 18.6.2010) auf der WHO-Website stehenden Empfehlungen bagatellisieren aber in ihren Schlussfolgerungen das Risiko erheblich. Insbesondere werden Resistenzfälle als "sporadisch und selten" dargestellt und es gäbe keine Evidenz, dass oseltamivir-resistente Schweinegrippeviren in bestimmten Regionen oder gar weltweit zirkulierten.
Trotzdem brauchen sich die Public Health-Akteure keine Sorgen zu machen: "WHO and its network of collaborating laboratories are closely monitoring the situation and will issue information and advice on a regular basis as indicated."
Schon zum Zeitdruck der ersten Veröffentlichung dieser Empfehlungen hätte der WHO aber eigentlich die Existenz eines erheblichen Resistenzbildungsproblems vor allem in Japan bekannt sein müssen. Offensichtlich waren aber die damaligen Daten noch zu schwach um gegen die Verharmlosungsrhetorik der auch am Umsatzwohl der beiden Pharmariesen interessierten Expertenschar und gegen die sorgsam gehegte Furcht vor einer "1918/1919 II"-Pandemie mit zig Millionen Personen anwirken zu können.
Spätestens mit der Veröffentlichung einer Studie der "Working group for Influenza Virus Surveillance in Japan" in der Juni-2010-Ausgabe der renommierten Fachzeitschrift "Emerging infectious diseases" (Heft 6 Juni 2010; Volume 16, Number 6-June 2010), hätten diese industriefreundlichen Grundeinstellungen aber schlagartig und radikal verändert werden müssen.
Diese Studie stellt nämlich eine Reihe empirischer Zustände in Japan vor, die angesichts der weltseit Millionen eingelagerter Packungen Tamiflu, mal wirklich als dramatisch bezeichnet werden können:
• Als erstes wird nämlich berichtet, dass die Resistenzrate für Tamiflu und Produkte mit demselben Wirkstoff in Japan zwischen der 2007/08- und der 2008/2009-Grippesaison von 2,6 % auf 99,7 % angestiegen ist. Tamiflu ist damit zumindest zur Prophylaxe und Behandlung von Menschen, die an einer H1N1-Infektion leiden, praktisch wertlos.
• Dafür ist evtl. auch der geballte Einsatz von Tamiflu u. Co. maßgeblich verantwortlich, da Japan den weltweit höchsten Pro-Kopf-Verbrauch von Medikamenten dieser Wirkstoffgruppe hatte.
• Positiv wird immerhin vermeldet, dass u.a. das H1N1-Virus nicht zugleich gegen alle anderen Wirkstoffe resistent geworden ist. Dies sollte aber nicht als Freibrief für den Umstieg in den Masseneinsatz dieser Wirkstoffe verstanden werden, wenn man bedenkt, wie schnell sich unter einem massiven prophylaktischen und kurativen Einsatz Resistenzen entwickeln können.
• Die wesentliche Schlussfolgerung aus der japanischen Wissenschaftler lautet: "Although oseltamivir remains a valuable drug for treatment of pandemic (H1N1) 2009, many ORVs (Oseltamivir-resistente Viren) were isolated after prophylaxis with a half dose of the drug. Therefore, prophylaxis with oseltamivir may not be recommended as stated by WHO".
• Eine weitere Beobachtung der japanischen Virologen relativiert allerdings mindestens die aktuelle gesundheitliche Bedeutung der Entstehung von resistenten Viren etwas. Die Symptome und die Einweisungsraten in Krankenhäuser unterscheiden sich nämlich nicht zwischen Menschen mit ORVs und Menschen mit OSV, d.h. Oseltamivir-sensitiven Viren. Selbst wenn dies für den Moment etwas Dramatik aus den Folgen der Resistenzbildung nimmt, kann es nicht als Plädoyer für den weiteren üppigen Gebrauch dieses Wirkstoffs interpretiert werden.
In keinem Fall sollte eine Public Health-Einrichtung wie die WHO weiter die Häufigkeit der Resistenzbildung ignorieren oder kleinschreiben und dem prophylaktischen Einsatz unkritisch gegenüber stehen oder ihn gar fördern. Wenn, ja wenn da nicht die erwiesene Nähe maßgeblicher Ratgeber und Richtlinienverfasser zu der Firma wäre, die natürlich bald wieder weltweit die Lagerhallen mit "Kampfmitteln" gegen die nächste Grippewelle füllen möchte.
Der Aufsatz "Oseltamivir-resistant influenza A (H1N1) viruses during 2007-2009 influenza seasons, Japan" von Ujike M, Shimabukuro K, Mochizuki K, Obuchi M, Kageyama T, Shirakua M, et al. ist in "Emerging Infectious Diseases" erschienen, einer Zeitschrift, die von den "Centers for Disease Control and Prevention (CDC)" herausgegeben wird, einer wissenschaftlichen Einrichtung des US-Gesundheitsministeriums.
Bernard Braun, 18.6.10
Wie die Schweinegrippe-Politik der WHO jede Verschwörungstheorie in den Schatten stellt. Glaubwürdigkeit am Ende!
 Vor fast einem Jahr, am 11. Juni 2009 erklärte die Generaldirektorin der Weltgesundheitsorganisation (WHO), Margaret Chan, die Schweinegrippe zur Pandemie mit der höchsten Stufe 6 und löste damit eine Flut von aufwändigen, teuren und Millionen von Menschen in Angst und Schrecken versetzende Maßnahmen aus: "I have conferred with leading influenza experts, virologists, and public health officials. In line with procedures set out in the International Health Regulations, I have sought guidance and advice from an Emergency Committee established for this purpose. On the basis of available evidence, and these expert assessments of the evidence, the scientific criteria for an influenza pandemic have been met. I have therefore decided to raise the level of influenza pandemic alert from phase 5 to phase 6. The world is now at the start of the 2009 influenza pandemic." Und sie fügte hinzu: "WHO has been in close dialogue with influenza vaccine manufacturers."
Vor fast einem Jahr, am 11. Juni 2009 erklärte die Generaldirektorin der Weltgesundheitsorganisation (WHO), Margaret Chan, die Schweinegrippe zur Pandemie mit der höchsten Stufe 6 und löste damit eine Flut von aufwändigen, teuren und Millionen von Menschen in Angst und Schrecken versetzende Maßnahmen aus: "I have conferred with leading influenza experts, virologists, and public health officials. In line with procedures set out in the International Health Regulations, I have sought guidance and advice from an Emergency Committee established for this purpose. On the basis of available evidence, and these expert assessments of the evidence, the scientific criteria for an influenza pandemic have been met. I have therefore decided to raise the level of influenza pandemic alert from phase 5 to phase 6. The world is now at the start of the 2009 influenza pandemic." Und sie fügte hinzu: "WHO has been in close dialogue with influenza vaccine manufacturers."
Wie eng dieser Dialog war und ob es dabei blieb oder es immer mehr war als Miteinanderreden, sollten die öffentliche bekanntwerdenden Details über das Agieren dieser weltweiten Public Health-Institution bis zum heutigen Tag immer drastischer belegen.
Angesichts des nachhaltigen Ausbleibens der Schreckensseiten einer Pandemie bis zum heutigen Tag und der gleichzeitigen milliardenschweren Umsätze und Gewinne der wenigen Hersteller von Impfstoffen und der in ihrer Wirksamkeit bis heute umstrittenen Wirkstoffe Oseltamivir (als Tamiflu der Firma Roche bekannt) and Zanamivir (Markenname Relenza der Firma GlaxoSmithKline) und vieler Ungereimtheiten oder argumentativen Leerstellen der Protagonisten der Pandemie-Politik, gab es bereits früh Vermutungen, ein Teil der Ratgeber, also auch Mitglieder des "Emergency Committee" der WHO, hätten wegen bezahlter Tätigkeiten für die ökonomischen Nutznießer der Pandemiepolitik schwere Interessenskonflikte. Dies wurde u.a. von der WHO stets postwendend als bösartige und grundfalsche Ausgeburt von "Verschwörungstheorien" bestritten und zu diskreditieren versucht.
Was aber seit Ende letzten Jahres über das tatsächliche Geschehen immer deutlicher an die Öffentlichkeit drang, könnte selbst hartgesottene Verschwörungstheoretiker vor Neid erblassen lassen.
Ende 2009 charakterisierte der EX-SPD-MdB Wolfgang Wodarg, heute Vorsitzende des Gesundheitsausschusses des Europarats, des Zusammenschlusses von 47 Staaten, die fast alle auch Mitglied der WHO sind, die WHO-Politik als "campaign of panic" and a "false disaster".
Gestützt auf erste Recherchen einer Arbeitsgruppe des Europarats fügte er dem hinzu:
• "The WHO in collaboration with some big pharmaceutical companies and their scientists, re-defined pandemics and lowered the alarm-threshold. Those new standards forced politicians in most states to react immediately and sign marketing commitments for additional and new vaccines against "swine-flu" and spend billions of dollars to catch up."
• "Never before the search for traces of a virus was carried out so broadly and intensively, besides, many cases of death that happen to coincide with seropositive H1N1 lab-findings were simply attributed to "swine-flu" and used to foster fear."
• Und: "A group of people in the WHO is associated very closely with the pharmaceutical industry."
Die Mitglieder der "Parliamentary Assembly of the Council of Europe (PACE)" votierten daraufhin dafür, eine gründliche Untersuchung durchzuführen und deren ERgebnisse öffentlich zu diskutieren.
In der Resolution heißt es: "In order to promote their patented drugs and vaccines against flu, pharmaceutical companies have influenced scientists and official agencies, responsible for public health standards, to alarm governments worldwide. They have made them squander tight healthcare resources for inefficient vaccine strategies and needlessly exposed millions of healthy people to the risk of unknown side-effects of insufficiently tested vaccines."
Am 3. Juni 2010 beschäftigen sich Deborah Cohen, eine der Editorinnen des "British Medical Journal (BMJ)" und Philip Carter, Mitarbeiter des "Bureau of Investigative Journalism" in einem Feature in dem renommierten Medizinjournal mit dem Thema "Conflicts of interest. WHO and the pandemic flu 'conspiracies'".
Die Ross und Reiter, also auch Namen von Sponsoren und Geldempfänger beinhaltenden Ergebnisse lassen sich so zusammenfassen:
• In zahlreichen nationalen und transnationalen Institutionen, die über die Art und Weise der Reaktion auf Grippeerkrankungen entscheiden saßen und sitzen mehrere Wissenschaftler, die gleichzeitig und kontinuierlich Vorträge für Hersteller von Grippemitteln hielten, Forschungsgelder oder Beraterhonorare von ihnen erhielten oder sonstige Verbindungen mit möglichen Interessenskonflikten zu ihnen hatten.
• In dem insgesamt relevantesten Expertengremium der WHO arbeiteten drei der derartig parteilichen Experten an allen WHO-Richtlinien zur Schweinegrippe mit und verfassten darin z.B. das Kapitel "Gebrauch von antiviralen Mitteln während einer Influenza-Pandemie". Dieses Kapitel stammt von dem Infektionsmediziner Fred Hayden von der University of Virginia, der in einer vom Tamufluhersteller Roche bezahlten Studie zum Ergebnis, das Medikament reduziere die Häufigkeit von Krankenhauseinweisungen wegen Grippe um 60 %. Der Versuch einer Cochrane-Reviewergruppe um den britischen Virologen Jefferson , dieses Ergebnis nachzuvollziehen und es zu bestätigen scheiterte. Wen wundert es dann aber, dass Hayden via WHO-Richtlinie den einzelnen Ländern empfahl, sich ausgerechnet Vorräte von Medikamenten anzulegen und damit vor allem einen Vorrat von Tamiflu!?
• Fred Hayden gab auf die Fragen von Cohen und Carter an, er habe für ein 2002 stattgefundenes WHO-Expertentreff diese Interessenkonflikte gegenüber den WHO-Verantwortlichen auch angegeben: "DOI (declaration of interest) forms were filled out for the 2002 consultation." Ähnlich äußerte sich auch der Epidemiologe Arnold Monto , der die WHO-Richtlinien zum Gebrauch von Impfstoffen in Pandemien verfasste und diverse Zuwendungen vom Impfstoffhersteller GSK bekommen hatte: "Conflict of interest forms are requested before participation in any WHO meeting."
• Obwohl also der WHO bei mehreren Beratern Belege für Interessenkonflikte vorlagen und obwohl 2009 öffentlich über die Existenz der DOI-Formblätter berichtet wurde, taucht bis heute in keiner Richtlinie einer dieser Hinweise auf.
• Fred Hayden räumte auf Vorhalt der beiden BMJ-Autoren ein, er "strongly support transparency in declarations of interest". Selbst für den von ihm verfassten Text konzedierte er, erst mit diesem Wissen könne sich jedermann "make their own judgments about the possible relevance of any potential conflicts."
• Nur die WHO tut buchstäblich alles, um ihre Glaubwürdigkeit und die Verlässlichkeit ihrer Richtlinien, zu zerstören und dies auch noch als problemgerechte Politik zu verkaufen: Pressesprecher heben zum einen hervor, die WHO "never publishes individual DOIs, except after consultation with the Office of the Director-General". Und die Generaldirektorin Margaret Chan sei auch "very committed personally to transparency". Als der öffentliche Druck zu groß wird, konkretisiert Direktorin Chan in einer Presseerklärung vom 3. Juni 2010 zum achten Treffen des so fragwürdig gewordenen "Emergency Committees" warum es hier keine Transparenz gab bzw. was Transparenz aus ihrer Sicht ist: "On a separate issue, the Director-General noted that the secretariat is following the practice of the Organization for public disclosure of the names of the Emergency Committee members to take place once the work of the Committee had been completed. The purpose of this practice is to protect the integrity and independence of the Members while doing this critical work - but also to ensure transparency by publicly providing the names of the members as well as information about any interest declared by them at the appropriate time. The Committee Members strongly concurred with this approach." Angesichts der unumstrittenen Sachlage geht es der WHO-Generaldirektorin also aktuell darum, die "Integrität und Unabhängigkeit" der schon immer industrieabhängigen Mitglieder und ihrer industriefreundlichen Arbeit vor Beeinflussung zu sichern.
Dass der angemessene Zeitpunkt, die Namen der Berater und ihre Interessenkonflikte zu veröffentlichen, Sankt-Nimmerleinstag heißt und die schützenswerten Mitglieder diesem Ansatz zustimmen, verwundert dann niemand mehr.
• Unabhängig von dem dreisten, höchst parteilichen und für das künftige Vertrauen in WHO-Empfehlungen desaströse Verständnis der Leiterin der weltweiten Public Health-Institution WHO, wirft der Fall Schweinegrippe-Pandemie noch weitere grundsätzliche Fragen auf, die schnellstens beantwortet werden müssen: Wie geht man mit der Tatsache um, dass es kaum noch Experten für Arzneimittel gibt, die kein Geld von irgendeinem Arzneimittelhersteller für mehr oder weniger seriöse Leistungen erhalten haben oder erhalten? Reicht die Verpflichtung zu DOIs wirklich aus oder muss man nicht auch noch die uneingeschränkte Veröffentlichungspflicht solcher Erklärungen vereinbaren? Sollen und können Experten mit INteressenskonflikten überhaupt in ein Entscheidungsgremium berufen werden dürfen und dort verbindliche Richtlinien beeinflussen dürfen?
• Den langen Reigen der WHO-kritischen Äußerungen und Untersuchungen vervollständigte schließlich der Europarat-/PACE-Ausschuss, der auch noch am 3. Juni 2010 seinen vorläufigen Bericht zum Umgang der WHO mit der H1N1-Pandemie veröffentlichte. Die WHO-Politik habe zu einer einer "Verschwendung großer Summen öffentlicher Gelder, unbegründeter Ängste und Befürchtungen über die Gesundheitsgefahren für die europäische Bevölkerung" geführt. Eine Pandemie, die "eigentlich nie eine solche war" habe eine "Placebobehandlung in großem Umfang" ausgelöst.
In dem verabschiedeten Text stellt der Ausschuss "schwere Mängel" in Bezug auf die Transparenz im Entscheidungsprozess über den Ausbruch [der Pandemie] fest, was zu der Frage über den Einfluss der Pharmazeutischen Industrie auf die getroffenen Entscheidungen führt. Stark rückläufiges Vertrauen in den Rat der für die öffentliche Gesundheit verantwortlichen Institutionen könnte sich im Falle einer ernsten künftigen Pandemie als "katastrophal" erweisen, warnt der Bericht.
Der Ausschuss legt außerdem eine Reihe dringender Empfehlungen für größere Transparenz und bessere Regierungsführung in der öffentlichen Gesundheit dar sowie Garantien für das, was er "unzulässige Einflussnahme durch Interessengruppen" nennt. Auch fordert er einen öffentlichen Fonds für die Unterstützung unabhängiger Forschung, Studien und Expertenratschläge, möglicherweise durch einen Pflichtbeitrag der Pharmazeutischen Industrie finanziert sowie eine engere Zusammenarbeit mit den Medien, um "Sensationsgier und Panikmache im Bereich der öffentlichen Gesundheit zu vermeiden". Eine Debatte des Berichtes durch die Parlamentarier aller 47 Mitgliedstaaten des Europarates ist für den 24. Juni 2010 auf der Sommersitzung der PACE in Straßburg vorgesehen.
• Ob Mitgliedsländer des Europarats, die zugleich WHO-Mitglieder sind, darüber nachdenken, sowohl den Rücktritt der Generaldirektorin zu fordern und Änderungen an der Transparenzvorstellung der WHO einzufordern, ist bisher öffentlich nicht bekannt.
Die Äußerungen Wolfgang Wodargs und Auszüge aus der Januar-Resolution der PACE finden sich hier.
Das Feature "Conflicts of Interest. WHO and the pandemic flu "conspiracies" von Deborah Cohen und Philip Carter aus der BMJ-Ausgabe vom 3. Juni 2010 (BMJ 2010;340:c2912) ist komplett kostenlos erhältlich und ein Lektüre-Muss für jeden an Public Health interessierten Menschen.
Auch die "provisional version" des Berichtes "The handling of the H1N1 pandemic: more transparency needed" des "Social Health and Family Affairs Committee" des Europarats und des Berichterstatters Mr Paul Flynn ist komplett kostenlos zugänglich.
Schließlich kann man auch einen der wichtigen Texte der ja auch immer noch aktuellen Tamiflu-Debatte komplett und kostenlos erhalten. Es handelt sich dabei um den Aufsatz "Neuraminidase inhibitors for preventing and treating influenza in healthy adults: systematic review and metaanalysis" von Tom Jefferson, Mark Jones, Peter Doshi, und Chris Del Mar (alles Mitglieder der "Cochrane Acute Respiratory Infections Group" aus dem BMJ 2009;339:b5106.
Dessen Zusammenfassung lautet: "Neuraminidase inhibitors have modest effectiveness against the symptoms of influenza in otherwise healthy adults. The drugs are effective postexposure against laboratory confirmed influenza, but this is a small component of influenza-like illness, so for this outcome neuraminidase inhibitors are not effective. Neuraminidase inhibitors might be regarded as optional for reducing the symptoms of seasonal influenza. Paucity of good data has undermined previous findings for oseltamivir's prevention of complications from influenza. Independent randomised trials to resolve these uncertainties are needed."
Bernard Braun, 6.6.10
Ärzte und Pharmavertreter - eine verhängnisvolle Affäre
 Drei von vier Ärzten gehen davon aus, dass Pharmavertreter sie darin beeinflussen wollen, welche Medikamente sie verschreiben. Über 90% halten sich für völlig oder weitgehend immun gegenüber den Beeinflussungsversuchen - 9% der Befragten glauben, überhaupt nicht beeinflussbar zu sein, weitere 83% geben an, nur selten oder gelegentlich beeinflusst zu werden. Ihre Kollegen betrachten die Ärzte jedoch als beeinflussungsgefährdet: 21% glauben, dass diese den Beeinflussungsversuchen der Pharmavertreter häufig oder immer erliegen.
Drei von vier Ärzten gehen davon aus, dass Pharmavertreter sie darin beeinflussen wollen, welche Medikamente sie verschreiben. Über 90% halten sich für völlig oder weitgehend immun gegenüber den Beeinflussungsversuchen - 9% der Befragten glauben, überhaupt nicht beeinflussbar zu sein, weitere 83% geben an, nur selten oder gelegentlich beeinflusst zu werden. Ihre Kollegen betrachten die Ärzte jedoch als beeinflussungsgefährdet: 21% glauben, dass diese den Beeinflussungsversuchen der Pharmavertreter häufig oder immer erliegen.
Zu diesen und weiteren Ergebnissen gelangen Klaus Lieb und Simone Brandtönies in einer heute im Deutschen Ärzteblatt erschienen Studie. Die Ergebnisse beruhen auf einer Befragung von Fachärzten für Neurologie/Psychiatrie, Allgemeinmedizin und Kardiologie - den Facharztgruppen mit den höchsten Kosten für Arzneimittelverordnungen pro Arzt. Die Befragung wurde 2008 durchgeführt und bezieht sich auf das Jahr 2007.
Diese deutsche Studie bestätigt die Ergebnisse angloamerikanischer Studien: Ärzte meinen von sich selbst, nicht beeinflussbar zu sein, sehen das Problem aber bei ihren Kollegen. Nicht bekannt ist den Befragten offensichtlich, dass die Beeinflussung unbewusst erfolgt ("Marketing für Medikamente wirkt - selbst in subtiler Dosis").
Der Kontakt zwischen Industrie und Ärzten mittels der Vertreter funktioniert bestens. 77% der Befragten lassen sich mindestens 1x pro Woche besuchen, fast jeder 5. erhält täglich Besuch.
Fast die Hälfte der Befragten fühlt sich häufig oder immer adäquat und korrekt von den Pharmavertretern informiert, lediglich 15% selten oder nie. Dies erstaunt, denn bezüglich der Objektivität von Informationsquellen erhalten Pharmavertreter mit 4 die schlechteste (Schul-)Note. Pharmafinanzierten Fortbildungen geben Ärzte die Note 3, unabhängigen Fortbildungen 1,9 und Fachbüchern als am besten bewertete Quelle 1,8.
Die Mehrheit nimmt regelmäßig Geschenke an, und zwar im Durchschnitt pro Jahr: Arzneimuster 66 x, Schreibwaren 34 x, Kalender 9 x. Lediglich 4% nehmen keinerlei Geschenke an.
Durchschnittlich nahmen die Ärzte an 6,3 unabhängigen und 5,2 pharmafinanzierten Fortbildungen teil. Bei mehr als 2/3 der pharmafinanzierten Fortbildungen gab es kostenloses Essen, bei etwa einem Viertel kostenlose Übernachtung und Übernahme der Reisekosten.
43% führten 2007 mindestens eine Anwendungsbeobachtung durch, jeder 5. mehr als drei. Anwendungsbeobachtungen sind Studien, die anerkanntermaßen mehr dem Marketing als dem Wissensgewinn dienen ("Einflussnahme der Pharma-Industrie auf Medikamentenverschreibungen"".
Fazit der Autoren: "Eine kritischere Haltung der Ärzte gegenüber den Einflussversuchen der pharmazeutischen Unternehmen und die aktive Förderung alternativer Informationsangebote könnten zu mehr Unabhängigkeit und zu einer rationaleren und möglicherweise günstigeren Arzneimitteltherapie führen."
Diese Studie erweitert das Wissen um die Beeinflussung der Ärzte durch die Industrie. Erst kürzlich hatte das Deutsche Ärzteblatt eine Studie über die Beeinflussung der Ärzte durch manipulierte Studien veröffentlicht (wir berichteten).
Die unkritische Haltung vieler Ärzte mag auf den ersten Blick verwundern. Dahinter steht ein hochsystematisches und wissenschaftlich begründetes Vorgehen der Industrie. Sie lässt ihre Vertreter Beziehungen zu den Ärzten aufbauen, die von diesen als freundschaftlich wahrgenommen werden und wenden durch kleine und größere Geschenke die Reziprozitätsregel an, derzufolge man sich für Gefälligkeiten, Geschenke, Einladungen und dergleichen zu revanchieren hat (s.a. "Warum uneingeschränkte Transparenz in Interessenregistern und Ablehnung jedes Vorteils ein Muss für die ärztliche Profession ist").
Ein Aufsatz und ein Buch geben tiefe Einblicke in die Vorgehensweisen der Pharmavertreter:
Fugh-Berman A, Ahari S. Following the Script: How Drug Reps Make Friends and Influence Doctors. PLoS Medicine 2007;4(4):e150}
Williams J. Insider's Guide to the World of Pharmaceutical Sales, 9th Edition. 9th ed: Principle Publications, 2008. Dieses Buch wurde vor kurzem im Deutschen Ärzteblatt besprochen. Downnload
Die Ergebnisse der Überzeugungsbemühungen der pharmazeutischen Industrie sind nirgendwo besser dokumentiert als in den Umsatzzahlen.
So darf es sich die Industrie als "Erfolg" anrechnen, dass sich unter den 15 umsatzstärksten Medikamenten in Deutschland im Jahr 2007 nur 2 befinden, die nach Bewertung des Pharma-unabhängigen arznei-telegramm als Mittel der Wahl für das jeweilige Krankheitsbild darstellen. Unter den übrigen 13 sind 6 Varianten ohne besonderen Stellenwert (Scheininnovationen / Me-too-Präparate), 5 Medikament mit umstrittenem Therapieprinzip sowie 2 Medikamente die als Mittel der Reserve gelten.
Viele Ärzte verlieren offensichtlich unter dem Einfluss der Pharmavertreter die Fähigkeit zur medizinisch rationalen Verschreibung von Arzneimitteln.
Einen wahren Triumph des Marketings stellt der von der Firma Pfizer vertriebene Blutfettsenker LIPITOR® (in Deutschland SORTIS®) dar, das mit 13,3 Mrd. Dollar im Jahr 2009 weltweit umsatzstärkste Medikament (Quelle: IMS Health). Die Substanz Atorvastatin weist keinerlei Vorteile auf im Vergleich zur Standardsubstanz Simvastatin, ist jedoch in Deutschland um den Faktor 3 bis 4 teurer.
Wie Pfizer Patienten in den USA Lipitor® durch Werbung schmackhaft macht, zeigt diese Website www.lipitor.com ebenso wie die in den USA zulässige Direktwerbung im Fernsehen. Auf www.youtube.com wird man bei Eingabe von Lipitor fündig, hier ein Beispiel und hier noch eins.
Lieb K, Brandtönies S. Eine Befragung niedergelassener Fachärzte zum Umgang mit Pharmavertretern. Dtsch Arztebl 2010;107(22):392-8. Download
David Klemperer, 4.6.10
AWMF spricht Empfehlungen zum Umgang mit Interessenkonflikten bei Fachgesellschaften aus
 "Die Bedeutung von Interessenkonflikten und die Notwendigkeit, diese offen darzulegen und bei Entscheidungen zu berücksichtigen, sind zunehmend in den Fokus öffentlicher Diskussion gerückt," erklärt die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) in einer kürzlich veröffentlichten Empfehlung.
"Die Bedeutung von Interessenkonflikten und die Notwendigkeit, diese offen darzulegen und bei Entscheidungen zu berücksichtigen, sind zunehmend in den Fokus öffentlicher Diskussion gerückt," erklärt die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) in einer kürzlich veröffentlichten Empfehlung.
Die AWMF vertritt derzeit 154 medizinische Fachgesellschaften und erarbeitet Empfehlungen und Stellungnahmen in grundsätzlichen und fachübergreifenden Angelegenheiten und Aufgaben der Fachgesellschaften. In der Erstellung von Leitlinien für Diagnostik und Therapie spielt die AWMF in Deutschland eine führende Rolle.
Die Empfehlungen verfolgen die Ziele, "die Integrität der professionellen Urteilsfähigkeit zu schützen und das Vertrauen der Öffentlichkeit zu bewahren". Inhaltlich stützen sich die Empfehlungen explizit auf den 2009 erschienen Bericht des Institute of Medicine Conflict of Interest in Medical Research, Education, and Practice.
Drei Bereiche werden angesprochen:
• Publikationen in Fachgesellschaftsorganen
Autoren sollen Interessenkonflikte offenlegen. Für Inhalt und Form der Offenlegung wird auf die Empfehlungen des Institute of Medicine verwiesen und auf die Anforderungen des International Committee of Medical Journal Editors.
• Fachgesellschaftskongresse
Die Kongresse vieler (nicht aller) Fachgesellschaften werden von der Industrie unterstützt. Die AWMF empfiehlt, die Kongresse einschließlich des Finanzierungssystems so zu gestalten, dass sie "von der Industrie weitestgehend unbeeinflusst sind, das öffentliche Vertrauen in die Integrität der Fachgesellschaften verstärken und ein Fort- und Weiterbildungsprogramm von hoher Qualität anbieten". Falls eine Finanzierung über die Industrie erfolgt, solle diese detailliert und standardisiert offengelegt werden.
• Leitlinienentwicklung
Das AWMF-Regelwerk zur Erstellung von Leitlinien sieht vor, dass alle an der Entwicklung von Leitlinien beteiligten Personen ihre etwaigen Interessenkonflikte auf einem Formblatt erklären. Darin sind u.a. Berater- bzw. Gutachtertätigkeit, Vortragstätigkeit, Forschungsförderung, Eigentümerinteressen (z.B. an Patenten) und Besitz von Geschäftsabteilen für die vergangenen 3 Jahre anzugeben. Mitwirkende mit Interessenkonflikten, die aufgrund der Fachgesellschaften bzw. anderer Organisationen oder durch das Lenkungsgremien als befangen bewertet wurden, sollen laut Regelwerk nicht an der Bewertung der Evidenzen und der Konsensfindung mitwirken. Die Interessenkonfliktserklärungen sind im sind Leitlinienreport zu veröffentlichen.
Lange Zeit fand das Thema Interessenkonflikte im Gesundheitswesen in Deutschland wenig Beachtung. In den letzten Jahren hat sich jedoch ein Wandel vollzogen. Die AWMF hat mit ihren Empfehlungen einen wichtigen ersten Schritt getan und sich zum Thema Interessenkonflikte klar positioniert. Inwieweit die Empfehlungen von den 154 Fachgesellschaften umgesetzt werden, wird die Zukunft zeigen. Möglicherweise sind in einem zweiten Schritt die Empfehlungen konkreter zu fassen, zu erweitern und mit Sanktionsmöglichkeiten zu versehen.
Empfehlungen der AWMF zum Umgang mit Interessenkonflikten bei Fachgesellschaften. Download
Lo B, Marilyn J. Field, Committee on Conflict of Interest in Medical Research EaP, Policy BoHS, (IOM) IoM. Conflict of Interest in Medical Research, Education, and Practice. Washington D.C., 2009. im Forum Gesundheitspolitik
Erklärung über einen Interessenkonflikt: Als Mitglied der Arbeitsgruppe, welche die AWF-Empfehlung verfasst hat, ist meine Beurteilung möglicherweise verzerrt. Die Mitarbeit war ehrenamtlich.
David Klemperer, 4.6.10
Unabhängige Arzneimittelforschung in Italien
 Die Erforschung von Arzneimitteln erfolgt überwiegend durch die pharmazeutische Industrie. Die Forschungsfragen der Industrie stehen weitgehend im Zusammenhang Gewinnerwartungen (siehe Beitrag im Forum).
Die Erforschung von Arzneimitteln erfolgt überwiegend durch die pharmazeutische Industrie. Die Forschungsfragen der Industrie stehen weitgehend im Zusammenhang Gewinnerwartungen (siehe Beitrag im Forum).
Öffentliche Förderung für nicht-kommerzielle Fragestellungen erfolgt bisher nicht annähernd im erforderlichen Umfang. Italien zeigt, dass es auch anders geht. Dort wurde die unabhängige Arzneimittelforschung im Jahr 2004 gesetzlich geregelt. Die Federführung hat die Arzneimittelbehörde Agenzia Italiana del Farmaco (AIFA) erhalten.
Das im Jahr 2005 gestartete unabhängige Arzneimittelforschungsprogramm (Website des Programms) wird das Programm durch einen Beitrag der pharmazeutischen Industrie finanziert. Alle Firmen zahlen 5% ihrer jährlichen Ausgaben für Werbung in einen nationalen Fonds. Zugrunde gelegt werden Werbemaßnahmen wie Geschenke, Anzeigen, Werbematerialien, Seminare, Kongresse, nicht jedoch die Gehälter der Pharmavertreter. Auf diese Weise flossen in den ersten drei Jahren (2005 bis 2007) jeweils etwa 45 Mio. Euro in den Fonds. Die Hälfte des Betrages dient der unabhängigen Forschung, mit der anderen Hälfte werden Arzneimittel zur Behandlung seltener Krankheiten (orphan drugs) finanziert.
Es erfolgt eine jährliche Ausschreibung für drei Bereiche:
•Arzneimittel für seltene Krankheiten
•vergleichende Studien (Head-to-head-Studien) - z.B. Untersuchung des Nutzen-Schaden-Profils von Arzneimitteln im direkten Vergleich in randomisierten kontrollierten Studien
•Angemessenheit des Gebrauchs, Pharmakovigilanz und Outcome-Forschung - Post Marketing Studien, Patientenedukation, systematische Übersichtsarbeiten (seit 2007)
Folgende Bedingungen gelten für die Förderung:
•Die Forscher müssen vollständige Kontrolle über das Studiendesign und die Durchführung der Studie haben (z.B. Studienprotokoll, Datenanalyse, Berichten der Ergebnisse).
•Die Ergebnisse müssen vollständig veröffentlicht werden.
•Die Studie darf nicht Teil des Zulassungsverfahrens sein.
Von 2005 bis 2007 wurden 1217 Anträge gestellt. Die Auswahl trifft eine international besetzte Kommission.
Letztlich wurden 151 Studien mit insgesamt 78 Mio. Euro gefördert:
•Experimentelle klinische Studien (114; 75%)
•Beobachtungsstudien (19, 13%)
•Edukative Interventionen (13, 9%)
•Systematische Übersichtsarbeiten (5; 3% - seit 2007)
Im frei zugänglichen Volltext des Aufsatzes werden eine Reihe geförderter Studien beschrieben.
Ihre Erfahrungen zusammenfassend stellen die Autoren fest, dass Geld eine notwendige aber nicht hinreichende Bedingung für unabhängige, an patientenrelevanten Fragestellungen ausgerichtete Forschung ist. Dies zeige sich in der geringen Zahl von Anträgen in einigen Fachgebieten - erwähnt werden hier Orthopädie und Anästhesie - und der teil unzureichenden Qualität von Anträgen. Erforderlich sei es, die unabhängige Arzneimittelforschung quantitativ und qualitativ zu verbessern. Gemeinschaftliche Anstrengungen auf europäischer Ebene seien wünschenswert.
Das Büro für Technikfolgenagschätzung hat die Rahmenbedingungen für unabhängige Arzneimittelforschung in einem Bericht für den Bundestag aufgearbeitet, der im Moment vom Bundestag bewertet wird und dann veröffentlicht werden soll.
Italian Medicines Agency Research & Development Working Group. Feasibility and challenges of independent research on drugs: the Italian Medicines Agency (AIFA) experience. Eur J Clin Invest 2010;40(1):69-6 Download Volltext
Biomedizinische Forschung überwiegend von finanziellen Gewinnerwartungen motiviert. Beitrag im Forum Gesundheitspolitik vom 12.2.2010 über die Studie von Dorsey et al. Funding of US Biomedical Research, 2003-2008. JAMA 2010;303(2):137-1. Abstract der Studie
Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag (TAB).
Klinische Forschungen in Deutschland unter besonderer Berücksichtigung nichtkommerzieller Studien. Website
David Klemperer, 13.5.10
Transparenz ist notwendig, damit die Industrie nicht auch in den nächsten drei Jahrzehnten manipuliert
 Die Versuchung durch Manipulation Studienergebnisse zu schönen, scheint übermächtig zu sein. Dies ist nachvollziehbar - vom Ausgang einer Arzneimittelstudie kann es abhängen, ob die untersuchte Substanz Milliardenumsätze erzielt oder auf dem Müllhaufen landet.
Die Versuchung durch Manipulation Studienergebnisse zu schönen, scheint übermächtig zu sein. Dies ist nachvollziehbar - vom Ausgang einer Arzneimittelstudie kann es abhängen, ob die untersuchte Substanz Milliardenumsätze erzielt oder auf dem Müllhaufen landet.
Eine kürzlich im Deutschen Ärzteblatt veröffentlichte systematische Übersichtsarbeit von Gisela Schott und weiteren Mitgliedern der Arzneimittelkommission der Deutsche Ärzteschaft belegt, dass die Industrie auch in der jüngeren Vergangenheit nicht widerstehen konnte. Erfasst und zusammengefasst wurden Studien von November 2002 bis Dezember 2009. Die Autoren knüpfen an die gleichartige systematische Übersichtsarbeit von Bekelman et al., die den Zeitraum von 1980 bis 2002 untersuchte und zu vergleichbaren Ergebnissen gelangte.
Somit ist festzustellen, dass seit 1980 bis heute Arzneimittelstudien, die von der Industrie finanziert werden oder bei denen ein Autor finanzielle Interessenkonflikte hat, durch Manipulationen häufiger zu positiven Ergebnisse gelangen, als anderweitig finanzierte Studien. Erwähnenswert ist der Sachverhalt, dass die Studie von Schott et al. von der Bundesärztekammer finanziert wurde.
In einem Editorial ("Arzneimittelforschung: Marketing vor Evidenz, Umsatz vor Sicherheit") im Deutschen Ärzteblatt stellt der Autor dieses Beitrags fest, dass sich die Arzneimittelforschung in einer Schieflage befinde. Pharmazeutische Firmen ließen Ärzte und Patienten häufig im Unklaren über die wahren Wirkungen ihrer Produkte - die Wissensgrundlage und Patienten Behandlungsentscheidungen treffen sei häufig verfälscht. Große pharmazeutische Firmen hätten in zahlreichen, durch interne Dokumente und Unterlagen gut dokumentierten Fällen die Evidenz verbogen, bis sie für das Marketing tauglich war.
Die Methoden, mit denen Studien manipuliert werden können, sind bekannt. In unserer Rubrik "Einflussnahme der Pharmaindustrie" berichten wir fortlaufend darüber. In jeder Phase der Untersuchung kann manipulativ auf das Ergebnis Einfluss genommen werden. Die Ergebnisse sind u.a. abhängig von der Fragestellung, der Studienpopulation, der Art und der Dosierung der Vergleichssubstanz, der Studiendauer. Häufig werden die Erfolgskriterien im Nachhinein verändert. Studien mit unpassenden Ergebnissen werden gar nicht veröffentlicht oder unpassende Ergebnisse innerhalb von Studien nicht veröffentlicht oder als positiv uminterpretiert. Der Zynismus, mit dem manche Industrievertreter hier vorgehen, ist durch die zwangsweise Veröffentlichung interner Dokumente im Rahmen von Gerichtsverfahren gut dokumentiert. Als Lektüre sei hier die Arbeit von Spielmans und Parry empfohlen.
Bislang müssen die Unterlagen, die zur Beurteilung einer Studie notwendig sind, nicht veröffentlicht werden. Dies ist eine notwendige Voraussetzung für Manipulationen. Studienregister sind zwar ein wichtiges Mittel gegen die Nicht-Veröffentlichung von Studien. Weitergehende Informationen, die erst eine umfassende Beurteilung einer Studie erlauben, sind im Studienplan und im Studienprotokoll enthalten. Deren frühzeitige Veröffentlichung - noch vor Beginn der Studie - würde die Betrugsmöglichkeiten entscheidend mindern. Uneingeschränkte Transparenz ist daher - das probate Gegenmittel und die an die Politik zu stellende Forderung. Darüber hinaus ist eine vermehrte öffentliche Studienfinanzierung erforderlich, schon allein weil die Industrie viele wichtige Fragen nicht untersucht. Hier ein Bericht über das italienische Modell der unabhängigen Studienfinanzierung.
Deutsches Ärzteblatt
Systematische Übersichtsarbeit zur Finanzierung von Arzneimittelstudien durch pharmazeutische Unternehmen
23.4.2010 Teil 1
Qualitative systematische Literaturübersicht zum Einfluss auf Studienergebnisse, -protokoll und -qualität
30.4.2010 Teil 2
Qualitative systematische Literaturübersicht zum Einfluss auf Autorschaft, Zugang zu Studiendaten sowie auf Studienregistrierung und Publikation
23.4.2010
Editorial. Arzneimittelforschung: Marketing vor Evidenz, Umsatz vor Sicherheit
Reaktionen auf die Studie von Schott et al. und das Editorial im Blog sozmad
Bekelman JE, Li Y, Gross CP. Scope and Impact of Financial Conflicts of Interest in Biomedical Research: A Systematic Review. Journal of the American Medical Association 2003;289(4):454-65. Download
Spielmans G, Parry P. From Evidence-based Medicine to Marketing-based Medicine: Evidence from Internal Industry Documents. Journal of Bioethical Inquiry 2010;7(1):13-29. Download, Beitrag im Forum Gesundheitspolitik.
David Klemperer, 11.5.10
Eher lau: Verhaltenskodex amerikanischer Fachgesellschaften für die Zusammenarbeit mit der Industrie
 Am 21. April 2010 hat der Council of Medical Specialty Societies (CMSS) einen Verhaltenskodex für die Beziehungen zur Industrie veröffenlicht. Im CMSS sind 32 Fachgesellschaften mit 650.000 Ärzten vertreten.
Am 21. April 2010 hat der Council of Medical Specialty Societies (CMSS) einen Verhaltenskodex für die Beziehungen zur Industrie veröffenlicht. Im CMSS sind 32 Fachgesellschaften mit 650.000 Ärzten vertreten.
Dieser Verhaltenskodex dürfte eine Reaktion auf den Report "Conflict of Interest in Medical Research, Education, and Practice" des Institute of Medicine vom Mai 2009 sein (wir berichteten).
Die Grundsätze beziehen sich auf 10 Bereiche:
• Unabhängigkeit
• Transparenz
• Annahme von Geschenken
• Sponsoring
• Fachgesellschaftstreffen (Fortbildung, Satellitensymposien, Industrieausstellungen)
• Forschungsfinanzierung
• Klinische Leitlinien
• Fachzeitschriften
• Standards für Werbeanzeigen
• Standards für die Lizenzierung von Produkten
Auffällig sind die fast durchgehend weichen Formulierungen, die einer Überprüfung kaum zugänglich sein dürften.
So heißt es zum Grundsatz der Unabhängigkeit: "Die Fachgesellschaften entwickeln alle Fortbildungsaktivitäten, wissenschaftlichen Programme, Produkte, Dienstleistungen und Stellungnahmen unabhängig vom Einfluss der Industrie und sie entwickeln Vorgehensweisen zur Förderung der Unabhängigkeit."
Bezüglich der Verwendung von Spenden darf die Industrie den Fachgesellschaften Vorgaben machen, die "angemessen" sind.
Zuwendungen der Industrie zur Fortbildung sind zulässig, nur soll dem Sponsor keine Möglichkeit gegeben werden, Einfluss auf die Fortbildungsaktivität zu nehmen. Gut überprüfbar ist die Forderung, dass Vortragsfolien kein Logo einer Firma enthalten dürfen - weniger gut hingegen, ob das Logo vielleicht einfach nur gelöscht wurde.
Die als pure Marketingaktivität bekannten Satelliten-Symposien im Rahmen von Fachgesellschaftskongressen sollten nicht etwa untersagt werden, vielmehr sollen sie "evidenzbasiert" und von einem Gutachter geprüft sein, der darin geübt ist Bias (Verzerrungen) zu erkennen.
Ähnlich unverbindlich geht es bei auch bei der Forschungsförderung und den Leitlinien zu.
Positiv ist zu vermerken, dass die Pflicht zur Offenlegung von Interessenkonflikten weitgehend ist und Vorstandsmitglieder von Fachgesellschaften keine finanziellen Verbindungen zur Industrie haben sollen.
Insgesamt fällt dieser Kodex aber weit hinter die Empfehlungen des Institute of Medicine zurück.
Darin war beispielsweise das Verbot der Annahme jeglicher Geschenke sowie ein Industrie-unabhängiges System der Finanzierung von Fortbildung gefordert worden.
Für die Deutschen Fachgesellschaften wird die Arbeitsgemeinschaft wissenschaftlich-medizinischer Fachgesellschaften am 24. April ein erstes Grundsatzpapier zum Umgang mit Interessenkonflikten bei Fachgesellschaften verabschieden. Darin werden Empfehlungen zu Publikationen in Fachgesellschaftsorganen, zu Fachgesellschaftskongressen und zur Leitlinienentwicklung enthalten sein. Wir werden darüber berichten.
Council of Medial Specialty Societies (CMSS).
Code for Interactions with Companies
Pressemitteilung
Website IOM-Report "Conflict of Interest in Medical Research, Education, and Practice
David Klemperer, 22.4.10
Lehrstück "Rosiglitazone und Herzinfarktrisiko" zum Zweiten - Assoziation von finanziellen Interessenskonflikten und Bewertung.
 Über das lange vom Hersteller GlaxoSmithKline (GSK) totgeschwiegene aber schließlich doch öffentlich gewordene gesundheitliche Risiko (Herzinfarkt) des zur Behandlung von Diabeteskranken eingesetzten Wirkstoffs Rosiglitazone wurde hier bereits ausführlich berichtet. Wie dieses Verschweigen oder auch die Umdeutung von Wirklichkeiten abläuft und wer neben dem Hersteller mit welchen Methoden der Verbreitung der Wahrheit aktiv im Wege steht, dokumentiert jetzt ein systematischer Querschnitts-Review über mögliche Zusammenhänge zwischen finanziellen Interessen von publizierenden Wissenschaftlern und ihrer Position zu der Assoziation des Risikos eines Herzinfarkts und der Einnahme von Rosiglitazone im renommierten "British Medical Journal (BMJ)".
Über das lange vom Hersteller GlaxoSmithKline (GSK) totgeschwiegene aber schließlich doch öffentlich gewordene gesundheitliche Risiko (Herzinfarkt) des zur Behandlung von Diabeteskranken eingesetzten Wirkstoffs Rosiglitazone wurde hier bereits ausführlich berichtet. Wie dieses Verschweigen oder auch die Umdeutung von Wirklichkeiten abläuft und wer neben dem Hersteller mit welchen Methoden der Verbreitung der Wahrheit aktiv im Wege steht, dokumentiert jetzt ein systematischer Querschnitts-Review über mögliche Zusammenhänge zwischen finanziellen Interessen von publizierenden Wissenschaftlern und ihrer Position zu der Assoziation des Risikos eines Herzinfarkts und der Einnahme von Rosiglitazone im renommierten "British Medical Journal (BMJ)".
Die 202 Artikel, die sich bis zum April 2009 mit diesem Zusammenhang befassten, wurden danach klassifiziert, ob sie ausdrücklich und entschieden kein Risiko sahen (17% con 180 einzelnen AutorInnen), sich neutral verhielten (47% von den 180) oder dieses Risiko eindeutig benannten (36% von den 180). Jedem Aufsatz wurden alle veröffentlichten Kenntnisse über finanzielle Interessen der AutorInnen hinzugefügt, die sie selber in diesem und vorherigen Aufsätzen angegeben hatten. Die Reviewer, welche die Aufsätze klassifizierten wussten nichts von den AutorInnen oder ihren finanziellen Interessen.
Die Ergebnisse waren eindeutig und unerfreulich:
• Zunächst gab es lediglich in 53% der Aufsätze (108 Autoren) eine Erklärung über mögliche Interessenkonflikte. Nach der bisherigen Erkenntnisse über Interessenkonflikte müsste eigentlich jeder Autor daran interessiert sein, den Verdacht, etwas zu verschweigen, durch derartige Angaben zu entkräften - sofern dies möglich ist!!
• 90 Autoren oder 45% aller AutorInnen hatten nach ihren eigenen Angaben einen finanziellen Konflikt, d.h. z.B. von der Firma GSK oder einer anderen Pharmafirma Geld erhalten. 69% gaben dies bei dem speziellen Aufsatz an und beim Rest konnte dies nur durch weitere Recherchen in Erfahrung gebracht werden. Dies bedeutet, dass nur 18 AutorInnen, die Angaben machten, positiv sagten, sie hätten keine finanziellen Konflikte. Etwas spitzer formuliert könnte man aber auch sagen, dass nur rund 9% aller zum Thema Rosiglitazone publizierenden AutorInnen nach ihren eigenen Angaben ausdrücklich keine finanziellen Konflikte haben, die sich möglicherweise auf ihre Ergebnisse und Bewertungen auswirken könnten.
• Die Chance (Wahrscheinlichkeit), dass AutorInnen kein Risiko eines Herzinfarkts "feststellten" oder erwarteten war bei denjenigen von ihnen, die finanzielle Interessenkonflikte durch Beziehungen zu einem Hersteller von blutzuckersenkenden Arzneimitteln angaben, 3,4fach so hoch wie bei Autoren, die diese Konflikte nicht angaben. Hatten die Verfasser finanziellen Kontakt zu einem Hersteller des Wirkstoffs Rosiglitazone war die Chance eines "favourable view" auf die Wirkung sogar 4,3fach höher. Auch die Chance, die Arzneimittel mit diesem Wirkstoff sogar ausdrücklich zu empfehlen, war bei den AutorInnen mit finanziellen Konflikten der genannten Art um knapp das 4,7fache erhöht. Diese Tendenz verstärkte sich sogar noch in Meinungsartikeln (6,29fache) und in Artikeln, die sich gezielt auf die Kontroverse konzentrierten (6,5fache). Selbst als die us-amerikanische "Food and Drug Administration (FDA)" die ersten Sicherheitswarnungen zu Rosiglitazone veröffentlichte, sahen AutorInnen mit finanziellen Konflikten Rosiglitazone um das 3- bis 4fache positiver als ihre KollegInnen ohne derartige Konflikte.
• Wenn der Analyse nicht Autoren, sondern Aufsätze zugrundegelegt wurden, waren 86% der Artikel, die kein Risiko sahen, von AutorInnen geschrieben, die einen finanziellen Kontakt oder Konflikt mit GSK angegeben hatten. Dies war nur bei den AutorInnen von 18% aller Aufsätze der Fall, in denen das genannte Risiko für gesichert hielten.
Die Methodik des Reviews erlaubt zwar nicht, von einem kausalen Zusammenhang von finanziellen Interessen und Konflikten und der Bewertung des Nebenwirkungsrisikos von Rosiglitazone zu sprechen. Trotzdem ist den Verfassern zuzustimmen, dass sowohl der Anteil der AutorInnen, die keinerlei Angaben zu möglichen Interessenskonflikten machen, drastisch gesenkt werden muss als auch eine formelle Datenbasis für Interessenskonflikte geschaffen werden sollte. Nicht jedem Interessierten ist schließlich eine aufwändige Recherche in PubMed, Scopus oder Google zuzumuten.
Vielleicht ist es auch notwendig, deutlicher als bisher der Seriosität und Interessenkonfliktfreiheit von Ergebnissen aus Veröffentlichungen zu misstrauen, wenn keine Angabe zu möglichen Interessenkonflikten gemacht werden!?
Der Aufsatz "Association between industry affiliation and position on cardiovascular risk with rosiglitazone: cross sectional systematic review von
Amy T Wang, Christopher P McCoy, Mohammad Hassan Murad und Victor M Montori ist am 18.3.2010 online im "British Medical Journal" (BMJ 2010;340:c1344) veröffentlicht worden und komplett kostenlos erhältlich.
Bernard Braun, 20.4.10
Täuschen, leugnen, desinformieren und einschüchtern - Strategien von GlaxoSmithKline zur Vermarktung ihres Diabetes-Blockbusters
 In seinem am 26. März 2010 publizierten programmatischen Papier "Eckpunkte zur Umsetzung des Koalitionsvertrags für die Arzneimittelversorgung" spielen Studien und Nutzenbewertungen, welche die Pharmaunternehmen vorlegen müssen, wenn sie ein Medikament mit hohem Preis oder angeblichen hohen Zusatznutzen auf den Markt bringen wollen, eine wichtige Rolle. Deren Ergebnisse können, so das Bundesgesundheitsministerium, vom Gemeinsamen Bundesausschuss und dem Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen überprüft werden und innerhalb eines Zeitraums zwischen drei Monaten und maximal drei Jahren zu praktischen Entscheidungen über den Nutzen und den Preis des Arzneimittels führen.
In seinem am 26. März 2010 publizierten programmatischen Papier "Eckpunkte zur Umsetzung des Koalitionsvertrags für die Arzneimittelversorgung" spielen Studien und Nutzenbewertungen, welche die Pharmaunternehmen vorlegen müssen, wenn sie ein Medikament mit hohem Preis oder angeblichen hohen Zusatznutzen auf den Markt bringen wollen, eine wichtige Rolle. Deren Ergebnisse können, so das Bundesgesundheitsministerium, vom Gemeinsamen Bundesausschuss und dem Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen überprüft werden und innerhalb eines Zeitraums zwischen drei Monaten und maximal drei Jahren zu praktischen Entscheidungen über den Nutzen und den Preis des Arzneimittels führen.
Der Gesundheitsökonom, Mediziner und SPD-Bundestagsabgeordnete Karl Lauterbach hat zu diesem Verfahren festgestellt: "Das wäre so als ob Öko-Test die Energieeffizienz eines Autos auf Basis eines Herstellerberichts bewerten müsste."
Auch wenn Lauterbach hier etwas zu flott und angreifbar den G-BA- und IQWIG-Teil der BMG-Überlegungen unter den Tisch fallen lässt, ist die Vorstellung, die Pharmahersteller würden lammfromm entweder wahrheitsgemäße und vollständige oder verfälschte und tendenziöse, aber leicht als solche durchschaubare Studienergebnisse auf den Tisch des GKV-Spitzenverbands legen, im besten Fall naiv.
Mit welchen Methoden es eine solche "naive" Arzneimittelpolitik wirklich zu tun bekommt, zeigt ein Bericht eines Ausschusses des us-amerikanischen Kongresses über das Verhalten eines der weltgrößten Pharmakonzerne, GlaxoSmithKline (GSK), im Falle des von ihm produzierten Medikaments Avandia mit seinem Wirkstoff Rosiglitazon.
Zu diesem Wirkstoff gibt das Wikipedia-Stichwort zu "Rosiglitazon" folgende Auskünfte:
"Rosiglitazon ist ein Antidiabetikum aus der Gruppe der Insulin-Sensitizer. Es wird bei Diabetes mellitus Typ 2 in Form von Tabletten eingesetzt. Das Wirkprinzip ist eine Erhöhung der Empfindlichkeit des Gewebes auf Insulin. Das körpereigene Insulin ist folglich wieder effektiver in der Lage, erhöhte Blutzuckerspiegel zu senken."
So weit, so gut. Wie es aussieht, wenn man allzu blind den Aussagen der Hersteller und eines Teils der eigentlich zur Kontrolle der Wahrheit ihrer Aussagen gegründeten Experteninstitutionen folgt, zeigt der weitere Wikipediatext zu der aktuell (abgerufen am 28. März 2010) kommunizierten Wirkung: "Bei einer Auswertung von 42 Studien, die im Juni 2007 im New England Journal of Medicine (Nissen/Wolski: Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. In: N Engl J Med. 2007 Jun 14;356(24):2457-71. Epub 2007 May 21.) veröffentlicht wurde, wurde ein um 43% erhöhtes Herzinfarktrisiko beobachtet. Der Hersteller des Medikamentes sowie die Europäische Arzneimittelagentur zweifeln die Aussagekraft der Metastudie jedoch an."
Der in den USA unter dem Markennamen Avandia verkaufte Wirkstoff war mit rund 3 Mrd. US-Dollar Jahresumsatz einer der so genannten "Blockbuster" von GSK.
Der im Januar 2010 veröffentlichte "Staff Report on GlaxoSmithKline and the Diabetes Drug Avandia" gibt auf 342 Seiten einen tiefen Einblick in so ziemlich alle, immer wieder berichteten Mittel der Ignoranz und Nichtweiterverbreitung von Erkenntnissen über eindeutig schädigende oder nutzlose Wirkungen eines Medikaments und die Bereitschaft, zur Manipulation der öffentlichen Wahrnehmung strategisch und systematisch sämtliche legalen, illegalen und unseriösen Mittel anzuwenden. Mit der Lektüre des Berichts und seiner Fülle an dokumentarischen Belegen und Verweisen aus Anhörungen der beteiligten Wissenschaftler und Firmenvertretern, veröffentlichten und bisher unveröffentlichten Firmendokumenten sowie einiger Gespräche mit anonymen "whistleblowers", kann man sich die Lektüre einer Vielzahl anderer Berichte über einzelne der branchenüblichen Methoden ersparen oder wesentlich abkürzen.
Im "executive summary" des US-Kongress-Reports steht in wenigen nüchternen Sätzen, die von Pharmakritikern nicht hätten besser formuliert werden können, die volle Breite dessen was dann danach den Leser erwartet:
"This staff report was developed over the last 2 years by U.S. Senate Committee on Finance investigators who reviewed over 250,000 pages of documents provided by GlaxoSmithKline (GSK/the Company), the Food and Drug Administration (FDA), the University of North Carolina, and others. Committee investigators also conducted numerous interviews and phone calls with GSK, the FDA, and anonymous whistleblowers. Committee staff began this investigation in May 2007 after a study was published in the New England Journal of Medicine, showing a link between the diabetes drug Avandia (rosiglitazone) and heart attacks. However, the reviewed evidence suggests that GSK knew for several years prior to this study that there were possible cardiac risks associated with Avandia. As a result, it can be argued that GSK had a duty to warn patients and the FDA of the Company's concerns. Instead, GSK executives attempted to intimidate independent physicians, focused on strategies to minimize or misrepresent findings that Avandia may increase cardiovascular risk, and sought ways to downplay findings that a competing drug might reduce cardiovascular risk. When an independent scientist sought to publish a study in 2007 pointing out the cardiovascular risk of Avandia, GSK acquired a leaked copy of that study from one of its consultants prior to the study being published. The company's own experts analyzed the study, found it to be statistically reliable, and then attacked the soundness of that study in press releases and public comments. GSK also sought to counter the study's findings by quickly releasing preliminary results from its own study on Avandia, even though the company's internal communications established that its study was not primarily designed to answer questions about cardiovascular risk."
Wer immer noch glaubt, hier handle es sich um einige Ausrutscher von ein paar "schwarzen Schafen" im unteren Management von GSK oder um die unglückliche und zufällige Koinzidenz von für sich betrachtet harmlosen Aktivitäten (so einige der immer wieder zu hörenden Entlastungsargumente) oder wer wenig Zeit hat, der braucht sich eigentlich nur die synoptische "Visual Timeline of public and internal (der Firma GSK) information" für den Zeitraum 2003 bis Mitte 2007 auf der Seite 25 des Reports durchzulesen.
Wer aber auch noch lesen will, dass die Firma aus eigenen Studien bereits im Herbst 2005 und im Sommer 2006 wusste, dass das Risiko einer Herzerkrankung bei Personen, die Avandia einnahmen, signifikant um 29% bzw. 31% über dem der Nichteinnehmer lag, muss die insgesamt nur 15 Seiten Text lesen und von Fall zu Fall in den mehrhundertseitigen Quellenanhang schauen.
Den nun bereits gewonnenen Eindruck kann man mit der Lektüre zweier Beiträge in der Ausgabe der renommierten Fachzeitschrift JAMA vom 24. März 2010 abrunden. Darunter ein Editorial, das sich u.a. mit der Frage beschäftigt, was getan werden muss, um nicht selber Aufsätze zu veröffentlichen, in denen mit kräftiger Unterstützung oder Billigung durch die Arzneimittelhersteller die Unwahrheit oder zumindest nicht die ganze Wahrheit verbreitet wird.
Anlässlich der Veröffentlichung des zitierten Kongress-Reports und weiterer kritischer Analysen zu den Umständen und Methoden, wurde auch öffentlich, zu welchen Methoden auch in einer von GSK finanzierten Studie (RECORD = Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes) gegriffen wurde. Der aktuelle und kostenlos erhältliche Beitrag "Setting the RECORD Straight" von St. Nissen in JAMA (2010;303(12): 1194-1195) enthält einige exemplarische Einblicke.
Und das bereits erwähnte Editorial von Ch. DeAngelis und Ph. Fontanarosa vermittelt einen noch breiteren Überblick über die Reihe weiterer erlaubter und unerlaubter Methoden der Beeinflussung der (Fach-)Öffentlichkeit zu Lasten der Diabetespatienten und die Möglichkeiten, dies zu verhindern.
Praktisch schlägt der Beitrag vor, dass dann, wenn die Ergebnisse einer von Herstellern gesponsorten Studie in einer der renommierten und handlungssteuernden Fachzeitschriften zur Veröffentlichung eingereicht werden, mindestens ein völlig unabhängiger Wissenschaftler Einblick in die Originaldaten der Studie hatte und deren Korrektheit vor dem Start der üblichen Reviewrunden bestätigt. Die statistischen Analysen der Studien sollten ebenfalls von Statistikern gemacht werden, die in keinem Abhängigkeitsverhältnis zum Industrie-Sponsor stehen.
Ob auch diese Ideen noch zu blauäugig sind, steht dahin. Dass die Vorstellungen des BMG angesichts der hier durch mehrere unabhängige Untersucher und ForscherInnen hochaktuell belegten Machenschaften und Winkelzüge eines der größten Arzneimittelhersteller der Welt erschütternd naiv oder ohnmächtig sind, steht aber fest.
Der komplette "Staff Report on GlaxoSmithKline and the Diabetes Drug Avandia. Prepared by the staff of the Committee on Finance, United States Senate, Max Baucus, Chairman, Chuck Grassley, Ranking Member. steht kostenlos im etwas luftigen Original-Layout zur Verfügung.
Auch von dem Aufsatz "Ensuring Integrity in Industry-Sponsored Research. Primum Non Nocere, Revisited" von Catherine D. DeAngelis und Phil B. Fontanarosa aus der JAMA-Ausgabe vom 24. März 2010 (JAMA. 2010;303(12): 1196-1198) ist entweder das Abstract oder auch die komplette Fassung kostenlos erhältlich.
Bernard Braun, 28.3.10
Interne Dokumente der Pharma-Industrie: Marketing vor Wissenschaft
 Forschung sei die beste Medizin, propagiert der vfa (Wirtschaftsverband der forschenden Pharma-Unternehmen in Deutschland). Erkenntnisse aus internen Dokumenten der Industrie, die im Rahmen von Strafverfahren gegen pharmazeutische Unternehmen in den USA öffentlich geworden geben diesem Werbeslogan eine fast zynische Note.
Forschung sei die beste Medizin, propagiert der vfa (Wirtschaftsverband der forschenden Pharma-Unternehmen in Deutschland). Erkenntnisse aus internen Dokumenten der Industrie, die im Rahmen von Strafverfahren gegen pharmazeutische Unternehmen in den USA öffentlich geworden geben diesem Werbeslogan eine fast zynische Note.
Glen Spielmans und Peter Parry haben interne Dokumente der Firmen AstraZeneca, Pfizer, Smith Kline Beecham (heute GlaxoSmithKline) und Eli Lilly untersucht, die sich auf Studien zu Arzneimitteln gegen Depressionen und Psychosen und ihre Vermarktung beziehen. In den dargestellten Beispielen nutzen die pharmazeutischen Unternehmen die wissenschaftlichen Daten für das Marketing, indem sie die Daten aus Studien marketinggerecht selektieren und interpretieren, über Publikationsfirmen in die entsprechende Form bringen lassen und in hochrangigen Fachzeitschriften platzieren.
Ein Beispiel ist die antipsychotische Substanz Quetiapin, die von AstraZeneca als Seroquel® vermarktet wird. Unter der Standardsubstanz Haloperidol war bei Patienten mit Psychose in der Vorgeschichte, die zu Beginn der Studie symptomfrei waren, nach einem Jahr die Bewertung der psychotischen Symptome günstiger und das Risiko für erneute Psychosen geringer als unter Quetiapin. In den entscheidenden Endpunkten schnitt Haldol somit besser ab als Quetiapin. Einige Maße der kognitiven Funktion waren jedoch unter Quietapin günstiger. In einer Veröffentlichung stellte die Autoren die Verbesserung der kognitiven Funktion in den Mittelpunkt und ließen die antipsychotischen Endpunkte unter den Tisch fallen.
Ein weiteres Beispiel ist das Antidepressivum Paroxetin (Paxil®) der Firma GlaxoSmithKline, das für die Behandlung der Depression bei Jugendlichen als wirksam und gut verträglich beworben wurde. Tatsächlich hatten aber Studien für 2 primäre und 6 sekundäre Endpunkte negative Ergebnisse erbracht, d.h. die Substanz wirkte für keinen der 8 Parameter besser als Plazebo. In der veröffentlichten Studie berichteten die Autoren von 8 Ergebnismaßen, von denen 4 günstig dargestellt wurden - all diese Ergebnismaße waren jedoch im Studienprotokoll nicht erwähnt - ein klassischer Fall von "data fishing". Gravierende unerwünschte Wirkungen, wie vermehrte Suizidgedanken, vermehrte vorsätzliche Selbstschädigung sowie feindseliges Verhalten wurden nicht erwähnt. Somit hat GlaxoSmithKline eine Substanz ohne positive Effekte mit gravierenden negativen Effekten in einer Veröffentlichung in einer namhaften Fachzeitschrift als effektiv und gut verträglich bezeichnet.
Weitere Beispiele und Zitate belegen, dass große pharmazeutische Firmen den Anschein der evidenzbasierten Medizin in verfälschender Form für das Marketing ihrer Arzneimittel einsetzen. Dafür nutzen sie die großen Fachzeitschriften, deren Informationen viele Aerzte am meisten Vertrauen schenken.
Schon die wegweisende Studie von Turner et al. hatte offengelegt, dass das Verfälschen und Unterdrücken von Daten eine unter pharmazeutischen Firmen verbreitete Praxis ist und nicht etwa die Verfehlung weniger schwarzer Schafe: für jedes der 12 untersuchten Antidepressiva hat das jeweilige Unternehmen Daten geschönt oder unterdrückt, wenn sie nicht in das Marketingkonzept passten (wir berichteten).
Die Studie von Spielmans und Parry ist im Volltext abrufbar:
Spielmans, G. and P. Parry (2010). "From Evidence-based Medicine to Marketing-based Medicine: Evidence from Internal Industry Documents." Journal of Bioethical Inquiry. Download
Einige der internen Dokumente der Industrie sowie Powerpoint-Präsentationen dazu auf folgender Website:
HealthyScepticism
David Klemperer, 14.3.10
Biomedizinische Forschung überwiegend von finanziellen Gewinnerwartungen motiviert
 In den USA wurden im Jahr 2007 105,6 Mrd. Dollar in die biomedizinische Forschung investiert. Da die Geldgeber darüber bestimmen, welche Fragen untersucht werden und welche nicht, ist die Frage nach den Finanzierungsquellen von großer Bedeutung. Unterschieden wird beispielsweise zwischen "Investigator-Driven Clinical Trials" und "Industry-driven trials", also zwischen Studien, die entweder in erster Linie der wissenschaftlichen Neugier oder aber den Gewinnerwartungen der Industrie entspringen. Im Jahr 2009 hatten sich die European Medical Research Councils in einem Bericht für eine Stärkung der Industrie-unabhängigen Forschung, also der "Investigator-Driven Clinical Trials" ausgesprochen (wir berichteten).
In den USA wurden im Jahr 2007 105,6 Mrd. Dollar in die biomedizinische Forschung investiert. Da die Geldgeber darüber bestimmen, welche Fragen untersucht werden und welche nicht, ist die Frage nach den Finanzierungsquellen von großer Bedeutung. Unterschieden wird beispielsweise zwischen "Investigator-Driven Clinical Trials" und "Industry-driven trials", also zwischen Studien, die entweder in erster Linie der wissenschaftlichen Neugier oder aber den Gewinnerwartungen der Industrie entspringen. Im Jahr 2009 hatten sich die European Medical Research Councils in einem Bericht für eine Stärkung der Industrie-unabhängigen Forschung, also der "Investigator-Driven Clinical Trials" ausgesprochen (wir berichteten).
70 bis 80 % der weltweiten biomedizinischen Forschungsleistungen werden in den USA erbracht. Die Trends in der Finanzierung sind das Thema einer kürzlich im Journal of the American Medical Association erschienen Untersuchung.
Die wesentlichen Geldgeber sind
• die amerikanische Regierung
• die Bundesstaaten
• private gemeinnützige Einrichtungen einschließlich Stiftungen
• die Industrie.
Auf Seiten der Industrie sind zu unterscheiden:
• die pharmazeutische Industrie
• Biotechnologiefirmen
• Hersteller medizinischer Geräte.
Die Gesamtsumme für biomedizinische Forschung stiegt von 75,5 Mrd. Dollar im Jahr 2003 auf $101,1 Mrd. Dollar im Jahr 2007. Inflationsbereinigt beträgt der Anstieg 14%, und ist damit etwas stärker als der Anstieg des Bruttosozialproduktes, das im selben Zeitraum um 12% stieg. Die jährliche Wachstumsrate hatte zwischen 1994 und 2003 noch durchschnittlich 7,8% betragen, zwischen 2003 und 2007 nur noch 3,4%. Die neuesten Zahlen aus dem Jahr 2008 weisen sogar auf eine Abnahme der Forschungsgelder hin.
Die National Institutes of Health (NIH) trugen im Jahr 2007 27% der Forschungsausgaben und damit den größten Teil (84%) der öffentlichen Ausgaben. Inflationsbereinigt nahm der absolute Betrag wie auch der Anteil an den Gesamtausgaben seit 2003 ab.
Größter Geldgeber war die Industrie mit 58,6 Mrd. Dollar im Jahr 2007, entsprechend einem Anteil von 58% der Gesamtausgaben. Im Jahr 2003 waren es noch 40 Mrd. gewesen, der Zuwachs bis 2007 beträgt inflationsbereinigt 25%. Die pharmazeutische Industrie stellt den größten Anteil der Ausgaben, gefolgt von den Biotechnologiefirmen und der Geräteindustrie. Die Stärke des Wachstums von 2003 auf 2007 verläuft umgekehrt - hier liegt die Geräteindustrie mit 59% vor den biotechnologischen Firmen (41%) und den pharmazeutischen Firmen (15%).
Zusammenfassend lässt sich feststellen, dass
• weiterhin mit hohem finanziellem Aufwand neue medizinische Technologien erforscht werden,
• in den letzten Jahren eine Dämpfung des Anstiegs der Zuwachsraten zu verzeichnen ist,
• sich die Anteile der Förderung weiter zuungunsten der öffentlichen Förderung in den Bereich der Industrie verschieben,
• die größten Hoffnungen der Anleger derzeit auf den Geräteherstellern und den Biotechnologiefirmen ruhen.
Vergleichsweise niedrig sind die Forschungsanstrengungen, wenn es darum geht, die Funktionalität der Gesundheitsversorgung und den Stellenwert neuer Technologien zu ergründen ("Health Policy
and Health Services Research"). Im Jahr 2008 stellten die amerikanische Regierung und private Einrichtungen dafür 2,2 Mrd. Dollar zur Verfügung. Die NIH waren mit 1,0 Mrd. Dollar beteiligt, die Agency for Healthcare Research and Quality mit 335 Mrd. Dollar und die Robert-Wood-Johnson-Foundation mit 523 Mrd. Dollar. Der Anteil für Forschung im Bereich Health Policy and Health Services an den Gesamtgesundheitsausgaben beträgt kärgliche 0,1 %. In die biomedizinische Forschung investieren die USA hingegen 4,5 %, ein Wert, der höher ist als in jedem anderen Land der Welt.
Dorsey ER, de Roulet J, Thompson JP, Reminick JI, Thai A, White-Stellato Z, et al. Funding of US Biomedical Research, 2003-2008. JAMA 2010;303(2):137-1. Abstract der Studie
Volltext der Vorläuferstudie Moses H, III, Dorsey ER, Matheson DHM, Thier SO. Financial Anatomy of Biomedical Research. JAMA 2005;294(11):1333-1342.
David Klemperer, 12.2.10
"An aspirin per day keeps ..." oder Lehrstück über den fragwürdigen Beitrag von Bayer Healthcare zur Gefäß-Primärprävention!
 "Heute wird Aspirin … fast allen Patienten gegeben, die bereits einen Herzinfarkt oder Schlaganfall hatten. Darüber hinaus wird Aspirin bei Patienten mit Durchblutungsstörungen an den Herzkranzgefäßen, nach Herzoperationen und bei Patienten, die erste Symptome von Mangeldurchblutungen im Gehirn hatten, eingesetzt. Viele Ärzte empfehlen auch anderen Patienten die Einnahme von Aspirin protect. Fragen Sie bitte Ihren Arzt oder Apotheker, ob eine regelmäßige Einnahme … für Sie sinnvoll ist." (aktuell vertriebene Praxisbroschüre "Rund ums Herz. Aspirin protect" der Firma Bayer Healthcare)
"Heute wird Aspirin … fast allen Patienten gegeben, die bereits einen Herzinfarkt oder Schlaganfall hatten. Darüber hinaus wird Aspirin bei Patienten mit Durchblutungsstörungen an den Herzkranzgefäßen, nach Herzoperationen und bei Patienten, die erste Symptome von Mangeldurchblutungen im Gehirn hatten, eingesetzt. Viele Ärzte empfehlen auch anderen Patienten die Einnahme von Aspirin protect. Fragen Sie bitte Ihren Arzt oder Apotheker, ob eine regelmäßige Einnahme … für Sie sinnvoll ist." (aktuell vertriebene Praxisbroschüre "Rund ums Herz. Aspirin protect" der Firma Bayer Healthcare)
Und wenn ein Arzt oder Apotheker sagen, dies sei sinnvoll, dann folgen viele herz-/kreislaufgesunde Menschen der Devise "an aspirin per day keeps conditions away" und die Firma "Bayer Healthcare" kann im Ernstfall immer sagen, sie habe niemals direkt eine tägliche Einnahme für Menschen ohne Vorerkrankung empfohlen oder gar einen primärpräventiven Nutzen versprochen.
Ist Bayer Healthcare also ein "ehrenwerter" Hersteller? Oder spricht dagegen nicht das Verschweigen der zahlreichen seit Mitte der 1990er Jahren immer wieder und zuletzt Mitte 2009 bestätigten Erkenntnisse über den vor allem bei der Primärprävention von schweren Herzkreislauf- oder anderen Gefäßerkrankungen geringen oder sogar mit unterschiedlich starken unerwünschten Effekten erkauften Nutzen von Aspirin in der zitierten, gezielt an Patienten gerichteten Broschüre?
Eine kleine aber relevante Auswahl der hier gemeinten und fast durchweg in renommierten peer-reviewten Fachzeitschriften erschienenen studienbasierten Erkenntnisse kann bei der Beantwortung hilfreich sein und zeigt u.a.:
• Personen, die ohne eine Herzerkrankungs-Vorgeschichte Aspirin mit primärpräventivem Ziel einnahmen, erhöhten nach einer Studie aus dem Jahr 2000 ("Consumption of NSAIDs and the development of congestive heart failure in elderly patients: an underrecognized public health problem" von Page J, Henry D. in der Fachzeitschrift "Archives of Internal Medicine" (2000;160:777-784) ihr Risiko für eine Herzgefäßerkrankung um 60%. Diejenigen Personen, die spezifisch vorerkrankt waren, erhöhten mit der Aspirineinnahme ihr Risiko einer Herzdurchblutungsstörung um das 10,5fache. Gesamtbewertung: "Assuming these relationships are causal, NSAIDs were responsible for approximately 19% of hospital admissions with CHF."
• Selbst wenn in der 2002 im "Archive for Internal Medicine" (2002;162:265-270) veröffentlichten und kostenlos erhältlichen "Rotterdam Study" ("Association of Nonsteroidal Anti-inflammatory Drugs With First Occurrence of Heart Failure and With Relapsing Heart Failure. The Rotterdam Study" von Johan Feenstra, Eibert R. Heerdink, Diederick E. Grobbee und Bruno H. Ch. Stricker kein Anstieg der Inzidenz von gefäßbedingtem Herzversagen nach Einnahme von Aspirin und pharmakologisch ähnlichen Wirkstoffen festgestellt werden konnte, trug das mit der regelmäßigen Einnahme solcher Arzneimittel assoziierte erheblich erhöhte Risiko von bereits am Herzen erkrankten Personen, einen Rückfall zu bekommen, nicht dazu bei, diese Wirkstoffe für hilfreich oder uneingeschränkt unschädlich erklären zu können.
• Auch das Risiko an anderen Krankheiten zu erkranken, war unter den Aspirin-EinnehmerInnen zum Teil erhöht. Das Risiko für Brustkrebs erhöhte sich beispielsweise nach der in der Fachzeitschrift "Journal of the National Cancer Institute (2005 97(11): 805-812) veröffentlichten Studie aus dem Jahr 2005 ("Nonsteroidal Anti-Inflammatory Drug Use and Breast Cancer Risk by Stage and Hormone Receptor Status" von Sarah F. Marshall, Leslie Bernstein, Hoda Anton-Culver, Dennis Deapen, Pamela L. Horn-Ross, Harvey Mohrenweiser, David Peel, Rich Pinder, David M. Purdie, Peggy Reynolds, Dan Stram, Dee West, William E. Wright, Argyrios Ziogas und Ronald K. Ross um 50%. Selbst wenn die AutorInnen einschränkend feststellen, hier handle es sich um keinen nachweisbar kausalen Zusammenhang, kann daraus nicht der Schluss gezogen werden, Aspirin wäre völlig harmlos und es sei überhaupt keine Zurückhaltung oder weitere Forschung angebracht.
• Bereits 1998 stellte ein im Medizinjournal "JAMA" (1998;280: 1930-1935) veröffentlichter Review mit Metaanalysen mehrerer RCTs ("Aspirin and Risk of Hemorrhagic Stroke: A Meta-analysis of Randomized Controlled Trials" von Jiang He; Paul K. Whelton; Brian V. und Michael J. Klag ein um 84% höheres Schlaganfallrisiko bei Personen fest, die täglich Aspirin einnahmen.
• 1998 quantifizierten die Verfasser einer Studie die schweren, unerwünschten Nebenwirkungen und das zusätzliche Mortalitätsrisiko der Einnahme so genannter nichtsteroidaler Antirheumatika (NSAR) und nichtsteroidale Antiphlogistika (NSAP) bzw. NSAID (non steroidal anti inflammatory drugs), zu deren häufigstem Wirkstoff Aspirin gehört, so: "Conservative calculations estimate that approximately 107,000 patients are hospitalized annually for nonsteroidal anti-inflammatory drug (NSAID)-related gastrointestinal (GI) complications and at least 16,500 NSAID-related deaths occur each year among arthritis patients alone." (Singh Gurkirpal [1998]: "Recent Considerations in Nonsteroidal Anti-Inflammatory Drug Gastropathy" in: The American Journal of Medicine, July 27, 1998: 31S). Über den Aufsatz gibt es kostenlos nur das Abstract.
• Ein Jahr später charakterisierten andere WissenschaftlerInnen zusammen mit Singh im "New England Journal of Medicine (NEJM)" (17. Juni 1999, Vol. 340, No. 24: 1888-1889) dieselben Nebenwirkungen der regelmäßigen Einnahme von Aspirin als eine "geräuschlose Epidemie". 75% der Menschen, die regelmäßig Aspirin einnehmen, kennen nach derselben Studie nicht die Gefahren des Gebrauchs dieses Schmerzmittels - und wahrscheinlich auch der anderer Analgetika. Zum Geschehen selber fassten sie ihre Ergebnisse so zusammen: "It has been estimated conservatively that 16,500 NSAID-related deaths occur among patients with rheumatoid arthritis or osteoarthritis every year in the United States. This figure is similar to the number of deaths from the acquired immunodeficiency syndrome and considerably greater than the number of deaths from multiple myeloma, asthma, cervical cancer, or Hodgkin's disease. If deaths from gastrointestinal toxic effects from NSAIDs were tabulated separately in the National Vital Statistics reports, these effects would constitute the 15th most common cause of death in the United States. … Furthermore the mortality statistics do not include deaths ascribed to the use of over-the-counter NSAIDS." (Wolfe M., Lichtenstein D.und Singh Gurkirpal [1999]: "Gastrointestinal Toxicity of Nonsteroidal Anti-inflammatory Drugs. Dass es sich dabei nur um die empirischen Effekte der verordneten Arzneimittel mit Wirkstoffen wie Acetylsalicylsäure (ASS) handelt, ist angesichts der Tatsache, dass weltweit der überwiegende Anteil der ASS-haltige Arzneimittel frei in der Apotheke gekauft wird, von hoher Brisanz. Von dem Aufsatz gibt es kostenlos leider nur einen Kurztext.
• 2005 veröffentlicht das private und bis in die jüngste Zeit hinein auch für das "Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)" gutachtende "Institut für evidenzbasierte Medizin" in Köln (dass es wegen dieser Unteraufträge an das u.a. der Frau von IQWIG-Leiter Sawicki gehörende Institut Debatten gab, ändert nichts an seiner fachlichen Qualität), also praktisch in Rufweite zum Bayer-Stammwerk in Leverkusen und in deutscher Sprache die kostenlos erhältliche, 27 Seiten umfassende Review-Studie "Acetylsalicylsäure in der Primärprophylaxe kardiovaskulärer Erkrankungen". Die Verfasser, Andreas Waltering, Lars Hemkens und Christiane Florack, untersuchen dazu die zum damaligen Zeitpunkt größten und qualitativ hochwertigen veröffentlichten Studien: British Male Doctors trial, Physicians´ Health Study, Thrombosis Prevention Trial, Hypertension Optimal Treatment Trial, Primary Prevention Project und Women s Health Study. Die im Einzelnen ebenfalls lesenswerten Ergebnisse fassen die Autoren u.a. so zusammen: "Die Primärprävention kardiovaskulärer Erkrankungen mittels Acetylsalicylsäure führt zu keiner Senkung der kardiovaskulären Mortalität oder der Gesamtmortalität. … Unter Therapie mit Acetylsalicylsäure treten signifikant häufiger schwere, vor allem gastrointestinale, Blutungsereignisse auf. Es muss von ca. 0,7 zusätzlichen ernsten Ereignissen pro 1000 Patientenjahre ausgegangen werden, … Eindeutige Subgruppen bezüglich kardiovaskulärer Risikofaktoren, die einen besonderen Nutzen durch eine Primärprophylaxe haben, lassen sich bis dato nicht identifizieren. Auch die Definition einer Risikoschwelle, ab der ein Patient in stärkerem Maße von einer Primärprophylaxe profitieren würde, ist anhand der vorliegenden Studien nicht möglich. Lediglich für Frauen im Alter von 65 Jahren scheint ein Nutzen auch bezüglich der Reduktion kardialer Ereignisse zu bestehen."
• Der 2008 im "European Journal of Heart Failure" (2008 10 (11): 1102-110) veröffentlichte Aufsatz "Non-steroidal anti-inflammatory drugs and cardiac failure: meta-analyses of observational studies and randomised controlled trials" von Paul A Scott, Gabrielle H. Kingsley und David L Scott, kommt nach der Analyse bzw. Metaanalyse der Ergebnisse von 5 Fall-Kontrollstudien, zwei Kohortenstudien, sechs placebo-kontrollierten Studien und sechs randomisierten kontrollierten Studien u.a. zu folgender Bewertung: "Observational studies and RCTs all show that NSAIDs (darunter wieder sehr häufig Aspirin bzw. sein Wirkstoff) increase the risk of cardiac failure. … Pre-existing cardiac failure increases risk." Auch wenn die Erhöhung des absoluten Risikos nicht so groß ist, empfehlen die ForscherInnen uneingeschränkt mehr Vorsicht bei der Einnahme derartiger Wirkstoffe.
Und am aktuellsten kam die international besetzte Wissenschaftlergruppe von Collins et al. in ihrem 2009 im britischen Fachjournal "The Lancet" (30. Mai 2009; 373 [9678]: 1849-60) veröffentlichten Aufsatz "Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials." auf der Basis von Metaanalysen mit Daten von sechs primärpräventiven und 16 sekundärpräventiven Studien mit Tausenden von Teilnehmern zu folgenden Schlussfolgerungen:
• Niedrige, regelmäßig und über lange Zeit eingenommene Dosen von Aspirin haben für viele Personen mit spezifischen Gefäßverschlusserkrankungen einen eindeutigen und bedeutenden sekundärpräventiven Nettonutzen. Die Einnahme kann spezifische Erkrankungs- bzw. Wiedererkrankungsrisiken maximal um ein Fünftel reduzieren.
• Auch in den primärpräventiven Studien wurde nach Collins et al. die Häufigkeit aller ernsthaften Gefäss-Erkrankungsereignisse unter den EinnehmerInnen von Aspirin hochsignifikant um 12% reduziert (jährlich 0,51% in der Aspirin- und 0,57% in der Kontrollgruppe; p=0,0001). Hierbei spielte aber die Verminderung der Häufigkeit nichttödlicher Herzinfarkte um rund 20% die größte Rolle.
• Der Nettoeffekt der Aspirineinnahme auf das Risiko, einen Schlaganfall zu erleiden, war so gering, dass es keinen statistisch signifikanten Unterschied zwischen Aspirin- und Kontrollgruppe gab.
• Die Sterblichkeit durch Gefäßerkrankungen unterschied sich zwischen beiden Gruppen ebenfalls nicht signifikant (0,10% versus 0,19% pro Jahr; p=0,7).
• Dem Allem steht das statistisch signifikant höhere Risiko schwerer Magen-Darm-Blutungen oder anderer Blutungen außerhalb des Schädels bei den meisten Angehörigen der Aspiringruppe gegenüber.
Sobald aber, wie bei der primärpräventiven regelmäßigen Einnahme von Aspirin, dem geringen oder gar fehlenden Nutzen eine deutliche Zunahme solch schwerer und wiederum folgenreicher Ereignisse wie innerer Blutungen gegenüber steht, muss dies sorgfältig gegeneinander abgewogen werden. Für Collins et al. kommt dabei zurückhaltend formuliert ein "uncertain net value" heraus, der gegen eine primärpräventive Einnahme spräche.
Angesichts dieser langjährigen Fülle von oftmals hochwertigen Reviews und Metaanalysen von RCTs über die unerwünschten und gefährlichen Folgen insbesondere der primärpräventiven Einnahme von Aspirin und verwandter Wirkstoffe durch herz-/kreislaufgesunde Personen ist das Verschanzen der Firma Bayer Healthcare hinter den "viele(n) Ärzte(n)", die genau dies angeblich auch empfehlen, kein Kavaliersdelikt mehr.
Dies umso weniger als die Firma im Ausland bereits mehrmals negative Erfahrungen mit Werbekampagnen gemacht hat, in denen sie die Wirkung von Aspirin aktiv übertrieben oder durch Verschweigen wichtiger Details den Eindruck erweckte, Aspirin sei ein "Wunder-" und Prophylaxemittel. Dies wurde ihr u.a. im Jahr 2000 in den USA und Mitte 2009 in Brasilien durch Regierungseinrichtungen verboten.
Obwohl eine ihr öffentlich "verordnete" Informationskampagne über die Risiken einer Dauereinnahme von Aspirin für Gesunde die Firma in den USA Millionen US-Dollar gekostet hat, hindert dies Bayer nicht daran, erneut und aktuell ein "Informations"-Angebot wie die Bayer/Aspirin-Website www.WonderDrug.com zu betreiben.
Auf ihr verschweigt oder verharmlost Bayer unter dem Motto "Expect Wonders" ("erwarte Wunder") erneut fast durchweg die bekannten spezifischen Nebenwirkungen des Präparats. So folgt der Ankündigung "Aspirin for the Heart. Aspirin has many uses and has been known as the miracle drug that works wonders" eine lange Aufzählung von tatsächlichen oder möglicherweise positiven Wirkungen bei allen möglichen Durchblutungserkrankungen. Der Sachstand zu den Grenzen und Risiken des Präparats wird keineswegs ergänzt, sondern lediglich mit dem Satz angedeutet: "Aspirin is not appropriate for everyone, so be sure to talk to your doctor before you begin an aspirin regimen." Und wenn der Arzt dann, warum auch immer, eine "Empfehlung" z.B. für den primärpräventiven Gebrauch gibt, schließt sich der profitable aber für Patienten riskante Kreis.
Ein wichtiger Nachtrag: Wohlwissend, dass der Aspirinwirkstoff ASS zu inneren Blutungen führt, verweist Bayer beruhigend auf sein Produkt "Aspirin protect", das es seit den 1990er Jahren auf dem Markt gibt. Diese Tabletten, so die Patientenbroschüre "lösen sich nicht im Magen, sondern erst im Dünndarm auf" und schonten damit wahrscheinlich die empfindliche Magenschleimhaut. Weniger zutreffend und vor allem nicht unumstritten ist der daraus gezogene Schluss "Aspirin protect" sei "auf Dauer gut verträglich" und könne also sorgenfrei eingenommen werden.
Ohne dies hier und vor allem mangels neuerer und hochwertiger Studien entscheiden zu können, sei der Hinweis erlaubt, dass das Nebenwirkungspotenzial von "Aspirin protect" seit Mitte der 1990er Jahre unterschiedlich bis offen kontrovers beurteilt wird:
• Eine 1996 in der Fachzeitschrift "Lancet" veröffentlichte Multicenter-Fallkontrollstudie "Risk of aspirin-associated major upper-gastrointestinal bleeding with enteric-coated or buffered product" von Kelly et. al. (348: 1413-1416) (komplett kostenlos erhältlich wenn man sich als Nutzer kostenlos und unaufwändig einträgt) kommen nach einer Zusammenfassung der Ergebnisse im "Deutschen Ärzteblatt" (94, Heft 43 vom 24. Oktober 1997, A-2834) zu dem unerwartet kritischen Ergebnis, dass "die als wesentlich nebenwirkungsärmer propagierten dünndarmlöslichen oder gepufferten Aspirinpräparationen nicht besser abschneiden als normales Aspirin, aber um das bis zu 20fache teurer sind." Verordnende Ärzte sollten sich also in Sachen Blutungen "nicht in einer falschen Sicherheit wiegen".
• Anders stellt dies ein im März 1998 wiederum im "Deutschen Ärzteblatt" (95, Heft 10, 6. März, A-551) redaktioneller Beitrag dar. Danach handle es sich nach Ansicht des Mathematikers Joachim Braun aus Königswinter bei den Ergebnissen von Kelly et al. um "statistische Artefakte". Außerdem belegten klinische Beobachtungsstudien "positive klinische Erfahrungen" mit Aspirin protect.
• 2006 veröffentlicht der Berliner Kliniker Harald Darius in der "Pharmazeutischen Zeitung" vom 22. August ausführlich Ergebnisse einer zweijährigen prospektiven Beobachtungsstudie, deren Kern bereits in der Überschrift verdeutlicht wird: "Anwendungsbeobachtung dokumentiert gute Verträglichkeit".
• Angesichts dieser gegensätzlichen Erkenntnissen aus mehr oder weniger aufwändig angelegten aber durchweg methodisch schwachen Fallkontroll- oder Kohortenstudien, gilt u.E. nachwievor eine 2001 im unabhängigen "arznei-telegramm" (Jg. 32, Nr.8: 81) gezogene Zwischenbilanz der Forschung: "Randomisierte Therapiestudien, die eine Senkung des Risikos peptischer Geschwüre, Blutungen oder Perforationen durch Aspirin protect insbesondere auch bei gefährdeten Patienten belegen, gibt es nicht. Nach Fallkontroll- und Kohortenstudien ist die Zubereitung nicht weniger riskant als übliche, bis zu 70% billigere ASS-Tabletten."
Wie man trotz dieses mittlerweile in so unterschiedlichen Publikationen wie dem "Arzneimittel-Kursbuch" der Stiftung Warentest oder einer Information zur "Optimierung der Pharmakotherapie" der Kassenärztlichen Vereinigung Westfallen-Lippe aus dem Jahr 2007 veröffentlichten Erkenntnis-Zwischenstands undifferenziert und Zuversicht verbreitend ein "auf Dauer gut verträglich" versprechen kann, ist wohl nur mit dem ökonomischen Interesse der Firma Bayer Healthcare zu erklären.
Bernard Braun, 6.2.10
Ghost Writing - auch in den führenden Medizinjournalen noch immer weit verbreitet
 Sechs der angesehensten Medizinfachzeitschriften (Annals of Internal Medicine, JAMA, Lancet, Nature Medicine, New England Journal of Medicine und PLoS Medicine) veröffentlichten im Jahr 2008 eine erhebliche Anzahl von Studien, an denen ein Ghostwriter beteiligt war. Von 630 anonym befragten Autoren gaben 7,8 Prozent an, dass Personen an ihrem Beitrag beteiligt waren, die eigentlich als Autoren hätten genannt werden müssen.
Sechs der angesehensten Medizinfachzeitschriften (Annals of Internal Medicine, JAMA, Lancet, Nature Medicine, New England Journal of Medicine und PLoS Medicine) veröffentlichten im Jahr 2008 eine erhebliche Anzahl von Studien, an denen ein Ghostwriter beteiligt war. Von 630 anonym befragten Autoren gaben 7,8 Prozent an, dass Personen an ihrem Beitrag beteiligt waren, die eigentlich als Autoren hätten genannt werden müssen.
Dies ergab eine Studie, die am 10. September auf dem International Meeting of Journal Editors in Vancouver vorgestellt wurde. Als Ghostwriter werden Personen bezeichnet, die Artikel ganz oder teilweise verfassen - zumeist von der Industrie finanziert - ohne dass ihr Name in der Studie genannt wird. Dadurch wird der Einfluss der Industrie auf die Studie verschleiert.
Die Untersucher - unter ihnen drei Herausgeber des Journal of the American Medical Association - hatten eine Online-Befragung der korrespondierenden Autoren von 900 Studien, Übersichtsarbeiten und Editorials durchgeführt. 70 Prozent der Autoren beteiligten sich an der Befragung.
Die Rate an Publikationen mit Ghostwriter beträgt laut dieser Untersuchung für das New England Journal of Medicine 10,9 Prozent, 7,9 Prozent für das Journal of the American Medical Association, 7,6 Prozent für den Lancet, 4,2 Prozent für die Annals of Internal Medicine und 2 Prozent für Nature Medicine.
Die Studie ist noch nicht in einer Fachzeitschrift veröffentlicht und wurde wurde noch nicht einem Peer Review-Verfahren unterzogen.
Eine Studie mit gleicher Fragestellung aber anderer Untersuchungsmethode hatte im Jahr 1996 ähnliche Zahlen ergeben. Wegen der Verschärfung der Regelungen hatte man eher mit einem Rückgang gerechnet.
Über das Problem des ghost writing haben wir mehrfach berichtet (ghost in die Suche eingeben)
Abstract: Prevalence of Honorary and Ghost Authorship in 6 General Medical Journals, 2009, www.jama-peer.org, plenary session abstracts, by Joseph Wislar, Annette Flanagin, Phil B. Fontanarosa, Catherine D. DeAngelis (siehe Seite 2)
Bericht der New York Times: Ghostwriting Is Called Rife in Medical Journals by Duff Wilson and Natasha Singer, Published September 10, 2009
Website The Sixth International Congress on Peer Review and Biomedical Publication
Artikel im Volltext: Annette Flanagin et al.: Prevalence of Articles With Honorary Authors and Ghost Authors in Peer-Reviewed Medical Journals JAMA. 1998;280:222-224.
David Klemperer, 12.9.09
Arzneimittel-Information: Deutsche haben ähnliche Vorbehalte gegenüber der Pharma-Industrie wie US-Bürger
 In einer Vielzahl von Studien wurden Arzneimittel-Informationen und insbesondere der Beipackzettel von Patienten als unverständlich und teilweise sogar angsteinflößend bewertet. Vor diesem Hintergrund will die EU-Kommission der pharmazeutischen Industrie erlauben, Informationen über verschreibungspflichtige Medikamente zu veröffentlichen. In einer repräsentativen Bevölkerungsumfrage hat sich jetzt allerdings gezeigt, dass die Bevölkerung diesem Vorhaben zumindest skeptisch gegenüber steht. Deutlich wurde darüber hinaus: Ähnlich wie in US-amerikanischen Umfragen ist auch in Deutschland das Vertrauen in die Pharma-Industrie nicht besonders hoch.
In einer Vielzahl von Studien wurden Arzneimittel-Informationen und insbesondere der Beipackzettel von Patienten als unverständlich und teilweise sogar angsteinflößend bewertet. Vor diesem Hintergrund will die EU-Kommission der pharmazeutischen Industrie erlauben, Informationen über verschreibungspflichtige Medikamente zu veröffentlichen. In einer repräsentativen Bevölkerungsumfrage hat sich jetzt allerdings gezeigt, dass die Bevölkerung diesem Vorhaben zumindest skeptisch gegenüber steht. Deutlich wurde darüber hinaus: Ähnlich wie in US-amerikanischen Umfragen ist auch in Deutschland das Vertrauen in die Pharma-Industrie nicht besonders hoch.
Der Bedarf an besseren Arzneimittel-Informationen ist groß. in der jetzt veröffentlichten Befragung des "Gesundheitsmonitor" der Bertelsmann-Stiftung zeigt sich: Verbesserungen beim gängigen und gewohnten Informationsmedium des Beipackzettels würden am häufigsten begrüßt: 98 Prozent halten dies für sehr wichtig oder wichtig. Ähnlich hohe Zustimmungsraten finden sich auch für andere Vorschläge wie "Arzneimittel-Tests einer unabhängigen Einrichtung wie Stiftung Warentest" (88%) oder eine vom Arzt ausgedruckte Arzneimittelinformation, in der persönliche Aspekte (Begleiterkrankungen, Lebensstil, Art der Informationswünsche usw.) berücksichtigt sind (81%). Auch der Vorschlag einer telefonischen Auskunftsstelle findet eine knappe Mehrheit.
Bei der Frage, wer diese Informationen bereit stellen solle, zeigt sich dann eine "markante Hierarchie der Vertrauenswürdigkeit". Nahezu uneingeschränktes Vertrauen (97%) genießt der eigene Arzt. Immerhin 75 Prozent schenken der Stiftung Warentest und den Verbraucherschutzorganisationen Vertrauen und knapp 50 Prozent Selbsthilfegruppen und Patientenorganisationen. Skepsis herrscht bei den meisten Befragten gegenüber Pharma-Unternehmen: Nur jeder vierte Befragte (26%) geht davon aus, dass Hersteller von Arzneimitteln zuverlässige und glaubwürdige Arzneimittel-Informationen bereitstellen könnten.
Von daher herrscht eine deutliche Skepsis vor, was die Objektivität solcher Arzneimittel-Informationen anbetrifft, die von Pharma-Unternehmen kommen. 78 Prozent der Befragten stellen dies in Frage, 32 Prozent davon sehr stark. Über drei Viertel der Bevölkerung sind der Meinung, dass Pharma-Unternehmen interessengebunden handelten und daher nicht objektiv und neutral über ihre Produkte berichteten. Die Befragten fühlen sich andererseits jedoch autark genug, um diese Interessenbindung zu durchschauen. Die allermeisten (86%) stimmen der Ansicht zu "Mündige Patienten sollten selbst entscheiden, wo und bei wem sie sich informieren."
Die Glaubwürdigkeit von Arzneimittel-Informationen hängt entscheidend von der Glaubwürdigkeit der Verfasser ab, so dass die Frage nahe liegt, wie es um das Image von pharmazeutischen Unternehmen in Deutschland bestellt ist. Diese Fragestellung ist durch den Gesundheitsmonitor jetzt erstmals in einer repräsentativen Bevölkerungsumfrage aufgegriffen worden. Dabei zeigt sich auch eine überraschend hohe Übereinstimmung der Urteile aus USA und Deutschland (vgl. Abbildung) 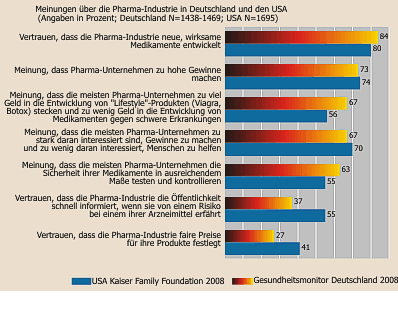
Das Image der pharmazeutischen Industrie hat einige positive Facetten, weist aber auch einige "hässliche Seiten" auf - hierzulande ähnlich wie jenseits des Atlantiks. Positiv hervorgehoben wird beispielsweise der innovative Beitrag der Pharma-Branche, die Entwicklung neuer und therapeutisch hilfreicher Medikamente. Diesen optimistischen Urteilen stehen jedoch verschiedene negative Bewertungen gegenüber. Dies betrifft die Höhe der Unternehmensgewinne, die Fairness der Preise oder auch die Schwerpunkte der Unternehmenspolitik. So meinen rund zwei Drittel, pharmazeutische Unternehmen seien zu stark daran interessiert, Gewinne zu machen und zu wenig daran interessiert, Menschen zu helfen. Genau so viele stimmen der Aussage zu "Die meisten Pharma-Unternehmen stecken zu viel Geld in die Entwicklung von "Lifestyle"-Produkten (Viagra, Botox) und zu wenig Geld in die Entwicklung von Medikamenten gegen schwere Erkrankungen".
Bemühungen zur Verbesserung der Arzneimittelinformation, so bilanzieren die Wissenschaftler, sind zweifellos sinnvoll. Es dürfe jedoch bezweifelt werden, dass der von der EU angestrebte Weg einer Aufhebung des Werbe- bzw. Informationsverbots für rezeptpflichtige Arzneimittel ein sinnvoller Beitrag ist. Auch Patienten und Verbraucher stellen in Frage, dass die Pharma-Unternehmen objektiv und neutral über ihre Produkte informieren würden. Das Image dieser Branche, so hat sich gezeigt, weist in Deutschland in ähnlicher Weise wie in den USA viele Negativfacetten auf. Nach Ansicht der Forscher gibt es andererseits schon sehr viel versprechende Möglichkeiten einer an Patienteninteressen orientierten Arzneimittel-Information. Diese Vorschläge werden abschließend kurz vorgestellt, etwa die von Computern erstellte und individualisierte Informationsbroschüre, die nach der Sprechstunde dem Patienten ausgehändigt wird oder die in einer US-Studie unlängst entwickelte "Drug Facts Box", ein "Kasten mit Arzneimittel-Fakten".
Die Studie ist hier kostenlos erhältlich: Gerd Marstedt, David Klemperer: Lesen Sie den Beipackzettel? Patientenwünsche zur Arzneimittelinformation (Gesundheitsmonitor, Newsletter 2/2009)
Gerd Marstedt, 4.8.09
Vorsicht vor Hinweisen auf "Studien"! Häufige Diskrepanz zwischen Werbeaussagen und "Studien"-Ergebnissen in Arzneimittelanzeigen
 Auch Arzneimittelhersteller wissen, dass PatientInnen wie ÄrztInnen Aussagen zu ihren Produkten eher glauben, wenn sie mit Hinweisen auf wissenschaftliche Studien versehen sind, welche die Wirksamkeit der Produkte nachweisen sollen. Wem hier angesichts der zahlreichen nachgewiesenen Manipulationen oder Fälschungen von Arzneimittelstudien durch die Pharmaindustrie der Gedanke an Falschinformationen durch den Kopf geht, ist nicht voreingenommen, sondern liegt ziemlich richtig. Dies trifft auch für die zu, die der Wirkkraft allgemein gehaltener und wenig sanktionierter gesetzlicher Verpflichtungen zum seriösen und wahrheitsgemäßen Marketing skeptisch gegenüber stehen. Konkret geht es um die Schweiz, in der 2002 explizite gesetzliche Bestimmungen für korrektes Marketingverhalten eingeführt wurde.
Auch Arzneimittelhersteller wissen, dass PatientInnen wie ÄrztInnen Aussagen zu ihren Produkten eher glauben, wenn sie mit Hinweisen auf wissenschaftliche Studien versehen sind, welche die Wirksamkeit der Produkte nachweisen sollen. Wem hier angesichts der zahlreichen nachgewiesenen Manipulationen oder Fälschungen von Arzneimittelstudien durch die Pharmaindustrie der Gedanke an Falschinformationen durch den Kopf geht, ist nicht voreingenommen, sondern liegt ziemlich richtig. Dies trifft auch für die zu, die der Wirkkraft allgemein gehaltener und wenig sanktionierter gesetzlicher Verpflichtungen zum seriösen und wahrheitsgemäßen Marketing skeptisch gegenüber stehen. Konkret geht es um die Schweiz, in der 2002 explizite gesetzliche Bestimmungen für korrektes Marketingverhalten eingeführt wurde.
Die mehrfache Skepsis stützt sich auf das Ergebnis einer Untersuchung von 577 Arzneimittelanzeigen für Arzneimittel gegen Schmerzen, Magen-Darm-Erkrankungen und psychische Erkrankungen, die 2005 in sechs großen schweizerischen medizinischen Fachzeitschriften erschienen sind. Der Anteil dieser Anzeigen an allen Arzneimittelanzeigen belief sich immerhin auf 28% (n=2.068), was gegen den möglichen Einwand spricht, bei den Ergebnissen handle es sich um absolute Randphänomene. In allen Anzeigen wurde mehr oder weniger umfangreich auf vorhandene wissenschaftliche Studien und Publikationen verwiesen, die die Werbeaussage stützen sollten.
Das Ergebnis sieht deutlich anders aus:
• In 56% (n=323) der 577 Anzeigen fand sich mindestens ein Literatur- oder Studienhinweis. Nachdem doppelte Anzeigen und Anzeigen mit letztlich völlig uninformativen Verweisen (trotzdem wurde aber zum Teil der Anschein erweckt, die Werbeaussage sei wissenschaftlich abgesichert) aussortiert wurden, blieben noch 29 Anzeigen mit 78 ausdrücklich durch Verweise abgesicherte Sachbehauptungen für die weitere Untersuchung übrig.
• In weniger als der Hälfte der Anzeigen bzw. der 78 Sachbehauptungen, nämlich 47% (n=37), stimmte die Werbeaussage mit den Inhalten der erwähnten Studien überein.
• Bei 21% der werblichen Sachbehauptungen (n=16) war die Aussage eindeutig falsch bzw. wurden die Leser unter der Annahme, dass die Verfasser die Literatur auf die sie verweisen gelesen haben, bewusst falsch informiert.
• Bei 32% (n=25) fördert der Vergleich von Werbeaussage und angegebener Literatur "einige Zweifel" an der Richtigkeit des Anzeigenversprechens. Dies lag hauptsächlich daran, dass in der Anzeige nur auf das Abstract der Studie verwiesen wurde bzw. nur die Zusammenfassung zitiert wurde. Dabei fielen dann auch Hinweise auf mögliche Verzerrungen oder extrem schwache Unterschiede zwischen dem untersuchten Arzneimittel und Kontrollpräparaten unter den Tisch. Außerdem wurde nur unzureichend über die Methodik der Studie berichtet, denn neben (methodisch fundierten) randomisierten Kontrollstudien finden sich auch einfache und wesentlich beweisschwächere Beobachtungs- oder Praxisstudien.
• Nach allem bisher Gesagten kann es nicht verwundern, dass Referenzstudien, in denen von den beteiligten Wissenschaftlern Interessenskonflikte genannt wurden oder die von Pharmaherstellern finanziert wurden, wesentlich häufiger die Werbeaussage unterstützten als Studien ohne diese beiden Charakteristika (RR 1.52, 95% CI 1.07-2.17 and RR 1.50, 95% CI 0.98-2.28).
Die Schweizer Autoren lassen in der Zusammenfassung ihrer Ergebnisse an praktischer Deutlichkeit nichts zu wünschen übrig: "Following the introduction of new regulations for drug advertisement in Switzerland, 53% of all assessed pharmaceutical claims published in major medical journals are not supported by the cited referenced studies or based on potentially biased study information. In light of the discrepancy between the new legislation and the endorsement of these regulations, physicians should not trust drug advertisement claims even when they seem to refer to scientific studies."
Die neunseitige Studie "Accuracy of drug advertisements in medical journals under new law regulating the marketing of pharmaceutical products in Switzerland" von Macarena Gonzalez Santiago, Heiner C Bucher und Alain J Nordmann, alles Mitarbeiter des "Instituts für klinische Epidemiologie und Biostatistik Basel (BICE)" in Basel, ist bereits 2008 in der Zeitschrift "BMC Medical Informatics and Decision Making 2008, 8:61 doi:10.1186/1472-6947-8-61" erschienen und komplett kostenlos erhältlich.
Geradezu mustergültig ist bei dem Aufsatz über die Studie die lückenlose Dokumentation der Begutachtung des zuerst eingereichten Textes durch namentlich genannte Fachgutachter, der zustimmenden oder ablehnenden Kommentare der Forscher bis hin zu der dann veröffentlichten Variante.
Auch diese so genannte "Pre-publication history" erhält man komplett und kostenlos auf einer Website.
Bernard Braun, 30.6.09
Gesunde zu Kranken machen - das Beispiel Olanzapin (Zyprexa®)
 Olanzapin ist ein Medikament, das zur Behandlung der Schizophrenie und der bipolaren Störung zugelassen ist. Beides sind psychische Störungen, die üblicherweise von Psychiatern behandelt werden. In Deutschland erfolgte die Markteinführung im November 1997. Der Markenname lautet Zyprexa.
Olanzapin ist ein Medikament, das zur Behandlung der Schizophrenie und der bipolaren Störung zugelassen ist. Beides sind psychische Störungen, die üblicherweise von Psychiatern behandelt werden. In Deutschland erfolgte die Markteinführung im November 1997. Der Markenname lautet Zyprexa.
Im Januar 2009 akzeptierte die pharmazeutische Firma Lilly in einem Vergleich eine Strafzahlung von 1,415 Milliarden Dollar wegen unzulässiger Marketingpraktiken. Dies ist die höchste Geldstrafe, die jemals gegen ein Unternehmen verhängt wurde. Erst hatte Lilly die Vergehen abgestritten und dann zugegeben. In einer Arbeit, die in der Juli-Ausgabe von Social Science and Medicine erscheint, analysiert Glen Spielmans interne Dokumente von Lilly, die im Rahmen des Strafverfahrens öffentlich wurden und für jedermann einsehbar sind, z.B. unter dieser Adresse: Furious Seasons - Zyprexa Documents.
In diesen Dokumenten wird deutlich, dass Lilly Olanzapin als eine Art "Breitspektrum-Psychopharmakon" vermarktete. Lilly wollte den Markt für Olanzapin durch den Einbezug von Allgemeinärzten erweitern. Diese sollten Olanzapin an Patienten mit "komplizierter Stimmung" ("complicated mood") verschreiben, ein unscharf beschriebenes Bild mit den Symptomen Angst, Reizbarkeit, Schlafstörungen und Stimmungsschwankungen. Dafür wurden Fallbeispiele konstruiert, die eine große Zielgruppe von Patienten erschließen sollten. Die beschriebenen Symptome entsprachen in keiner Weise den diagnostischen Kriterien eines Störungsbildes des DSM IV. Vielmehr wurden milde und eher unspezifischen Symptome - die auf viele Patienten zutreffen - als behandlungsbedürftig beschrieben, ein Vorgehen, das als "disease mongering" bezeichnet wird (s.a. "Medikament sucht Krankheit" und Osteoporose - kritisch gesehen ).
Mehrere konstruierte Fallbeschreibungen mit Hinweisen für die Pharmavertreter finden sich in dem Lilly-Dokument "Primary Care Sales Force Resource Guide". Darin werden unverblümt die Gesprächstechniken dargestellt, mit denen die Pharmavertreter die Allgemeinärzte zur Verschreibung von Olanzapin bringen sollen - von ausgewogener Information also keine Spur.
Bei der hypothetischen Patientin Donna handelt es sich beispielsweise um eine alleinerziehende Mutter Mitte 30, die in der Praxis mit düsterer Kleidung erscheint und etwas angespannt wirkt. Sie sagt, sie fühle sich in letzter Zeit ängstlich und reizbar. Sie habe heute mehr geschlafen als normal und habe zu Hause und bei der Arbeit Schwierigkeiten, sich zu konzentrieren. Vor einiger Zeit war sie jedoch gesprächig, gehobener Stimmung und hatte berichtet, mit wenig Schlaf auszukommen. Damit seien die vier Kernsymptome von "complicated mood" beschrieben, also Stimmungsschwankungen, Reizbarkeit, Schlafstörungen und Angst und dazu noch Konzentrationsstörungen, Stimmungslabilität, erhöhte Energie, depressive Stimmung, Verlust von Interesse und Agitiertheit. Aufgabe des Vertreters war es, den Arzt dazu zu bewegen, Patienten mit vergleichbaren Beschwerden das "Breitspektrum-Psychopharmakon" zu verschreiben.
Für die Demenz wurde Olanzapin nie zugelassen. Lilly drängte jedoch in diesen Indikationsbereich und konstruierte hypothetische Patienten, deren Symptome einer Demenz entsprachen.
Durch die erfolgreichen Marketingbemühungen von Lilly haben viele Patienten eine Behandlung erhalten, für die keine Indikation bestand. Zu den möglichen unerwünschten Wirkungen von Olanzapin zählen eine ausgeprägte Gewichtszunahme, die Auslösung eines Diabetes sowie bei älteren Patienten die Erhöhung des Schlaganfallrisikos.
In einer Pressemitteilung vom 15.1.2009 äußert der Vorsitzende von Lilly, dass er das Fehlverhalten seiner Firma zutiefst bedauere.
Glen I. Spielmans. The promotion of olanzapine in primary care: An examination of internal industry documents. Social Science & Medicine. Juli 2009 Abstract
David Klemperer, 20.6.09
Interessenkonflikte sind in der Krebsforschung weit verbreitet
 Ein erheblicher Anteil der Studien über Krebs wird von der Industrie finanziert. Diese Studien gelangen häufiger zu Ergebnissen, die für die Industrie positiv sind, als Industrie-unabhängige Studien. Zu diesem Ergebnis kommt eine Analyse aller Krebsstudien, die im Jahr 2006 in acht renommierten Fachzeitschriften erschienen sind. Die Arbeit erscheint am 15. Juni in CANCER, einer führenden Fachzeitschrift im Bereich Krebs.
Ein erheblicher Anteil der Studien über Krebs wird von der Industrie finanziert. Diese Studien gelangen häufiger zu Ergebnissen, die für die Industrie positiv sind, als Industrie-unabhängige Studien. Zu diesem Ergebnis kommt eine Analyse aller Krebsstudien, die im Jahr 2006 in acht renommierten Fachzeitschriften erschienen sind. Die Arbeit erscheint am 15. Juni in CANCER, einer führenden Fachzeitschrift im Bereich Krebs.
Die Autoren durchsuchten folgende Journale nach Arbeiten zum Thema Krebs: New England Journal of Medicine; JAMA; the Lancet; the Journal of Clinical Oncology; the Journal of the National Cancer Institute; Lancet Oncology; Clinical Cancer Research; und CANCER. Dabei fanden sie 1.534 Studien. In 29% dieser Studien waren Interessenkonflikte angegeben (Industriefinanzierung; Beratungshonorare für Autoren; Mitverfasser, der Angestellter eines pharmazeutischen Unternehmens ist; u.a.). In 17% wurde eine Finanzierung durch die Industrie angegeben.
Die Studien deckten unterschiedliche Herkunftsregionen und ein breites Themenspektrum ab. Der Anteil der Arbeiten mit Interessenkonflikten und Industriefinanzierung war dabei unterschiedlich.
Interessenkonflikte wurden angegeben bei Studien
• aus der klinisch-medizinischen Onkologie in 45%, aus der diagnostischen Radiologie in 4%
• aus den USA in 33%, aus Europa in 27%, aus Asien in 5%;
• mit männlichen Erstautoren in 37%, mit weiblichen Erstautorinnen in 20%
Randomisierte kontrollierte Studien zur Frage der Lebensverlängerung, bei denen ein Interessenkonflikt angegeben war, gelangten häufiger zu positiven Ergebnissen (29%), als unabhängige Studien (14%). Dies ist von besonderer Bedeutung, weil von diesen Studien die Zulassung zur Anwendung in der Krebsbehandlung abhängt.
Die meisten Industrie-finanzierten Studien befassten sich mit der Behandlung (62%). Die Inudtrie-unabhängigen Studien befassten sich häufiger mit Fragen der Prävention, der Risikofaktoren und der Epidemiologie.
Das Fazit dieser Studie lautet, dass die Industrie einen wesentlichen finanziellen Beitrag zur onkologischen Forschung leistet, dabei die Fragestellungen untersuchen lässt, die für ihre Zwecke bedeutsam sind (Behandlung, nicht Prävention) und häufiger die Ergebnisse erhält, die für sie nützlich sind als dies bei Industrie-unabhängigen Studien der Fall ist. Da die Studie auf den veröffentlichten Selbstangaben der Autoren beruht, wird der Einfluss der Industrie vermutlich unterschätzt, denn nicht jede Zeitschrift veröffentlicht alle Angaben der Autoren und nicht jeder Autor gibt seine Interessenkonflikte an.
Die Frage, warum die Ergebnisse häufiger als bei unabhängigen Studien im Industrieinteresse sind, wurde hier nicht untersucht. Aus anderen Studien ist bekannt, dass negative Studien zurückgehalten werden (publication bias) oder der Studienplan von vornherein so gestaltet wurde, dass positive Ergebnisse wahrscheinlicher wurden oder negative Ergebnisse positiv interpretiert wurden (s.a. Geschöntes Bild neuer Medikamente in medizinischen Fachzeitschriften). Auch Betrug kommt vor (siehe Lug und Trug in der Wissenschaft).
Diese Studie weist - wie mittlerweile zahlreich andere Studien - auf die Notwendigkeit eines größeren Abstands zwischen medizinischem Forschungsbetrieb und Industrie hin. Derzeit werden in großem Umfang Forschungsergebnisse generiert, denen nicht vertraut werden kann.
Jagsi R, Nathan Sheets, Aleksandra Jankovic, Amy R. Motomura, Sudha Amarnath, Ubel PA. Frequency, nature, effects, and correlates of conflicts of interest in published clinical cancer research. CANCER. Abstract der Studie
Diese folgende wegweisene Studie aus dem Jahr 2003 untersuchte die Frage der Interessenkonflikte für den gesamten Bereich der medizinischen Forschung:
Scope and Impact of Financial Conflicts of Interest in Biomedical Research. Bekelman JE, Li Y, Gross CP. Journal of the American Medical Association. Volltext
David Klemperer, 6.6.09
Transparenz à la Vermont - Was und wie viel bekommen Ärzte von Arzneimittelherstellern und wie verhindert man dies möglichst?
 Nach einem im April 2009 vom Generalanwalt des US-Bundesstaates Vermont veröffentlichten Bericht berichteten Pharmafirmen, sie hätten im Steuerjahr 2008 2.935.248 US-$ an die in diesem Bundessstaat agierenden Ärzte, Krankenhäuser und Universitäten an Zuschüssen, Reisekosten und andere direkte Zahlungen bezahlt. Dazu gehörten nach Untersuchungen derselben Regierungseinrichtungen so genannte "kickbacks" an die Ärzte, deren Höhe sich an dem Umsatz von verordneten Medikamenten orientierte und die "all-expense-paid trips, false consulting attangements, meals, and other gifts" umfasste.
Nach einem im April 2009 vom Generalanwalt des US-Bundesstaates Vermont veröffentlichten Bericht berichteten Pharmafirmen, sie hätten im Steuerjahr 2008 2.935.248 US-$ an die in diesem Bundessstaat agierenden Ärzte, Krankenhäuser und Universitäten an Zuschüssen, Reisekosten und andere direkte Zahlungen bezahlt. Dazu gehörten nach Untersuchungen derselben Regierungseinrichtungen so genannte "kickbacks" an die Ärzte, deren Höhe sich an dem Umsatz von verordneten Medikamenten orientierte und die "all-expense-paid trips, false consulting attangements, meals, and other gifts" umfasste.
Nach diesen Angaben waren von den 4.573 zur Gesundheitsversorgung zugelassene Akteuren 2.280 Empfängern von derartiger Zahlungen. Mindestens 2,1 Mio US-$ gingen an Ärzte, wobei sich der größte Teil der Zahlungen, nämlich 1,77 Mio $ auf gerade einmal 100 individuelle Empfänger konzentrierte. Anders auagedrückt, erhielten 4% der Ärzte rund 60% aller Industriegeschenke.
Von diesen Enthüllungen der Arzneimittelhersteller waren lediglich 17% der Öffentlichkeit verfügbar - wegen des bisher geltenden Handelsgeheimnisses.
Nach Bekanntwerden der Recherchen der Staatsanwaltschaft Vermonts und der Überlegungen, das Problem gesetzlich in Angriff nehmen zu wollen, beschloss der Pharmaindustrieverband "Pharmaceutical Research and Manufacturers of America (PhRMA)" im Januar 2009 einen freiwilligen Code, der seinen Unterstützern verbietet, Geschenke an Ärzte zu machen, die nicht deren Weiterbildung dienen und die Einladung zu opulenten Dinners begrenzt. Nach Recherche der New York Times (19.Mai 2009) sind haben sich dem Code bisher 50 Hersteller angeschlossen.
Zyniker in allen, also auch dem deutschen Gesundheits- und Marketing-Alltag könnten bis zu diesem Punkt die Achseln zucken, resignativ "business as usual" murmeln und sich in der kritischen Sicht aber folgenlosen derartiger "Landschaftspflege" der Pharmahersteller bestätigt sehen.
Die politisch Verantwortlichen im Nordosten der USA gingen einen Schritt weiter und verabschiedeten nun ein Gesetz, das zum 1.Juli 2009 in Kraft treten soll und folgende bemerkenswerte Maßnahmen beinhaltet:
• Alle Hersteller müssen eine Liste darüber erstellen, welchen Ärzten und anderen Erbringern gesundheitsbezogenen Leistungen sie welche Gelder und geldwerten Geschenke zugeführt haben und die konkreten Beträge zusammen mit den Namen und der Höhe der Summe jährlich veröffentlichen.
• Die Liste muss Rückschlüsse ermöglichen, welcher Chirurg, der Stents, künstliche Gelenke oder ein Medikament implantierte oder verordnete, welche Zuwendungen von Herstellern dieser Mittel erhalten haben.
• Das Gesetz verbietet zum ersten Mal in den USA mit dem kostenlosen Essen eine der wichtigsten Marketingmaßnahmen und schließt auch die lange missbrauchte Lücke, diese Zahlungen als privat und vertraulich hinter dem Mantel des Handelsgeheimnis zu verbergen.
Die mit diesem Gesetz verbundenen Erwartungen und anvisierten Ziele fasst die Begründung des Gesetzes so zusammen: "This act is necessary to increase transparency for consumers by requiring disclosure of allowable expenditures and gifts to health care providers and facilities providing health care. This act is also necessary to reduce real or perceived conflicts of interest which undermine patient confidence in health care providers and increase health care costs by influencing prescribing patterns. Limitations on gifts and increased transparency are expected to save money for consumers, businesses, and the state by reducing the promotion of expensive prescription drugs, biological products, and medical devices, and to protect public health by reducing sales-oriented information to prescribers."
Dass die Initiatoren des freiwilligen Verhaltenscode durch diese gesetzlichen Bestimmungen ihre Freiheit gefährdet sehen, war erwartbar und ihr Verhalten versucht die Transparenz über Geber und Nehmer möglichst gering zu halten.
Den Text der Begründung und die wichtigsten Passagen des dann doch verabschiedeten Gesetzes des Bundesstaates Vermont gibt es kostenlos.
Ein Artikel "Vermont Acts to make drug makers' gifts public" ist in der Internet-Ausgabe der "New York Times (NYT)" vom 19. Mai 2009 in ganzer Länge kostenlos erhältlich.
Bernard Braun, 21.5.09
USA: Institute of Medicine fordert offensiven Umgang mit Interessenkonflikten im Gesundheitswesen
 Ende April hat das US-amerikanische Institute of Medicine (IOM) einen Bericht über Interessenkonflikte in der Medizin veröffentlicht. Der Bericht wurde von einem 17-köpfigen Komitee verfasst und richtet sich an die wissenschaftliche und medizinische Öffentlichkeit, an die Industrie, die Nutzer, die Medien und and die Politik. Die Autoren beschreiben das Problem der Interessenkonflikte umfassend und bieten Lösungen an.
Ende April hat das US-amerikanische Institute of Medicine (IOM) einen Bericht über Interessenkonflikte in der Medizin veröffentlicht. Der Bericht wurde von einem 17-köpfigen Komitee verfasst und richtet sich an die wissenschaftliche und medizinische Öffentlichkeit, an die Industrie, die Nutzer, die Medien und and die Politik. Die Autoren beschreiben das Problem der Interessenkonflikte umfassend und bieten Lösungen an.
Auf den 355 Seiten geht es um
• eine Definition von Interessenkonflikt
• Grundsätze zum Erkennen und zur Bewertung von Interessenkonflikten
• Regelungen zu Interessenkonflikten
• Interessenkonflikte in der biomedizinischen Forschung
• Interessenkonflikte in der Aus-, Fort- und Weiterbildung
• Interessenkonflikte in der medizinischen Praxis
• Interessenkonflikte und Entwicklung von Leitlinien
• Institutionelle Interessenkonflikte
• die Rolle von unterstützenden Organisationen
Die Definition des IOM lautet: "Conflicts of interest are defined as circumstances that create a risk that professional judgments or actions regarding a primary interest will be unduly influenced by a secondary interest." Interessenkonflikte werden also als Sachverhalte definiert, die einen Konflikt zwischen primären und sekundären Interessen verursachen, wobei die Gefahr darin besteht, dass Urteilsvermögen und Handlungen unangemessen beeinflusst werden. So ist das primäre Interesse ärztlichen Handelns das Wohl des Patienten und die dafür erforderliche bestmögliche Behandlung. Ein sekundäres Interesse mit unangemessener Wirkung auf das Patientenwohl können finanzielle Anreize sein, die dem Arzt eine Behandlung attraktiv erscheinen lassen, welche nicht die bestmögliche ist. Eine detaillierte Darlegung und Analyse dieses von Dennis Thompson entwickelten Konzepts von Interessenkonflikt findet sich in dem Schwerpunktheft "Interessenkonflikte und Beeinflussung" der Zeitschrift für Evidenz, Fortbildung und Qualität im Gesundheitswesen. Thompson ist Mitglied des IOM-Komitees.
Das Komitee nennt einige übergeordnete Schlussfolgerungen seiner Untersuchung (Summary S. 4):
1. Das Ziel von Regelungen zu Interessenkonflikten ist es, die Integrität der professionellen Urteilsfähigkeit zu schützen und das Vertrauen der Öffentlichkeit zu bewahren und nicht erst dann aktiv zu werden, wenn Probleme aufgetreten sind.
2. Die Offenlegung individueller und institutioneller Interessenkonflikte ist ein notwendiger aber nicht ausreichender erster Schritt im Prozess des Erkennens von Interessenkonflikten und im Umgang damit.
3. Regelungen und Bestimmungen zu Interessenkonflikte sind wirksamer, wenn die Betroffenen an ihrer Entwicklung beteiligt sind.
4. Die betroffenen Institutionen und Organisationen können gemeinsam Anreize schaffen, Regelungen für Interessenkonflikte einzuführen, die den Empfehlungen des IOM-Komitees folgen.
5. Forschung ist erforderlich, um mehr Evidenz über die Wirksamkeit von Regelungen zu Interessenkonflikte zu generieren.
6. Die medizinischen Institutionen und Organisationen sollten freiwillig handeln, ansonsten ist zu erwarten, dass der Staat tätig wird.
Hier ein Auszug aus den 16 Empfehlungen (Summary S12-S17):
• Alle Einrichtungen, die mit medizinscher Forschung, Aus-, Fort- und Weiterbildung oder Leitlinienentwicklung befasst sind, sollten Regelungen schaffen, die mit den Grundsätzen des IOM-Berichts übereinstimmen. (Empfehlung 3.1)
•Interessenkonflikte sollten spezifisch und umfassend offengelegt werden, es sollte keine Untergrenze für Zuwendungen festgelegt werden. (Empfehlung 3.2)
• Es sollte ein Standard für Inhalt, Format und Vorgehensweisen bezüglich finanzieller Interessenkonflikte in Verbindung mit der Industrie im Rahmen einer Konsensfindung auf nationaler Ebene festgelegt werden. (Empfehlung 3.3)
• Der Gesetzgeber sollte die Industrie dazu verpflichten, alle Zahlungen an Ärzte, Wissenschaftler, Fachgesellschaften, Selbsthilfegruppen, Patientengruppen und Anbietern von Fortbildung öffentlich zu machen. (Empfehlung 3.4)
• Forschungseinrichtungen sollten Wissenschaftler von der Forschung am Menschen grundsätzlich ausschließen, die bedeutsame finanzielle Interessen an einem Produkt haben, das erforscht wird. (Empfehlung 4.1)
• Ärzte, Medizinstudenten und Ausbildungseinrichtungen sollten keinerlei Geschenke von der Industrie annehmen, auch keine kleinen Geschenke wie Kugelschreiber und Schreibblöcke. (Empfehlung 5.1, 6.1) Die Industrie sollte keine Geschenke anbieten. (Empfehlung 6.2)
• Ein neues System der Finanzierung von Fortbildung sollte geschaffen werden, das frei ist vom Einfluss der Industrie. (Empfehlung 5.3)
• Gruppen, die Leitlinien erarbeiten, sollten grundsätzlich die Mitgliedschaft von Personen mit Interessenkonflikten ausschließen. Es sollte keine finanzielle Unterstützung der Industrie angenommen werden. Ist die Beteiligung eines Experten mit Interessenkonflikte wegen dessen Expertise unvermeidbar, sollten Restriktionen gelten (Vorsitzender ohne Interessenkonflikte, Mitglieder mit Interessenkonflikte müssen Minderheit bilden, Ausschluss von der Beratung, der Abfassung und der Beschlussfassung zu Empfehlungen). (Empfehlung 7.1)
• Das Gesundheitsministerium sollte ein Forschungsprogramm entwickeln und fördern, um die Auswirkungen von Interessenkonflikte auf die Qualität medizinscher Forschung, auf die Aus-, Fort- und Weiterbildung, auf die Praxis der Medizin und auf die Leitlinienentwicklung zu erfassen und um die Effekte von Interessenkonflikt-Regelungen auf diese Bereiche zu untersuchen. (Empfehlung 9.2)
Der Bericht ist inhaltlich und politisch umfassend und wegweisend und anregend für die in Deutschland langsam an Schwung gewinnende Befassung mit dem Thema. Offen ist, inwieweit die angesprochenen Institutionen und Personen seine Empfehlungen aufgreifen und umsetzen.
Institute of Medicine. Conflict of Interest in Medical Research, Education, and Pracice.
• Executive Summary Download
• Volltext: Download als PDF seit Mai 2011 kostenlos nach einer unkomplizierten Registrierung Website
Derek Thompson. The Challenge of Conflict of Interest in Medicine ZEFQ, Heft 3, Mai 2009. Dieser Aufsatz ist ein Update seiner grundlegenden Definition aus dem Jahr 1993.
Schwerpunktheft Interessenkonflikte und Beeinflussung. Zeitschrift für Evidenz, Fortbildung und Qualität im Gesundheitswesen, Mai 2009. Editorial.
Website zum Thema Interessenkonflikte
David Klemperer, 17.5.09
Marketing für Medikamente wirkt - selbst in subtiler Dosis
 Als starke Marke etablierte Produkte sind stärker im Bewusstsein verankert und den Käufern gegenwärtiger als konkurrierende Produkte. Bei der Wahl zwischen zwei oder mehr Produkten kann sich dies unbewusst auf die Kaufentscheidung auswirken. In einer amerikanischen Studie wurde jetzt untersucht, ob sich dieses Prinzip auf den Medikamentenbereich übertragen lässt.
Als starke Marke etablierte Produkte sind stärker im Bewusstsein verankert und den Käufern gegenwärtiger als konkurrierende Produkte. Bei der Wahl zwischen zwei oder mehr Produkten kann sich dies unbewusst auf die Kaufentscheidung auswirken. In einer amerikanischen Studie wurde jetzt untersucht, ob sich dieses Prinzip auf den Medikamentenbereich übertragen lässt.
Die Hypothesen der Forscher lauteten:
1. Medizinstudenten, die einem Objekt ausgesetzt sind, das Werbung für eine Marke trägt, zeigen eine positivere Haltung gegenüber dem Produkt durch die Bahnung positiver Assoziationen als Medizinstudenten einer Vergleichsgruppe.
2. Die restriktive Politik einer Universität in Bezug auf pharmazeutisches Marketing mindert diesen Effekt durch die erhöhte Sensibilität für die Beeinflussungstaktiken.
Zur Beantwortung dieser Frage führten die Forscher eine randomisierte kontrollierte Studie durch. 352 Medizinstudenten im 3. und 4 Studienjahr aus zwei Universitäten wurden nach dem Zufallsprinzip in zwei Gruppen eingeteilt. Eine der Universitäten (University of Pennsylvania School of Medicine) verfolgt einen restriktiven Umgang mit Pharmavertretern. Geschenke, Mahlzeiten und Medikamentenmuster sind verboten. Die andere Universität (University of Miami Miller School of Medicine) lässt diese Marketingbemühungen zu.
Die Studenten kannten den eigentlichen Zweck der Studie nicht, sie wussten nur, dass es um klinische Entscheidungsfindung ging.
Alle Studenten mussten einige schriftliche Angaben auf einem Notizbogen machen und anschließend den Implicit Association Test (s.u.) am Computer durchführen. Die Exposition bestand darin, dass auf dem Notizbogen einer der beiden Gruppen der Name und das Logo des Blutfettsenker Lipitor® (in Deutschland Sortis®, Substanz: Atorvastatin) angebracht war, ebenso auf dem Klemmbrett, auf dem der Notizbogen befestigt war. In der Kontrollgruppe waren Klemmbrett und Notizpapier neutral.
In dem Test ging es um den Vergleich von Lipitor® mit dem Konkurrenzprodukt Zocor® (Substanz: Simvastatin) einem medizinisch zumindest gleichwertigen Blutfettsenker.
Der Implicit Association Test (IAT) misst unbewusste Haltungen und Bewertungen. Der IAT ist in der psychologischen Forschung und im Marketing weit verbreitet. Aufgabe des Probanden ist es, Objekten Merkmale zuzuordnen, ohne dabei Bedenkzeit zu haben. Der Vergleich der Reaktionszeiten bei der Zuordnung von Merkmalen zu zwei zu vergleichenden Objekten erlaubt Rückschlüsse über die implizite Haltung des Probanden. Beispiele für den IAT finden sich auf einer Website der Harvard University.
Die explizite Haltung der Studenten wurde mit einem Fragebogen erfasst, auf dem sie Lipitor® und Zocor® nach mehreren Dimensionen bewerteten
Die Tests zeigten, dass alle Studenten Lipitor® positiver bewerteten als Zocor®, also auch die Studenten der Kontrollgruppe. Unterschiede ergaben sich zwischen den beiden Universitäten. In Miami (wenig restriktiv bezüglich Pharma-Marketing) zeigten die exponierten Studenten eine stärkere Bevorzugung von Lipitor als die Kontrollen. In Penn (restriktiv bezüglich Pharma-Marketing ) hingegen zeigten die exponierten Studenten eine geringere Bevorzugung als die Kontrollstudenten.
Die Studie zeigt, dass bereits eine subtile Werbung für ein Medikament wirksam ist. In einem Umfeld, dass die gängigen Methoden des Pharmamarketings zulässt, wird die positive Bewertung eines Medikaments verstärkt. Sind Geschenke und gesponserte Mahlzeiten verboten, kehrt sich der Effekt um - die positive Bewertung wird abgeschwächt.
Die Rahmenbedingungen wirken sich offensichtlich stark darauf aus, wie Studenten das Marketing der Industrie einschätzen. In Miami (nicht restriktiv) halten 86% der Studenten Industrie-gesponserte Veranstaltungen für hilfreich und fortbildend, in Penn (restriktiv) 52%. In Miami verneinen 67%, dass Geschenke sie bei der Verschreibung von Medikamenten zugunsten des Produkts der schenkenden Firma beeinflussen könnten, in Penn 29%.
Diese Studie bestätigt und erweitert das vorhandene Wissen darum, wie Ärzte von der Industrie beeinflusst werden. Das Besondere an dieser Studie ist die Untersuchung einer eher schwachen Exposition (Anblick des Namens und Logos eines Medikaments) und der Nachweis der Auswirkung auf die implizite, also eher unbewusste Bewertung. Weiterhin ist hervorzuheben, dass die Auswirkung der Exposition gegensätzlich war, je nach Umfeld. Ein Pharmamarketing-freundliches Umfeld verbessert und ein kritisches Umfeld verschlechtert die Bewertung eines Medikaments.
Fazit aus dieser Studie sollte sein, werbende Einflüsse auf Ärzte so weit wie möglich zu unterbinden, damit sie ihren Patienten die besten und nicht die am stärksten beworbenen Medikamente verordnen. Ein Blick auf die umsatzstärksten Medikamente in Deutschland zeigt, dass Ärzte häufig stark beworbene Medikamente verordnen, auch wenn gleichwertige, teils sogar überlegene Medikamente zur Verfügung stehen, die stets preiswerter sind. Unter den 15 umsatzstärksten Medikamenten befinden sich 6 Präparate, die als Variante ohne besonderen Stellenwert und 5 Präparate, die als umstrittene Mittel bewertet werden.
GRANDE, D., FROSCH, D. L., PERKINS, A. W. & KAHN, B. E. (2009) Effect of Exposure to Small Pharmaceutical Promotional Items on Treatment Preferences. Arch Intern Med, 169, 887-893. Abstract der Studie
ARZNEI-TELEGRAMM (2008) 1997 und 2007 im Vergleich - die umsatzstärksten Arzneimittel. Arznei-telegramm, 39, 65-66. Tabelle
David Klemperer, 14.5.09
Befreiung vom Einfluss der Industrie - Forderungen an Medizinische Fachgesellschaften
 Einen größeren Abstand zur Industrie fordert eine Gruppe von 11 namhaften Autoren in einem Positionspapier von den medizinischen Fachgesellschaften. Die Unabhängigkeit der Fachgesellschaften sei derzeit durch enge Beziehungen und teils hohe finanzielle Zuwendungen in Frage gestellt. Wegen ihrer Bedeutung für die Fortbildung, die Leitlinienerstellung, die Erstellung ethischer Normen und die Formulierung politischer Forderungen müssten sie ihre Integrität und Glaubwürdigkeit durch stringente Regelungen zu Interessenkonflikten sicherstellen.
Einen größeren Abstand zur Industrie fordert eine Gruppe von 11 namhaften Autoren in einem Positionspapier von den medizinischen Fachgesellschaften. Die Unabhängigkeit der Fachgesellschaften sei derzeit durch enge Beziehungen und teils hohe finanzielle Zuwendungen in Frage gestellt. Wegen ihrer Bedeutung für die Fortbildung, die Leitlinienerstellung, die Erstellung ethischer Normen und die Formulierung politischer Forderungen müssten sie ihre Integrität und Glaubwürdigkeit durch stringente Regelungen zu Interessenkonflikten sicherstellen.
Zu den Autoren zählen die Herausgeberin des Journal of the American Medical Association, der Leiter der National Institutes of Health sowie namhafte Vertreter amerikanischer medizinischer Fachgesellschaften.
Hier ein Überblick über die Forderungen.
Haushalt der Fachgesellschaften
Der Haushalt von Fachgesellschaften soll keine Zuwendungen der Industrie enthalten (0 Dollar). Zur Umsetzung sind Zwischenschritte erforderlich, wie z.B.:
•die Zuwendungen sollen ohne Bedingungen gewährt werden und in einen Pool fließen
•der Anteil von Industriegeldern am Haushalt soll nicht höher als 25% sein
•der Anteil einer einzelnen Firma soll nicht mehr als die Hälfte der Industriegelder ausmachen.
Zu welchem Anteil sich Fachgesellschaften durch die Industrie finanzieren, ist unbekannt. Es bestehen keine Vorschriften zur Offenlegung.
Jahrestagungen und wissenschaftliche Konferenzen
Es ist eine allgemein geübte Praxis, dass Industrieunternehmen Tagungen der Fachgesellschaften finanziell unterstützen. Die Finanzierung soll künftig vermehrt aus neutralen Quellen sowie aus Eigenbeteiligung Mitglieder erfolgen. Die Mitglieder der Programmkomitees sollen strikten Regelungen zu Interessenkonflikten unterliegen. Standard sollte möglichst nicht nur die Offenlegung sondern die Freiheit von Verbindungen zur Industrie sein.
Industrieausstellungen sollen auf Stände beschränkt sein, die örtlich in abgrenzten Bereichen platziert sind und nicht am Weg zu wissenschaftlichen Veranstaltungen liegen. Geschenke sollen nicht verteilt werden.
Fachgesellschaften sollen Begleitveranstaltungen der Industrie, wie z.B. Sateliten-Symposien, auf keine Weise unterstützen und - falls erforderlich - verhindern.
Zuwendungen der Industrie für Forschung
Gelder der Industrie für Forschung sollen in einen zentral verwalteten Topf der Fachgesellschaft fließen. Das Einbringen bzw. die Finanzierung spezifischer Forschungsvorhaben durch die Industrie soll nicht zulässig sein. Entscheidungen über die Vergabe von Forschungsmitteln sollen ohne jegliche Industriebeteiligung getroffen werden. Allein die Fachgesellschaften und die Forscher sollen über die Daten verfügen und über die Publikation entscheiden.
Leitlinienerstellung
Am Verfassen von Leitlinien sollten nur Personen beteiligt sein, die keinerlei Verbindung zur Industrie haben. Die Offenlegung von Interessenkonflikten bietet keinen ausreichenden Schutz vor der Beeinflussung im Sinne der Industrieinteressen. Strikte Regeln sind erforderlich, weil Leitlinien die evidenzbasierte Grundlage für die Behandlungsentscheidungen darstellen sollen. Dem Argument, die höchst qualifizierten Experten eines Bereiches würden dadurch von der Leitlinienerstellung ausgeschlossen, entgegnen die Autoren: die als am höchsten qualifiziert geltenden Wissenschaftler seien häufig lediglich die in der Öffentlichkeit sichtbarsten; zudem dürften auch diese Wissenschaftler Stellungnahmen zu Entwürfen abgeben. Entscheidend sei, dass die Verfasser einer Leitlinie unabhängig sind.
Unterstützung von Produkten
Fachgesellschaften sollen in keinem Fall den Verkauf von Produkten unterstützen, z.B. durch Aufdruck ihres Logos. Diese Praxis wird in den USA von einigen Fachgesellschaften ausgeübt, deren Logo dann auf Lebensmitteln, Zahnpasta und Sonnencremes zu finden sind. Dafür erhalten sie hohe Summen von den Herstellern.
Zugehörige Organisationen
Organisationen, die der Fachgesellschaft zugehörig sind, wie z.B. Stiftungen und Akademien sollen ihre Unabhängigkeit nach den selben Regeln wie Fachgesellschaft selbst bewahren bzw. herstellen.
Interessenkonflikte von Vorstandsmitgliedern
Für die Führungspersonen sollen die striktesten Regeln für Interessenkonflikte gelten.
Als Minimalstandard sollen der aktuelle, der letzte und der künftige Vorsitzende bzw. Präsident, die Mitglieder des Vorstands und die Geschäftsführung für die Zeit ihrer Amtsführung frei von Interessenkonflikten sein (Null-Dollar-Grenze). Etwaige vorhandene finanzielle Verbindungen zur Industrie sollten frühzeitig aufgelöst werden, wenn möglich 2 Jahre vor Beginn einer Amtszeit.
Auch die Mitarbeiter der Fachgesellschaften sollen keine finanziellen Verbindungen zur Industrie haben, die Annahme von Geschenken soll ihnen verboten werden.
Alle interne Aktivitäten sollen allein von der Fachgesellschaft finanziert werden, wie Kosten für Meetings, Reisen usw.
Jede Fachgesellschaft soll über Vorgehensweisen zur Überprüfung von Interessenkonflikten verfügen. Individuelle Fälle sollen z.B. durch ein Ethikkomitee überprüft werden. Formulare zur Erklärung von Interessenkonflikten sollen detailliert und explizit sein und Aktivitäten sowie erhaltene Geldsummen abfragen.
Empfehlungen für Mitglieder
Die Fachgesellschaften sollen die Prinzipien und Standards, mit denen sie institutionellen Interessenkonflikten begegnen, ihren Mitgliedern zur Minderung individueller Interessenkonflikte nahelegen. Die ethischen Anforderungen an die Organisation gelten auch für die individuellen Mitglieder der Organisation.
Die Verfasser selbst bezeichnen ihre Empfehlungen als rigoros. Integrität erfordere Opfer. Von Seiten einiger Fachgesellschaften rechneten sie mit Widerspruch. Innerhalb der Ärzteschaft und auch von Seiten der Politik würden aber zunehmend grundlegende Reformen gefordert, weil lange geübten Praktiken der Fachgesellschaften ihre Integrität untergraben und den Interessen der Patienten schaden.
Rothman, David J et al. Journal of the American Medical Association. Professional Medical Associations and Their Relationships With Industry: A Proposal for Controlling Conflict of Interest. 1.4.2009. Abstract
David Klemperer, 3.4.09
Erfundene Daten, hohe Umsätze. Wissenschaftler fordern industrieunabhängige Studien
 "Er war einer der profiliertesten Forscher im Bereich der Behandlung von postoperativem Schmerz. Sein Betrug wirft uns in unserem Wissen enorm zurück." So äußerte sich der Herausgeber der amerikanischen Fachzeitschrift Anesthesia & Analgesia in der New York Times vom 11.3.2009, nachdem bekannt geworden war, dass der Anästhesist und Schmerzforscher Scott S. Reuben die Daten für mindestens 21 Veröffentlichungen seit 1996 frei erfunden hat. Die Verlässlichkeit weiterer 52 Publikationen ist ungewiss. Reuben erhielt u.a. in den Jahren 2002 bis 2007 Zuwendungen von pharmazeutischen Firma Pfizer für die Untersuchung der Substanzen Celecoxib (Celebrex®) und Pregabalin (Lyrica®).
"Er war einer der profiliertesten Forscher im Bereich der Behandlung von postoperativem Schmerz. Sein Betrug wirft uns in unserem Wissen enorm zurück." So äußerte sich der Herausgeber der amerikanischen Fachzeitschrift Anesthesia & Analgesia in der New York Times vom 11.3.2009, nachdem bekannt geworden war, dass der Anästhesist und Schmerzforscher Scott S. Reuben die Daten für mindestens 21 Veröffentlichungen seit 1996 frei erfunden hat. Die Verlässlichkeit weiterer 52 Publikationen ist ungewiss. Reuben erhielt u.a. in den Jahren 2002 bis 2007 Zuwendungen von pharmazeutischen Firma Pfizer für die Untersuchung der Substanzen Celecoxib (Celebrex®) und Pregabalin (Lyrica®).
Mit seinen Veröffentlichungen hat er wesentlich zum positiven Erscheinungsbild nicht nur dieser beiden Medikamente beigetragen. Auch dürfte der Beitrag seiner gefälschten Studien für das erfolgreiche Marketing dieser Medikamente bedeutsam sein. Offensichtlich ist hier ein Wissenschaftler der Versuchung erlegen, im Hinblick auf eigenen Vorteil seinem Auftraggeber günstige Ergebnisse abzuliefern.
Der Betrug kam durch eine Untersuchung an seinem Arbeitsplatz im Baystate Medical Center in Springfield, Mass. zutage, nachdem aufgefallen war, dass Reuben für 2 neue Studien keine Genehmigung hatte.
Wenig ermutigend ist es, dass die meisten Betrugsfälle unentdeckt bleiben dürften, wie Richard Smith vergangenes Jahr im British Medical Journal berichtete. Eine Schätzung auf Grundlage einer Befragung von Wissenschaftlern (veröffentlicht in der renommierten Zeitschrift Nature, wir berichteten) kommt zum Ergebnis, dass nur etwa ein Prozent der Fälle von schweren Vergehen aufgedeckt wird.
Über fragwürdige Praktiken in der Publikation von Studien hatten wir zuletzt mehrfach berichtet, so über "Fehlinformation und Manipulation am Beispiel des Medikamentes Gabapentin", über die sachlich nicht haltbare, aber für Marketingzwecke förderliche Begriffsbildung "Neuroleptika der 2. Generation" und darüber, wie die Autoren neue Medikamenten in Fachzeitschriften sehr viel positiver darstellen als sie in den Unterlagen für die behördliche Zulassung erscheinen ("Geschöntes Bild neuer Medikamente in medizinischen Fachzeitschriften").
Eine Stärkung einer an den Bedürfnissen der Patienten orientierten Forschung haben die European Medical Research Councils in einem am 12.3.2009 veröffentlichten Bericht gefordert. Der Bericht trägt den Titel "Investigator-Driven Clinical Trials", womit Studien gemeint sind, die von Wissenschaftlern initiiert werden und nicht von der Industrie. Das Gremium, in dem auch die Deutsche Forschungsgemeinschaft vertreten ist, stellt fest, dass es einen Mangel an Forschung zu medizinischen Fragen gibt, die nicht mit kommerziellen Interessen verbunden sind oder diesen gar zuwiderlaufen. Diesen Mangel sehen die Autoren z.B. bei der Behandlung seltenen Krankheiten, bei der Prüfung, welches von zwei oder mehreren Medikamente das bessere ist, bei der langfristigen Sicherheit von Medikamente, bei Behandlungsergebnissen, die für den Patienten bedeutsam sind, bei Teilgruppen der Bevölkerung wie Kindern und Alten (S.7). In erster Linie Regierungen aber auch wohltätige Stiftungen sollen zur Finanzierung beitragen.
New York Times 9.3.2009. Doctor Admits Pain Studies Were Frauds, Hospital Says Download
European Medical Research Councils. Looking Foward. Investigator-Driven Clinical Trials. Download
David Klemperer, 21.3.09
EU-Parlament muss über Werbung für rezeptpflichtige Arzneimittel entscheiden
 Am 10. Dezember 2008 verabschiedeten die EU-Kommissare einen Richtlinien-Vorschlag zum so genannten Arzneimittelpaket. Auch wenn das Werbeverbot für rezeptpflichtige Arzneimittel formell erhalten bleibt, wird es systematisch durchlöchert: Arzneimittelhersteller sollen künftig auf allgemein zugänglichen Internetseiten oder in Printmedien Informationen zu Gesundheit, Krankheit und rezeptpflichtigen Arzneimitteln verbreiten dürfen.
Am 10. Dezember 2008 verabschiedeten die EU-Kommissare einen Richtlinien-Vorschlag zum so genannten Arzneimittelpaket. Auch wenn das Werbeverbot für rezeptpflichtige Arzneimittel formell erhalten bleibt, wird es systematisch durchlöchert: Arzneimittelhersteller sollen künftig auf allgemein zugänglichen Internetseiten oder in Printmedien Informationen zu Gesundheit, Krankheit und rezeptpflichtigen Arzneimitteln verbreiten dürfen.
Für die Vorschläge hatte sich vor allem Günter Verheugen, der für Unternehmens- und Industriepolitik zuständige Vizepräsident der EU-Kommission, stark gemacht. Er möchte die Wettbewerbsfähigkeit der europäischen Pharmaindustrie fördern. In einer Pressemitteilung der Europäischen Kommission vom 10.12.2008 heißt es dazu: "Wir wollen die EU wieder zu dem machen, was sie schon einmal war, nämlich zur Apotheke der Welt." Dabei soll eine Erweiterung der Spielräume bei der Arzneimittelinformation und eine damit verbundene angebliche Harmonisierung der europäischen Gesetzgebung der Pharmaindustrie helfen.
Im Vorfeld hatte es massive Kritik von VerbraucherInnen und Fachleuten gegeben. Auch der EU-Kommissarin für Gesundheit und Verbraucherschutz Androulla Vasilliou gingen die Vorschläge zu weit. Sie konnte immerhin durchsetzen, dass Radio- und TV-Beiträge sowie Internet-TV tabu bleiben. Doch das reicht bei weitem nicht aus, denn andere Schutzklauseln werden durch vage formulierte Ausnahmeregeln wieder durchlöchert. Der Verbraucherschutz bleibt auf der Strecke.
Künftig sollen Pharmafirmen auf Grundlage des Beipackzettels und vorliegender Fachinformationen den VerbraucherInnen selbst zusammengestelltes Informationsmaterial präsentieren dürfen. Was als verbesserte Aufklärungsmöglichkeit daher kommt, reißt das Tor zur geschönten bis irreführenden Darstellung weit auf. Bereits jetzt sind Beipackzettel und Fachinformation für Laien für europäisch zugelassene Arzneimittel frei zugänglich auf der Homepage der European Medicines Agency.
Bisher sieht die neue EU-Richtlinie eine Überwachung des erweiterten direkten Zugang der Hersteller zu VerbraucherInnen vor. Diese Vorabkontrolle der Information durch die Behörden soll nun eine freiwillige Selbstkontrolle der Industrie ersetzen können, nachzulesen auf der Website des EU-Kommissariats für Unternehmen und Industrie. Über die Art der Kontrolle sollen wiederum die Mitgliedsstaaten selbst entscheiden können - dem vorgegeben Ziel der Harmonisierung dürfte das kaum dienlich sein.
Das Gleiche gilt für die Frage der möglichen Platzierung von Laienwerbung, die in Zukunft in Zeitungen und Zeitschriften erlaubt sein soll. Die Entscheidung über die genaue Form, in der Pharma-Hersteller ihre Produkte den nicht medizinisch oder pharmakologisch vorgebildeten KundInnen anbieten können, soll aber bei den Mitgliedsstaaten liegen. Auch hier keine Spur der vielzitierten europäischen Harmonisierung.
Grundsätzlich problematisch bleibt eine klare Abgrenzung von Arzneimittelinformation von Werbung. Jede Botschaft eines Herstellers mag einen Informationsanteil enthalten, aber hinter jeder Produktinformation steckt auch immer eine verkaufsfördernde Absicht, sprich Werbung. So ist es nicht verwunderlich, dass die Kommission hier entscheidende Fragen offen und Klarheit vermissen lässt. PatientInnen brauchen unabhängige, verständliche und vergleichende Gesundheitsinformationen, um eine Entscheidung für oder gegen eine Behandlung treffen zu können. Aber gerade vergleichende Arzneimittelinformation - bzw. -werbung - ist nach der jetzigen Gesetzesvorlage verboten.
Der Gesetzesvorschlag hat mit der Verabschiedung durch die EU-Kommissare seinen parlamentarischen Prozess begonnen und sowohl der EU-Ministerrat als auch das Europäische Parlament werden sich mit der Thematik befassen müssen. Entscheidende Vorbesprechungen gibt es dieser Tage im EU-Ausschuss für Umweltfragen, Volksgesundheit und Lebensmittelsicherheit (ENVI), wo am ehesten Chancen bestehen, mit den Bedenken von VerbraucherInnen und Fachleuten auf offene Ohren zu stoßen. Die Buko Pharma-Kampagne bietet eine Plattform, um die Ablehnung der zunehmenden Freigabe von Laienwerbung für Medikamente zu bündeln und Druck insbesondere auf deutsche (EU)-PolitikerInnen auszuüben, damit sie sich für wirklichen und zuverlässigen mehr Verbraucherschutz einsetzen. Sie hat Stellungnahmen wichtiger Verbraucher- und Fachorganisationen zusammengetragen und eröffnet auf dieser Website auch die Möglichkeit, sich an ihrer Unterschriftenaktion zu beteiligen und damit die Überzeugung zum Ausdruck zu bringen, dass Verbraucherschutz Vorrang vor wirtschaftlichen Interessen haben muss.
Jens Holst, 19.2.09
Fehlinformation und Manipulation - tiefe Einblicke in Marketingstrategien für Medikamente am Beispiel Gabapentin
 Behandlungsentscheidungen sollten zutreffende Informationen zugrundliegen. Verzerrte Informationen gefährden die Sicherheit und das Wohlergehen der Patienten. Am Beispiel der Substanz Gabapentin (auch als Neurontin bekannt) lässt sich eine umfassende Marketingstrategie auf Grundlage von Zeugenaussagen und firmeninternen Unterlagen nachvollziehen. Im Rahmen eines Gerichtsverfahrens musste die Firma Parke-Davis (Pfizer) über 8.000 Seiten interner Dokumente öffentlich zugänglich machen. Diese befinden sich in einer durchsuchbaren Datenbank im Drug Industry Document Archive der University of California, San Francisco. Das Gerichtsverfahren war auf Grund der Aussagen des Biologen David P. Franklin zustande gekommen, der im Jahr 1996 für 4 Monate für die Firma arbeitete. Die Zusammenfassung seiner gerichtlichen Zeugenaussage steht als Download zur Verfügung.
Behandlungsentscheidungen sollten zutreffende Informationen zugrundliegen. Verzerrte Informationen gefährden die Sicherheit und das Wohlergehen der Patienten. Am Beispiel der Substanz Gabapentin (auch als Neurontin bekannt) lässt sich eine umfassende Marketingstrategie auf Grundlage von Zeugenaussagen und firmeninternen Unterlagen nachvollziehen. Im Rahmen eines Gerichtsverfahrens musste die Firma Parke-Davis (Pfizer) über 8.000 Seiten interner Dokumente öffentlich zugänglich machen. Diese befinden sich in einer durchsuchbaren Datenbank im Drug Industry Document Archive der University of California, San Francisco. Das Gerichtsverfahren war auf Grund der Aussagen des Biologen David P. Franklin zustande gekommen, der im Jahr 1996 für 4 Monate für die Firma arbeitete. Die Zusammenfassung seiner gerichtlichen Zeugenaussage steht als Download zur Verfügung.
Gabapentin war im Jahr 1993 für die Behandlung einer bestimmten Art epileptischer Anfälle in den USA zugelassen worden. Der Umsatz stieg von 98 Millionen Dollar im Jahr 1995 auf fast 3 Milliarden Dollar im Jahr 2004. Den Anstieg erreichte die Firma durch erfolgreiches Marketing von Gabapentin für nicht zugelassene Indikationen (off-label-Gebrauch) wie Schmerz, Migräne und psychiatrische Diagnosen. Im Jahr 2004 bekannte sich Pfizer illegaler Marketingmethoden schuldig und bezahlte 430 Millionen Dollar Strafe.
Bereits 2006 hatten Steinman und Kollegen das hohe Maß an Systematik beschrieben, das Parke-Davis im Marketing von Gabapentin Mitte bis Ende der 1990er Jahre entwickelt hatte. Forschung, Veröffentlichungen und als unabhängig bezeichnete Fortbildungsprogramme wurden eingesetzt, angereichert mit den Aktivitäten von bezahlten Meinungsführern und Ärzten vor Ort (siehe Abbildung). Bei den meisten Bestandteilen der Kampagne blieb der werbende Charakter verborgen. Die Grenzen zwischen Forschung, Fortbildung und Werbung seien mehr als porös, stellten die Autoren damals fest.
In einem kürzlich erschienen Beitrag im New England Journal of Medicine fassen Landefeld und Steinman die Lehren aus dem Fall der Gabapentin-zusammen:
• Pharmazeutisches Marketing ist umfassend und strategisch, finanziell gut ausgestattet, als Fortbildung oder Forschung verkleidet, einflussreich, effektiv und unauffällig.
• Viele Personen und Institutionen haben die ethischen und gesetzlichen Probleme nicht beachtet - Mitarbeiter der Firma, Ärzte, Krankenhäuser und Fachgesellschaften und Aufsichtsbehörden. Offensichtlich wurde die illegalen Marketingmethoden für normal erachtet.
• Drastische Maßnahmen sind notwendig, um die Integrität der medizinischen Wissenschaft und Praxis zu bewahren und das Vertrauen der Öffentlichkeit zu rechtfertigen. Öffentliche Förderung pharmazeutischer Forschung.
Die Autoren weisen darauf hin, dass die Marketingmethoden für Gabapentin in den USA in erster deshalb strafbar waren, weil es sich um den off-label-Gebrauch handelte - für zugelassene Indikationen sind sie legal und weit verbreitet.
Landefeld CS, Steinman MA. The Neurontin Legacy - Marketing through Misinformation and Manipulation. N Engl J Med 2009;360:103-106. Auszug
Drug Industry Document Archive der University of California, San Francisco.
Aussage David P. Franklin
Steinman MA, Bero LA, Chren M-M, Landefeld CS. Narrative Review: The Promotion of Gabapentin: An Analysis of Internal Industry Documents. Ann Intern Med 2006;145(4):284-293. Volltext.
David Klemperer, 14.2.09
Offenlegung ärztlicher Interessenkonflikte fördert Vertrauen der Patienten
 Die Offenlegung ärztlicher Interessenkonflikte würde das Vertrauen der Patienten in ihre Ärzte und in die Behandlungsentscheidungen stärken. Viele Patienten befürchten, dass Interessenkonflikte sich ungünstig auf ärztliche Entscheidungen auswirken.
Die Offenlegung ärztlicher Interessenkonflikte würde das Vertrauen der Patienten in ihre Ärzte und in die Behandlungsentscheidungen stärken. Viele Patienten befürchten, dass Interessenkonflikte sich ungünstig auf ärztliche Entscheidungen auswirken.
Dies sind Ergebnisse einer Studie, die im Medical Journal of Australia erschienen ist. 906 Patienten aus drei Allgemeinmedizin-Praxen in Sydney sind im Jahr 2007 über ihr Wissen und ihre Einstellung zu Interessenkonflikte ihrer Ärzte befragt worden.
Die meisten der Befragten (76%) gaben an, keine Informationen über mögliche Interessenkonflikte ihrer Ärzte zu haben.
Die Mehrheit würde aber gerne wissen ob ihr Arzt von der Industrie Geld oder andere Zuwendungen und Unterstützung erhält (76%), insbesondere für die Teilnahme an Forschung (69%) und für den Besuch von wissenschaftlichen Tagungen (61%).
Auch würden die Patienten gerne wissen, ob dem Arzt materielle Vorteile entstehen aus
•der Durchführung einer Behandlung (80%)
•der Durchführung einer Untersuchung (77%)
•einer Überweisung 77%
•der Verschreibung eines Medikamentes.
Fast allen Befragten (98%) erscheint es wichtig, dass der Arzt sich in seinen Entscheidung ausschließlich von den Interessen des Patienten leiten lässt.
Viele Patienten befürchten jedoch, dass die Zuwendungen der Industrie diesbezüglich ein Problem darstellen. Die Frage, ob ihrer Meinung nach ihre Ärzte durch die Zuwendungen der Industrie unangemessen beeinflusst würden, beantworteten 49% mit ja, 27% mit nein, 24% waren sich nicht schlüssig.
Die meisten Befragten (78%) meinen, dass sie eine bessere informierte Entscheidung treffen können, wenn sie über die Interessenkonflikte ihres Arztes informiert sind.
Bevorzugt wird die Informationen direkt durch den Arzt im Arzt-Patient-Gespräch (78%), schriftliche Informationen wünschen sich 62%.
Die Offenlegung der Interessenkonflikte stärkt das Vertrauen der meisten Patienten - 80% geben an, dass sie bei Offenlegung den Entscheidungen des Arztes mehr vertrauen würden, 7% verneinten dies, 13% waren unentschieden.
Die Studie zeigt, dass viele Patienten mögliche Interessenkonflikte ihrer Ärzte als Problem erkannt haben. Auch wenn etwa die Hälfte der Patienten meint, die Ärzte würden nicht unangemessen beeinflusst, ist jeder 4. Befragte anderer Meinung. Interessant ist, dass nicht nur die Mehrzahl aller Befragten eine vollständige Offenlegung wünscht sondern auch 77% derjenigen, die keine unangemessene Beeinflussung ihrer Ärzte befürchten. Die Offenlegung würde zu besseren Behandlungsentscheidungen und zu höherem Vertrauen führen.
In Deutschland wird die Mitteilung von ärztlicher Interessenkonflikte außerhalb des Wissenschaftsbereiches bislang kaum diskutiert. In Australien und in den USA wird die Transparenz in Zukunft vom Staat gefordert werden. In beiden Ländern werden Gesetzte vorbereitet, mit denen die Industrie zur Veröffentlichung aller Zahlungen an Ärzte verpflichtet wird.
Die Firma Pfizer hat für ihren US-amerikanischen Bereich die Zeichen der Zeit erkannt und angekündigt, ab 2010 alle ab 1. Juli 2009 erfolgenden Zahlungen an amerikanische Ärzte öffentlich zu machen. Einbezogen sind alle praktizierende Ärzte sowie alle Forscher und Einrichtungen, die Studien durchführen.
Australische Studie (Abstract): Tattersall MHN, Dimoska A, Gan K. Patients expect transparency in doctors' relationships with the pharmaceutical industry. Medical Journal of Australia 2009;190:65-68 (19. Januar).
Pressemitteilung Pfizer 9. Februar 2009. Pfizer to Publicly Disclose Payments to U.S. Physicians, Healthcare Professionals and Clinical Investigators.
David Klemperer, 12.2.09
Literaturübersicht zum Sponsoring ärztlicher Fort- und Weiterbildung durch die Pharma-Industrie
 Dass Pharma-Unternehmen das Marketing ihrer Produkte auch im Rahmen von Fortbildungsveranstaltungen für Ärzte betreiben, wurde in vielen Studien vorwiegend aus den USA offen gelegt, über die wir in unserer Rubrik "Einflussnahme der Pharma-Industrie" mehrfach berichtet haben. Nils Schneider und Sara Lena Lückmann vom Institut für Epidemiologie, Sozialmedizin und Gesundheitssystemforschung der Medizinischen Hochschule Hannover haben jetzt in einer Literaturübersicht, die in der Zeitschrift für Allgemeinmedizin veröffentlicht wurde, noch einmal detailliert den Stand der Forschung zu diesem Thema beschrieben.
Dass Pharma-Unternehmen das Marketing ihrer Produkte auch im Rahmen von Fortbildungsveranstaltungen für Ärzte betreiben, wurde in vielen Studien vorwiegend aus den USA offen gelegt, über die wir in unserer Rubrik "Einflussnahme der Pharma-Industrie" mehrfach berichtet haben. Nils Schneider und Sara Lena Lückmann vom Institut für Epidemiologie, Sozialmedizin und Gesundheitssystemforschung der Medizinischen Hochschule Hannover haben jetzt in einer Literaturübersicht, die in der Zeitschrift für Allgemeinmedizin veröffentlicht wurde, noch einmal detailliert den Stand der Forschung zu diesem Thema beschrieben.
Basis ihres Artikels sind 22 englisch- und deutschsprachige Studien aus den Jahren 2000 bis 2007. Neben ausführlichen, studienübergreifenden Zusammenfassungen von Forschungsbefunden sind die kurzen Zusammenfassungen aller Studien im Hinblick auf Methodik, Teilnehmerzahl und zentrale Ergebnisse besonders aufschlussreich. Hier zeigt sich beispielsweise, um nur einige Studien zu nennen:
• In einer Querschnittstudie mit schriftlicher Befragung von 105 Ärzten, die eine Weiterbildung in Innerer Medizin machen, wird deutlich: 61% der befragten Ärzte meinen, Kontakte zur Pharmaindustrie würde ihr eigenes Verschreibungserhalten nicht beeinflussen, aber nur 16 % glauben, dass ihre Kollegen durch solche Kontakte unbeeinflusst bleiben. Ärzte erkennen bei Kollegen also eine Einflussnahme, halten sich selbst aber für resistent.
• In einer Befragung mit ähnlicher Teilnehmerstruktur glaubt die Mehrzahl der 277 Ärzte, dass die Pharmaindustrie die ärztliche Weiterbildung beeinflusst, und wünscht sich, dass Lehrende in solchen Veranstaltungen alle potenziellen Interessenskonflikte offen legen.
• In einer Umfrage bei 241 Radio-Onkologen beurteilen 66% der Befragten Information durch die Pharmaindustrie als nützlich für ihre Fortbildung. Nur 5 % der Befragten sind der Meinung, Pharmamarketing habe Einfluss auf ihr eigenes Verschreibungsverhalten, aber 33% meinen, Pharmamarketing habe Einfluss auf das Verschreibungsverhalten anderer Ärzte.
• In einer Befragung von 487 englischen Klinik- und Hausärzten zeigt sich: Bei der Hälfte aller Fortbildungsveranstaltungen und Konferenzen geben die befragten Ärzte an, finanzielle Unterstützung durch die Pharmaindustrie erhalten zu haben. 40% sehen in dieser Unterstützung durch die Pharmaindustrie einen Interessenskonflikt, aber 86% glauben, dass Pharmasponsoring ihr Verschreibungsverhalten nicht beeinflusst.
Im Aufsatz von Schneider/Lückmann wird auch noch einmal detailliert auf die Empfehlungen der Bundesärztekammer für Sponsoring und Fortbildung eingegangen. Dort wird explizit gefordert: "Sponsoring ist transparent zu machen. Der Sponsor darf Form und Inhalt der Fortbildungsmaßnahme nicht beeinflussen. Referenten müssen ihre Verbindungen zur Industrie offen legen." Zitiert wird auch Prof. Müller-Oerlinghausen, ehemaliger Vorsitzender der Arzneimittelkommission der Deutschen Ärzteschaft, heute Mitglied der pharmakritischen Ärzteinitiative MEZIS: "Warum wir Fortbildungen umsonst bekommen müssen, warum Akademien sagen, ohne pharmazeutische Industrie geht es überhaupt nicht, das hat mir nie eingeleuchtet. " (vgl. TV-Magazin Panorama, 16.8.2007:Trotz Verbot - Pharmakonzerne manipulieren Ärztefortbildung).
Leider ist vom Aufsatz von Schneider/Lückmann nur ein Abstract kostenlos verfügbar: Niels Schneider, Sara Lena Lückmann: Pharmasponsoring in der ärztlichen Fort- und Weiterbildung (Z Allg Med 2008; 84: 516-524; DOI: 10.1055/s-0028-1100421)
Gerd Marstedt, 4.2.09
USA: Direkte, an Konsumenten gerichtete Werbung für rezeptpflichtige Medikamente scheint an Wirkung zu verlieren
 In der Europäischen Union ist der Entscheidungsprozess über die sogenannte "Direct-to-consumer advertising (DTCA)" noch offen und es ist strittig, ob und in welcher Form und in welchen Medien es zukünftig Pharmaunternehmen gestattet wird, Verbraucher direkt über rezeptpflichtige Medikamente zu informieren. In den USA andererseits, dem neben Neuseeland einzigen Land, in dem die Direktwerbung gesetzlich erlaubt ist, deutet sich nach einer neueren Studie eine sinkende Wirkung dieser Werbung an, so dass Pharmaunternehmen sehr viel weniger als noch vor fünf Jahren von ihrer Werbung in Form steigender Umsätze profitieren.
In der Europäischen Union ist der Entscheidungsprozess über die sogenannte "Direct-to-consumer advertising (DTCA)" noch offen und es ist strittig, ob und in welcher Form und in welchen Medien es zukünftig Pharmaunternehmen gestattet wird, Verbraucher direkt über rezeptpflichtige Medikamente zu informieren. In den USA andererseits, dem neben Neuseeland einzigen Land, in dem die Direktwerbung gesetzlich erlaubt ist, deutet sich nach einer neueren Studie eine sinkende Wirkung dieser Werbung an, so dass Pharmaunternehmen sehr viel weniger als noch vor fünf Jahren von ihrer Werbung in Form steigender Umsätze profitieren.
Wenn man errechnet, wie lange der durchschnittliche Amerikaner im Jahr mit seinem Arzt spricht, und wie lange er im Fernsehen Direktwerbung für rezeptpflichtige Medikamente sieht, so ergibt sich ein Verhältnis von 1 Minute Arzt zu 100 Minuten Arzneimittelwerbung. Im letzten Jahrzehnt haben sich in den USA die Ausgaben der Pharma-Industrie für die Direktwerbung etwa vervierfacht und erreichten zuletzt eine Höhe von 4,5 Milliarden Dollar. (NYT: Showdown Looms in Congress Over Drug Advertising on TV). Dieser Anstieg ist durchaus erklärbar: Man schätzt, dass jeder einzelne für dieses Marketing eingesetzte Dollar die Umsätze um etwa 2,20 bis 4,20 Dollar steigert. In einer Studie aus dem Jahr 2003 zeigte sich, dass jeder dritte Amerikaner schon einmal mit dem Arzt über ein rezeptpflichtiges Medikament aus der Werbung diskutiert hat.
Möglicherweise ist der Boom der direkten Konsumentenwerbung jedoch in eine Krise geraten. Dies deutet eine Studie an, die in ähnlicher Form schon einmal im Jahr 2003 und jetzt erneut von einer Forschungsgruppe aus Colorado durchgeführt wurde. Befragt wurden 168 Ärzte verschiedener Fachrichtungen aus 22 Praxen, nachdem sie insgesamt 1.647 Gespräche mit Patienten durchgeführt hatten. Sie gaben dann zu jedem dieser Patientengespräche Auskunft, jeder Arzt füllte etwa 10 Erhebungsbögen aus. Die wichtigsten Ergebnisse der Auswertung waren dann:
• Nur in 58 Fällen (3,5%) hatten Patienten nach einem ganz bestimmten Medikament gefragt und nur in 2,6% aller Fälle nach einem Medikament aus der TV-Werbung.
• Deutliche Unterschiede zeigten sich dabei zwischen Praxen nur für Privatpatienten und anderen Arztpraxen: Privatpatienten fragten deutlich häufiger (7,2%) nach einem bestimmten Arzneimittel als andere (1,7%).
• Im Vergleich zu einer ähnlichen Befragung des Forschungsteams aus dem Jahr 2003 (vgl.: How does direct-to-consumer advertising (DTCA) affect prescribing? A survey in primary care environments with and without legal DTCA) wurde allerdings deutlich, dass diese Nachfrage bei Privatpatienten deutlich gesunken ist, von 15,8% fünf Jahre zuvor auf jetzt 7,2%.
• Die Forscher fanden weiterhin, dass einige Merkmale einen recht deutlichen Einfluss auf die Empfänglichkeit für Medikamentenwerbung und die direkte Nachfrage nach bestimmten Arzneimitteln bei Arzt. Dies ist - neben Privatpatienten - auch der Fall bei Frauen und Kranken, die drei und mehr Medikamente einnehmen müssen.
• Die Ärzte berichteten, dass das nachgefragte Medikament in den meisten Fällen (62%) nicht ihre erste Wahl gewesen wäre. Zumeist (in 53% der Fälle) wären sie jedoch dem Patientenwunsch gefolgt.
Die in den letzten Jahren gesunkene Nachfrage nach bestimmten rezeptpflichtigen Medikamenten erklären die Wissenschaftler daraus, dass in den letzten Jahren in den USA das Vertrauen der Patienten und Verbraucher in die Pharma-Industrie Schaden erlitten hat. Von daher werde den Aussagen der Pharma-Unternehmen in Werbespots nicht mehr so ohne weiteres vertraut wie zuvor. (vgl. US-Verbraucher: Das Vertrauen in die Pharmaindustrie ist im Keller).
Am 10. Dezember 2008 hatte die Europäische Kommission in Brüssel ihr sogenanntes "Pharmapaket" vorgestellt, das auch einen Entwurf für eine Richtlinie enthält, aufgrund derer Pharma-Unternehmen zukünftig Patienten direkt über verschreibungspflichtige Arzneimittel informieren können. Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) und andere Verbände und Politiker hatten den Entwurf jedoch massiv kritisiert. (vgl. Das Pharmapaket in der Kritik)
Die Ärztebefragung aus Colorado ist hier im Volltext kostenlos verfügbar: Bennett Parnes u.a.: Lack of Impact of Direct-to-Consumer Advertising on the Physician-Patient Encounter in Primary Care: A SNOCAP Report (Annals of Family Medicine 7:41-46 (2009), doi: 10.1370/afm.870)
Gerd Marstedt, 15.1.09
Trugbilder der Wirklichkeit für Marketingzwecke - das Beispiel der "Neuroleptika der zweiten Generation"
 Medikamente zur Behandlung der Schizophrenie werden als Neuroleptika oder auch als Antipsychotika bezeichnet. Sie werden nach chemischer Struktur und Wirkstärke (pharmakologische Potenz) unterteilt sowie nach Substanzen der ersten und zweiten Generation, wobei erstere auch als "typische" und letztere als "atypische" Neuroleptika bezeichnet werden. Ihre Wirksamkeit entfalten sie über die Beeinflussung von Botenstoffen im Gehirn, hauptsächlich Dopamin. Psychotische Symptome wie Wahn, Halluzinationen, Verfolgungsängste und Erregungszustände können gebessert werden. Dem stehen eine Reihe unerwünschter Wirkungen gegenüber, wie z.B. Bewegungsstörungen(extrapyramidale Störungen und Dyskinesien) und Gewichtszunahme.
Medikamente zur Behandlung der Schizophrenie werden als Neuroleptika oder auch als Antipsychotika bezeichnet. Sie werden nach chemischer Struktur und Wirkstärke (pharmakologische Potenz) unterteilt sowie nach Substanzen der ersten und zweiten Generation, wobei erstere auch als "typische" und letztere als "atypische" Neuroleptika bezeichnet werden. Ihre Wirksamkeit entfalten sie über die Beeinflussung von Botenstoffen im Gehirn, hauptsächlich Dopamin. Psychotische Symptome wie Wahn, Halluzinationen, Verfolgungsängste und Erregungszustände können gebessert werden. Dem stehen eine Reihe unerwünschter Wirkungen gegenüber, wie z.B. Bewegungsstörungen(extrapyramidale Störungen und Dyskinesien) und Gewichtszunahme.
Die erste Generation der Neuroleptika wurde in den 1950-er-Jahren entwickelt, wie z.B. Chlorpromazin, Perphenazin und Haloperidol. Ab den 1970-er Jahren wurden neu entwickelte Substanzen als zweite Generation von Neuroleptika eingeführt mit dem Versprechen zusätzlicher positiver und weniger unerwünschter Wirkungen, wie z.B. Clozapin, Amisulprid, Olanzapin und Risperidon.
Seit 2005 werden die Medikamente der zweiten Generation in Deutschland häufiger verordnet als die hochpotenten Neuroleptika der ersten Generation (Arzneiverordnungsreport 2008, S. 795).
Eine internationale Arbeitsgruppe ist jetzt in einer Meta-Analyse der Frage der Überlegenheit der Neuroleptika der zweiten Generation nachgegangen mit folgendem Ergebnis:
• Es existiert kein gemeinsames Merkmal, in dem sich die Substanzen der zweiten von der ersten Generation unterscheiden. Der Begriff "atypische Neuroleptika" entbehrt damit einer sachlichen Grundlage.
• Als Gruppe haben die Medikamente der zweiten Generation kein günstigeres Profil von erwünschten und unerwünschten Wirkungen. Insbesondere wirken sie nicht besser auf die negativen Symptome.
• Einzelne Substanzen sind bezüglich einzelner Zielparameter günstiger als andere, so z.B. das Doxepin bezüglich einer bestimmten Form von Bewegungsstörungen.
Für die Meta-Analyse wurden neun Substanzen der zweiten mit Substanzen der ersten Generation verglichen, zumeist mit Haloperidol und Perphenazin. Dafür wurden 150 doppelblinde randomisierte kontrollierte Studien mit 21.533 Teilnehmern ausgewertet. Beurteilt wurde die Gesamtwirksamkeit, positive, negative und depressive Symptome, Lebensqualität, extrapyramidale Störungen, Gewichtszunahme und Sedierung.
Die Begriffe "zweite Generation von Neuroleptika" und "atypische Neuroleptika" erweisen sich somit als eine Erfindung, mit der die Industrie ein erfolgreiches Marketing für die neuen und teureren Medikamente betrieb, merken Peter Tyrer und Tim Kendall in einem Kommentar an.
Durch eine Reihe von Tricks wurde von vornherein sichergestellt, dass die neuen Medikamente im Vergleich besser abschnitten. So wurden die neuen Substanzen in meisten Fällen mit Haloperidol verglichen, einem hochpotenten Neuroleptikum der ersten Generation mit vergleichsweise starken unerwünschten Wirkungen. Weiterhin wurden die Substanzen der ersten Generation hoch dosiert, was zu einer höheren Rate unerwünschter Wirkungen führt. Neuroleptika der ersten Generation mit günstigerem Profil wurden erst gar nicht in die Vergleiche einbezogen und Studien mit unerwünschten Ergebnissen wurden nicht veröffentlicht. Es sei nicht schwer zu erkennen - so die Kommentatoren - dass die Studien dem Marketing dienen und nicht der Klärung des tatsächlichen Nutzens für die Patienten.
Leucht S, Corves C, Arbter D, Engel RR, Li C, Davis JM. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. The Lancet 2009;373:31-41
Zusammenfassung
Tyrer P, Kendall T. The spurious advance of antipsychotic drug therapy. The Lancet 2009;373:4-5
Kommentar, Download kostenpflichtig
David Klemperer, 4.1.09
Geschöntes Bild neuer Medikamente in medizinischen Fachzeitschriften
 Über die Zulassung eines neuen Medikamentes entscheidet die Zulassungsbehörde - in Deutschland das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), in den USA die Food and Drug Administration (FDA). Voraussetzung für die Zulassung ist der Nachweis von Wirksamkeit und Sicherheit. In Deutschland sind die Anforderungen im Arzneimittelgesetz geregelt. Das US-amerikanische Zulassungsverfahren wird auf einer Website der FDA näher beschrieben.
Über die Zulassung eines neuen Medikamentes entscheidet die Zulassungsbehörde - in Deutschland das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), in den USA die Food and Drug Administration (FDA). Voraussetzung für die Zulassung ist der Nachweis von Wirksamkeit und Sicherheit. In Deutschland sind die Anforderungen im Arzneimittelgesetz geregelt. Das US-amerikanische Zulassungsverfahren wird auf einer Website der FDA näher beschrieben.
Die Wirksamkeitsstudien, welche die Zulassungsbehörden erhalten, sind der Öffentlichkeit nicht in vollem Umfang zugänglich. Die Fachöffentlichkeit wird über medizinische Fachzeitschriften informiert, in denen die Forscher die entsprechenden klinischen Studien zu einem neuen Medikament veröffentlichen. Ergebnisse werden also in zwei Formen veröffentlicht - als Wirksamkeitsstudie für die Zulassungsbehörde und als Studie in einer medizinischen Fachzeitschrift. Wissenschaftler der University of California überprüften jetzt, inwieweit die Wirksamkeitsstudien über neue Wirkstoffe (new chemical entities) mit den Veröffentlichungen in Fachzeitschriften übereinstimmen.
Grundlage für die Untersuchung waren 33 in den Jahren 2001 und 2002 von der FDA neu zugelassene neue Wirkstoffe und die von den antragstellenden pharmazeutischen Unternehmen vorgelegten 164 Wirksamkeitsstudien.
Die Ergebnisse belegen, dass die Informationen, welche die Öffentlichkeit erhält, unvollständig und verzerrt sind.
•Nur 128 der 164 Wirksamkeitsstudien (78%) waren 5 Jahre nach der Zulassung in Fachzeitschriften veröffentlicht.
•Die Wahrscheinlichkeit der Veröffentlichung war höher für Wirksamkeitsstudien mit positivem Ergebnis.
•Die Zahl der Publikationen pro neue Substanz lag zwischen 1 und 14.
•Die Wirksamkeitsstudien enthielten 179 primäre Outcomes (Behandlungsergebnisse).
•155 Outcomes wurden sowohl in den Wirksamkeitsstudien als auch in den Fachzeitschriften genannt.
•41 Outcomes der Wirksamkeitsstudien wurden in den Fachzeitschriften ausgelassen.
•15 positive Outcomes erschienen zusätzlich in den Fachzeitschriften. Die Fachzeitschriften enthielten somit mehr positive Outcomes als die Wirksamkeitsstudien.
•Die Wirksamkeitsstudien enthielten 43 Outcomes, die für das jeweilige Medikament ungünstig waren. 20 dieser negative Ergebnisse (47%) wurden nicht in Fachzeitschriften veröffentlicht.
•4 der übrigen 23 negativen Outcomes erschienen in den Fachzeitschriften positiv und zwar durch Veränderung der statistischen Signifikanz (ein statistisches Maß für die Zuverlässigkeit von Studienergebnissen).
•Von den 99 Schlussfolgerungen der Wirksamkeitsstudien wurden 9 für die Fachzeitschriften verändert, alle zugunsten der Substanz.
Warum, wie, durch wen und an welcher Stelle die Veränderungen entstanden, war nicht Gegenstand der Untersuchung.
Die nahe liegende Schlussfolgerung lautet jedoch, dass die Firmen und Autoren durch selektives Veröffentlichen bzw. Nicht-Veröffentlichen ganzer Studien, durch Auslassung negativer und Zufügung positiver Ergebnisse sowie durch Umwandlung negativer in positive Ergebnisse neue Medikamente für die Öffentlichkeit günstiger darstellen als sie sind.
Diese Ergebnisse sind von weitreichender Bedeutung. Medizinische Behandlung soll mehr Nutzen stiften als Schaden anrichten. Behandlungsentscheidungen auf Grundlage positiv verzerrter Informationen gefährden jedoch die Gesundheit von Patienten. Da es sich dabei stets um neue, patentgeschützte und somit teure Medikamente handelt, wird für diese Art der Patientengefährdung auch noch viel Geld ausgegeben.
Originalarbeit, Volltext: Rising K, Bacchetti P, Bero L.
Reporting Bias in Drug Trials Submitted to the Food and Drug Administration: Review of Publication and Presentation. PLoS Medicine 2008;5(11):e217
Kommentar: Chan AW. Bias, Spin, and Misreporting: Time for Full Access to Trial Protocols and Results
David Klemperer, 6.12.08
Forschung von 25 Jahren: Die mangelnde klinische Gleichwertigkeit von Generika und Original ist oft ein gut gepflegtes Phantom.
 Gegen die Verordnung und Einnahme von sogenannten Generika, d.h. Arzneimitteln, die nach Beendigung des Patentschutzes eines Originalpräparats, meist preisgünstiger "nachgebaut" werden und aus Kostengründen auch immer häufiger verordnet werden sollen oder müssen, wurden und werden von Originalherstellern und ihnen nahe stehenden Kopflangern Sicherheitsbedenken und Warnungen vor möglichen unerwünschten gesundheitlichen Wirkungen geäußert. Diese machen sich an der Bioäquivalenz, d.h. einer qualitativ gleichwertigen Zusammensetzung und Wirkung der Generika fest. Hier könnten, so die Warner vor allzu intensiver Verordnung von Generika, kleine Unterschiede erhebliche negative Einflüsse auf die erwünschte gesundheitliche Wirkung darstewllen.
Gegen die Verordnung und Einnahme von sogenannten Generika, d.h. Arzneimitteln, die nach Beendigung des Patentschutzes eines Originalpräparats, meist preisgünstiger "nachgebaut" werden und aus Kostengründen auch immer häufiger verordnet werden sollen oder müssen, wurden und werden von Originalherstellern und ihnen nahe stehenden Kopflangern Sicherheitsbedenken und Warnungen vor möglichen unerwünschten gesundheitlichen Wirkungen geäußert. Diese machen sich an der Bioäquivalenz, d.h. einer qualitativ gleichwertigen Zusammensetzung und Wirkung der Generika fest. Hier könnten, so die Warner vor allzu intensiver Verordnung von Generika, kleine Unterschiede erhebliche negative Einflüsse auf die erwünschte gesundheitliche Wirkung darstewllen.
Dagegen gerichtet gab es schon immer bei einzelnen besonders umstrittenen Generika - meist bei denen für die der Markt relativ groß war - schlüssige Gegenargumente und Belege für eine hinreichend gleiche Bioäquivalenz von Original und Generika.
Für eine der quantitativ und qualitativ bedeutendsten Arzneimittelgruppen, die der vielfältigen Mittel gegen kardiovaskuläre Risikofaktoren, Beschwerden und Erkrankungen (z.B. Betablocker oder Diuretika) erschien nun in der neuesten Ausgabe des US-Medizinjournals JAMA (JAMA 3.12.2008;300(21): 2514-2526) ein systematischer Review der in den letzten 25 Jahren durchgeführten und publizierten 47 Studien (darunter 38 randomisierte kontrollierte Untersuchungen [RCT]) zur Bioäquivalenz bzw. klinischen Gleichwertigkeit der dort existierenden Original- und Generika-Mittel.
Die Quintessenz der Reviewer lautet kurz und knapp: "No evidence of superiority" der klinischen Gleichwertigkeit ("clinical equivalence") der Originalpräparate gegenüber ihren jeweiligen Generika. Dabei stand im Mittelpunkt des Interesses der klinische Outcome der Behandlung mit Arzneimitteln aus 9 Unterklassen dieser Medikamentengruppe. Zum Outcome wurden das Auftreten unerwünschter Wirkungen, Laborwerte und eine Reihe von behandlungsassoziierten Vitalzeichen. Nur bei 2 der 9 untersuchten Untergruppen wurde die klinische Gleichwertigkeit nicht in allen reviewten Studien festgestellt. Aber auch dort stellten 91 bzw. 71 % der Studien sie fest.
Die in den reviewten Studien gefundenen Ergebnisse rechtfertigen, so die Autoren des Review "that it is reasonable for physicians and patients to rely on FDA bioequivalence rating as a proxy for clinical equivalence among a number of important cardiovascular drugs."
Wie hartnäckig sich Vorurteile selbst dort halten wo ausdrücklich keinerlei Beleg für eine Minderwertigkeit von Generika gefunden wurde, zeigen die in 43 der 47 Studien-Zeitschriften veröffentlichten Editorials: In 23 Fällen äußerten sich die jeweiligen Herausgeber gegen die Ergebnisse ihrer Autoren negativ darüber, Originalarzneimittel durch Generika zu ersetzen. Es ist zu befürchten, dass angesichts des ökonomischen Potenzials des Arzneimittelmarktes auch weiterhin Ärzte, Apotheker und vor allem auch Patienten mit Vorsatz erschreckt werden und sich für eine nur für die Hersteller ökonomisch vorteilhaftere Behandlung mit Originalpräparaten entscheiden.
Hier findet sich das kostenlose Abstract des Aufsatzes "Clinical Equivalence of Generic and Brand-Name Drugs Used in Cardiovascular Disease A Systematic Review and Meta-analysis" von Aaron S. Kesselheim, Alexander S. Misono, Joy L. Lee, Margaret R. Stedman, M. Alan Brookhart, Niteesh K. Choudhry und William H. Shrank.
Bernard Braun, 3.12.08
EU wirft Pharma-Unternehmen Blockadepolitik und Wettbewerbsbehinderungen gegen die Einführung preiswerterer Medikamente vor
 Der Wettbewerb im Arzneimittel-Sektor funktioniert nicht. Mit vielfältigen Strategien versuchen Pharmaunternehmen die Markteinführung preiswerterer Medikamente (Generika) zu verhindern oder zu blockieren. Dies stellt ein Zwischenbericht der Europäischen Kommission fest, der die Wettbewerbsbedingungen im pharmazeutischen Sektor untersucht hat. Der Abschlussbericht, so teilte die Leiterin der Untersuchungskommission Neelie Kroes jetzt mit, werde im Frühjahr 2009 vorgelegt. Bereits jetzt habe man jedoch bei einer Stichprobe von Arzneimitteln, für die der Patentschutz zwischen 2000 und 2007 in 17 Mitgliedstaaten auslief, festgestellt, dass in diesem Zeitraum Einsparungen von rund 3 Milliarden Euro möglich gewesen wären, hätte man seinerzeit Generika ohne Verzögerung eingeführt.
Der Wettbewerb im Arzneimittel-Sektor funktioniert nicht. Mit vielfältigen Strategien versuchen Pharmaunternehmen die Markteinführung preiswerterer Medikamente (Generika) zu verhindern oder zu blockieren. Dies stellt ein Zwischenbericht der Europäischen Kommission fest, der die Wettbewerbsbedingungen im pharmazeutischen Sektor untersucht hat. Der Abschlussbericht, so teilte die Leiterin der Untersuchungskommission Neelie Kroes jetzt mit, werde im Frühjahr 2009 vorgelegt. Bereits jetzt habe man jedoch bei einer Stichprobe von Arzneimitteln, für die der Patentschutz zwischen 2000 und 2007 in 17 Mitgliedstaaten auslief, festgestellt, dass in diesem Zeitraum Einsparungen von rund 3 Milliarden Euro möglich gewesen wären, hätte man seinerzeit Generika ohne Verzögerung eingeführt.
Der Bericht nennt keine Namen einzelner Pharma-Unternehmen, beschreibt jedoch eine Reihe von Strategien, mit denen versucht wird, den Patentschutz von Arzneimitteln durch juristische oder geschäftliche Maßnahmen zu verlängern und so die Markteinführung von Generika zu verhindern.
• Pharma-Unternehmen melden eine Vielzahl von Patenten an (sogenannte "patent clusters" or "patent thickets"), um so Generika-Hersteller zu behindern und im Ungewissen zu lassen, ob einzelne Patente noch gültig sind. In einem Einzelfall fand die Kommission, dass für ein einzelnes "Blockbuster Medikament" insgesamt 1.300 verschiedene Patente eingereicht worden sind.
• Gerichtliche Klagen gegen Generika-Hersteller sind ein weiteres Mittel von Pharma-Unternehmen, um zumindest Zeit zu gewinnen für den Patentschutz ihrer Original-Medikamente. Im Zeitraum 2000-2007 hat sich die Zahl solcher Prozesse nach Feststellung der Kommission vervierfacht. Die juristischen Auseinandersetzungen dauern im Schnitt 2,8 Jahre. In der Mehrzahl der Fälle (62%) bekamen die Generika-Hersteller recht. Die Kosten für diese Rechtsstreitigkeiten werden auf über 420 Millionen Euro geschätzt.
• In vielen Fällen kommt es zu außergerichtlichen Einigungen zwischen den Herstellern der Originalpräparate und der Generika. Über 200 solcher Fälle wurden der Kommission bekannt, in denen die Generika-Firmen Geld bekamen, damit ihre Arzneien gar nicht oder verspätet auf den Markt kamen.
Die Kommission stellt in ihrem Zwischenbericht weiterhin fest, dass die Pharmaunternehmen im Durchschnitt fast ein Viertel (23%) ihres Umsatzes für Marketing und Werbung ausgeben. Dabei wird nicht nur versucht, eigene Produkte positiv zu bewerben. Es wird auch versucht, Zweifel an der Wirksamkeit und Sicherheit von Generika zu schüren. Man werde jetzt die Ergebnisse des Berichts mit den betroffenen Parteien erörtern und Schlussfolgerungen ziehen., erklärte Neelie Kroes und weiter: "Noch stellt sich die Frage nicht. Jedoch wird die Kommission wird ohne jedes Zögern kartellrechtliche Verfahren einleiten, wenn der Verdacht aufkommt, dass Unternehmen die Kartellvorschriften verletzt haben."
• Website der Untersuchungskommission mit vielfältigen Materialien zum Download, einschl. des kompletten Berichts: European Commission, Pharmaceuticals, Sector Inquiry
• Pressemitteilung mit zentralen Befunden des Zwischenberichts: Antitrust: preliminary report on pharmaceutical sector inquiry highlights cost of pharma companies' delaying tactics
• Zusammenfassung des Zwischenberichts (PDF, 13 Seiten): Pharmaceutical Sector Inquiry, Preliminary Report, Executive Summary
Gerd Marstedt, 29.11.08
Ehrenwert aber wirkungsarm - der Verhaltenskodex der Freiwilligen Selbstkontrolle für die Arzneimittelindustrie e.V.
 Die Freiwillige Selbstkontrolle für die Arzneimittelindustrie e.V. wurde im Jahr 2004 gegründet, um die Zusammenarbeit der pharmazeutischen Industrie mit Ärzten und Apothekern entsprechend eines Verhaltenskodex (FSA-Kodex) zu überwachen und bei Regelverstößen zu sanktionieren. Der Kodex ist vom Bundeskartellamt als Wettbewerbsregel anerkannt. Dem Verein gehören 90 Firmen an, weitere 20 haben erklärt, auf Grundlage des Kodex zu arbeiten.
Die Freiwillige Selbstkontrolle für die Arzneimittelindustrie e.V. wurde im Jahr 2004 gegründet, um die Zusammenarbeit der pharmazeutischen Industrie mit Ärzten und Apothekern entsprechend eines Verhaltenskodex (FSA-Kodex) zu überwachen und bei Regelverstößen zu sanktionieren. Der Kodex ist vom Bundeskartellamt als Wettbewerbsregel anerkannt. Dem Verein gehören 90 Firmen an, weitere 20 haben erklärt, auf Grundlage des Kodex zu arbeiten.
Im August ist eine Neuauflage des Kodex erschienen.
Im Folgenden einige Schlaglichter aus dem aktuellen Kodex.
In der Einleitung heißt es, dass der Patient im Mittelpunkt stehe und es der darum gehe, diesen "durch zutreffende und objektive wissenschaftliche Informationen über Arzneimittel das Wissen zu vermitteln, das für eine sachgerechte Auswahl und Anwendung von Arzneimitteln erforderlich ist." Es solle nicht nur der Nutzen sondern auch Grenzen und Risiken mitgeteilt werden - Arzneimittel seien "zutreffend zu bewerben".
Die Unternehmen seien jederzeit an hohen ethischen Standards zu messen (§ 4 Allgemeine Auslegungsgrundsätze).
Werbung solle die angesprochenen Fachkreise in die Lage versetzen, sich ein eigenes Bild von dem therapeutischen Wert eines Arzneimittels zu machen. Sie müsse daher "so zutreffend, ausgewogen, fair, objektiv und vollständig sein, dass sie einen richtigen Gesamteindruck vermittelt". Sie solle auf einer aktuellen Auswertung aller einschlägigen Erkenntnisse beruhen und diese Erkenntnisse klar und deutlich wiedergeben (§ 5 Werbung).
Ärzte dürfen nicht "in unlauterer Weise beeinflusst werden" (§ 6 Zusammenarbeit).
Irreführende Werbung sei unzulässig, Werbung müsse "hinreichend wissenschaftlich abgesichert" sein und alle verfügbaren Erkenntnisse über Nebenwirkungen umfassen.
Bezahlte Tätigkeiten wie Vorträge, Beratung und klinische Prüfung von Arzneimitteln werden in § 18 geregelt. § 19 befasst sich mit der Durchführung von Anwendungsstudien (hier als "nicht-interventionelle Studien" bezeichnet).
Die Unternehmen dürfen im In- und Ausland eigene Fortbildungsveranstaltungen durchführen und zu Fortbildungsveranstaltungen anderer einladen, die sich auf Arzneimittel und deren Indikationen beziehen. Dafür dürfen sie "angemessene" Reise- und Übernachtungskosten sowie eine "angemessene" Bewirtung übernehmen, wenn der "wissenschaftliche Charakter eindeutig im Vordergrund steht" (§ 20 Einladung zu berufsbezogenen wissenschaftlichen Fortbildungsveranstaltungen).
Geschenke bei produktbezogener Werbung sollten "geringwertig" sein und bei nicht produktbezogener Werbung nur zu besonderen Anlässen und in einem "sozial adäquaten Rahmen" vergeben werden § 21 Geschenke).
Geld- und Sachspenden an Institutionen wie medizinisch-wissenschaftlichen Fachgesellschaften, Krankenhäuser und Universitätskliniken regelt § 25. Gaben von mehr als 10.000 Euro pro Leistungsempfänger pro Jahr sind zu veröffentlichen.
Mit dem Kodex bemüht sich die Pharmazeutische Industrie, einen Bereich zu regeln, der für das Gesundheitswesen von höchster Bedeutung ist. Eine umfassende Würdigung der Effekte des Kodex kann hier nicht erfolgen, Positiv anzumerken ist, dass in einem Fall eines offensichtlichen und breit publizierten Verstoßes eine Sanktionierung erfolgt ist (Novartis erhält Höchststrafe für Einladung von Ärzten in den Spreewald). Das Verschreibungsverhalten der Ärzte belegt jedoch, dass der für rationale Therapieentscheidungen erforderliche Abstand zwischen Ärzten und Industrie nicht hergestellt ist - von den 15 umsatzstärksten Medikamenten im Jahr 2007 bewertet die Zeitschrift arznei-telegramm in ihrer Juni-Ausgabe 13 als "nicht zweckmäßig oder zum Teil riskant" und nur 2 als "Mittel der Wahl oder der Reserve". Auch sind Beispiele für Medikamentenwerbung, die den anspruchsvollen Kriterien des § 5 (s.o.) genügen, nicht bekannt.
Die Arzneimittelkommission der deutschen Ärzteschaft weist in einer Stellungnahme darauf hin, dass der Kodex nach bisheriger Erfahrung nicht geeignet war, "unlauteren Werbepraktiken der Arzneimittelindustrie und versuchten Einflussnahmen auf das Verordnungsverhalten von Ärzten in gewünschter Weise entgegenzuwirken". Verbote für die Werbung mit nicht zugelassenen Arzneimitteln sowie irreführende und versteckte Werbung würden ebenso unterlaufen wie Regelungen zur Organisation und Unterstützung von Veranstaltungen und Kongressen sowie zur Gewährung von Geschenken an Angehörige der medizinischen Fachkreise. Die Arzneimittelkommission fordert daher eine Korrektur des FSA-Kodex mit verbindlichen Regelungen, andernfalls seien gesetzgeberische Maßnahmen gegen unlautere Werbemethoden erforderlich.
• FSA-Kodex Version 2019 (Version 2008 nicht mehr verfügbar)
• Newsletter der Arzneimittelkommission der deutschen Ärzteschaft vom 26.6.2008
• Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft vom 22.5.2008
David Klemperer, 3.9.2008
Wie ein Pharmahersteller mit kritischen Forschungsergebnissen umgeht, deren Gewinnung er sogar unterstützt hat!
 Anlässlich der differenzierten Veröffentlichung der Ergebnisse einer vom Hersteller des Impfmedikaments "Vitespen", der Firma Antigenics Inc., sogar finanziell geförderten Studie über die Wirkung auf das rückfallfreie Überleben von Patienten, die wegen eines Nierenzellkarzinom operiert worden sind, gibt es mehrerlei zu berichten:
Anlässlich der differenzierten Veröffentlichung der Ergebnisse einer vom Hersteller des Impfmedikaments "Vitespen", der Firma Antigenics Inc., sogar finanziell geförderten Studie über die Wirkung auf das rückfallfreie Überleben von Patienten, die wegen eines Nierenzellkarzinom operiert worden sind, gibt es mehrerlei zu berichten:
• Erstens zeigte sich bei der vergleichenden Untersuchung (Phase-III-Studie) von 362 (ursprünglich 409) Personen mit dieser Krebserkrankung, denen dieser Impfstoff nach einer Operation über längere Zeit gespritzt wurde mit 367 Personen, die "nur" operiert wurden, kein statistisch signifikantes höheres rückfallfreies Überleben der geimpften Personen.
• Nach einer durchschnittlichen postoperativen Beobachtungszeit von 1,9 Jahren erlitten 37,7% der Impf-Personen einen Rückfall und der Anteil der Rückfälligen in der Kontrollgruppe war mit 39,8% nur unwesentlich höher. In der bis März 2007 fortgesetzten Beobachtung der StudienteilnehmerInnen starben in der Impfgruppe 70 Personen und in der Nicht-Ipmfgruppe 72 Personen. Sämtliche Unterschiede sind statistisch nichtsignifikant.
• Eine gesonderte Analyse in der Untergruppe der Patienten mit Nierenzellkarzinomen, die in den früheren Erkrankungs-Stadien I oder II waren, ergab, dass die Erkrankung bei 15,2% der Vitespen-behandelten und bei 27,0% der ausschließlich beobachteten Patienten erneut auftrat - das heißt dass die Vitespen-behandelten Patienten nur halb so oft einen Rückfall erleben könnten. Dieses Ergebnis war trotz der auf den ersten Blick beachtlichen Differenz jedoch statistisch nicht signifikant. Die Hazard ratio von 0.576 und dem 95%-Vertrauensintervall von CI 0.324-1.023 führt zu einem p-Wert von 0.056.
• Ausdrücklich bewerten die Wissenschaftlerinnen dieses Ergebnis sehr zurückhaltend: "A possible improvement in recurrence-free survival in patients with early stage disease who received vitespen will require further validation."
Wer dieses bei Fachwissenschaftlern und dem Hersteller des Impfmedikaments mit Sicherheit bereits seit längerem bekannte Ergebnis liest, könnte es als einen weiteren Beleg für den nachweisbar fehlenden Nutzen mancher Arzneimittel zur Kenntnis nehmen und noch energischer für vergleichbar kritische Bewertungen anderer Substanzen eintreten.
Sieht man sich aber den Umgang des Herstellers mit diesen Ergebnissen an, kann man noch wesentlich mehr über die Kultur der Hersteller im Umgang mit kritischen Ergebnissen über ihre Produkte lernen.
Denn ausweislich der eigenen Homepage (Stand: 6. Juli 2008) präsentiert die Firma Antigenics Inc. stolz die Zulassung und EWinführung des Medikaments auf dem russischen Markt und äußert sich auch explizit zur angeblich Nutzen stiftenden Einsatz bei Nierzellkrebskranken.
Das Ganze liest sich dann so:
• "In April 2008, Oncophage® (vitespen; formerly HSPPC-96) was approved in Russia for the treatment of kidney cancer patients at intermediate risk for disease recurrence. The company expects to launch Oncophage in Russia in the second half of 2008. Oncophage is approved only in Russia and Antigenics expects to submit to the European Regulatory Agency before the end of 2008."
• Die selbstgestellte Frage "What are the results from clinical trials of Oncophage?" beantwortet sich der Hersteller dann mit beträchtlichem Mut zur Lücke so: "Data from Antigenics’ Phase 3 trial of Oncophage in kidney cancer showed a 45-percent improvement in recurrence-free survival associated with Oncophage in a well-defined subgroup of earlier stage (better-prognosis) patients, although a significant improvement was not observed in the overall patient population. Additional analysis is ongoing." Vom Hauptergebnis der Studie findet sich kein Wort.
Dieser Umgang mit wissenschaftlichen Ergebnissen und der damit gerechtfertigte recht skrupellose Umgang mit den gesundheitlichen Erwartungen russischer Nierenkranker, ermunterte den us-amerikanischen Onkologen James Yang vom National Cancer Institute in Bethesda zu einem scharf formulierten Editorial in derselben Ausgabe der Zeitschrift "The Lancet" in der auch die Originalstudie veröffentlicht wurde. Er weist auf die offenkundige Neigung der Hersteller hin, sich lediglich auf potentiell positive Teilergebnisse statt auf das negative Gesamtergebnis der Studie zu konzentrieren. Dr. Yang gibt zu bedenken: "Derartige Methoden ähneln dem vorzeitigen Abschuss des Pfeils und der Erlaubnis, das Ziel nachträglich zu kennzeichnen." Angesichts der forcierten Zulassung des Impfstoffs in Russland fordert er außerdem: "Kommerziell getriebene Anstrengungen, welche die Folgerungen einer solchen Studie verdrehen oder verschleiern, sollten energisch abgelehnt werden, da solche Anstrengungen ihren Wert untergraben."
Ein Abstract des in der Onlineausgabe des Medizinjournals "The Lancet" vom 4. Juli 2008 (DOI:10.1016/S0140-6736(08)60697-2) veröffentlichten Aufsatzes "An adjuvant autologous therapeutic vaccine (HSPPC-96; vitespen) versus observation alone for patients at high risk of recurrence after nephrectomy for renal cell carcinoma: a multicentre, open-label, randomised phase III trial" von Christopher Wood und weiteren Mitgliedern der "C-100-12 RCC Study Group" gibt es kostenlos.
Die Selbstdarstellung und -wahrnehmung des Vitespen-Herstellers Antigenics Inc. und der Stellung des Medikaments auf dem russischen Markt kann ausführlich auf der Antigenics-Oncophage-Website nachgelesen werden.
Bernard Braun, 6.7.2008
Wissenschaftler oder Verkäufer? Ärzte im Dienste der pharmazeutischen Industrie
 Im Pharma-Marketing wird unter Key Opinion Leader (KOL) ein Arzt verstanden, der seine Kollegen in ihrer Berufsausübung beeinflusst, insbesondere - aber nicht ausschließlich - in ihrem Medikamentenverschreibungsverhalten. Verwandte englischsprachige Begriffe sind "Thought Leader" und "Opinion and Thought Leader (OTL)" (The Pharma Marketing Glossary ], im Deutschen "Meinungsführer".
Im Pharma-Marketing wird unter Key Opinion Leader (KOL) ein Arzt verstanden, der seine Kollegen in ihrer Berufsausübung beeinflusst, insbesondere - aber nicht ausschließlich - in ihrem Medikamentenverschreibungsverhalten. Verwandte englischsprachige Begriffe sind "Thought Leader" und "Opinion and Thought Leader (OTL)" (The Pharma Marketing Glossary ], im Deutschen "Meinungsführer".
In einem Beitrag im British Medical Journal analysiert der australische Wissenschaftsjournalist Ray Moynihan die Bedeutung der KOLs für die Marketingstrategien der Pharmazeutischen Industrie. Dabei stützt er sich auf Beiträge in Zeitschriften des Pharmazeutischen Marketing sowie auf Interviews mit dem Leiter der Association of the British Pharmaceutical Industry und einer früheren Pharmavertreterin, die fast zwei Jahrzehnte für mehrere große Firmen gearbeitet hat.
Die Bedeutung der KOLs für die Industrie besteht darin, dass sie die Botschaften der Industrie glaubhafter vermitteln, als es der Industrie selbst möglich ist. Um KOLs zu gewinnen, taxieren Mitarbeiter der Marketingabteilungen mögliche Kandidaten bezüglich ihrer Sichtweisen und Meinungen sowie ihres Einflusspotenzials. Bei positiver Beurteilung wird systematisch eine Beziehung aufgebaut, die Kommunikationsmöglichkeiten des KOL werden gefördert. Die so Auserwählten werden kontinuierlich beobachtet und danach bewertet, ob sich die Investition auch bezahlt macht. Für diese Art von Monitoring bieten kleine Firmen Software an, mit der sich die Rentabilität ("return on investment") eines KOL erfassen lässt.
KOLs können als Bezahlung erwarten:
• für einen wissenschaftlichen Vortrag 3.000 Dollar (Quelle Marketwire)
• für wissenschaftliche Beratung bis zu 400 Dollar pro Stunde (Quelle Cutting Edge Information)
• für klinische Forschung als 216,50 englische Pfund pro Stunde (Quelle: British Medical Association)
KOLs sind integraler Bestandteil der Marketing-, Forschungs- und Fortbildungsstrategien der Industrie. Ihr Wert besteht darin, dass sie Einfluss auf das Verschreibungsverhalten ihrer Kollegen über verschiedene Kanäle ausüben - durch Forschung, Vorträge, Veröffentlichungen, Teilnahme an Beratungsgremien, Herausgebergremien von Fachzeitschriften, Fachgesellschaften und in der Entwicklung von Leitlinien. Ihre Verbindungen zur Industrie bleiben dabei zumeist verborgen.
Die Mechanismen und Konsequenzen einseitiger, von der Industrie gesteuerter Informationen über Medikamente hat Ray Moynihan in einer Reihe von Beiträgen im British Medical Journal beschrieben. Hervorgehoben sei hier der 2-teilige Aufsatz "Who pays für the pizza", auf die wir bereits in einer früheren Meldung hingewiesen hatten.
R. Moynihan. Key opinion leaders: independent experts or drug representatives in disguise? BMJ 21.6.2008. Volltext kostenlos. Der Beitrag enthält zwei kurze Videos mit Ausschnitten aus dem Interview mit der früheren Pharmavertreterin.
R. Moynihan. Who pays for the pizza? Redefining the relationships between doctors and drug companies BMJ 31.5.2003
Teil 1 Entanglement
Teil 2 Disentanglement
David Klemperer, 1.7.2008
"Medikament sucht Krankheit": Die Bedeutung von Krankheitserfindung, Medikalisierung oder "disease mongering" im Gesundheitswesen.
 "Immer mehr Menschen werden von einer Befindlichkeitsindustrie aus Ärzten, Pharmafirmen und anderen Profiteuren im Gesundheitsmarkt krankgeredet und krankgemacht werden."
"Immer mehr Menschen werden von einer Befindlichkeitsindustrie aus Ärzten, Pharmafirmen und anderen Profiteuren im Gesundheitsmarkt krankgeredet und krankgemacht werden."
Mit dieser Feststellung beginnt der Medizinredakteur der Süddeutschen Zeitung, Werner Bartens, seinen am 31. Mai 2008 in der "Süddeutschen Zeitung (SZ)" erschienenen Artikel über einige besonders krasse und bekannt gewordenen Fälle von Krankheitserfindungen oder vornehmer ausgedrückt von Medikalisierung.
Die Wahl der Beispiele zeigt, dass es sich hierbei keineswegs um ein Nischengeschehen oder das Werk von "schwarzen Schafen" handelt, sondern ein spürbarer Teil der öffentlich kommunizierten und dramatisierten Risiken sowie des entsprechenden Versorgungsbedarfs auf den Reißbrettern und in den Business-Planungen von Leistungsanbietern und -erbringern generalstabsmäßig entsteht und nicht der Gesundheit der Bevölkerung, sondern den Gewinninteressen der Krankheitserfindern dient.
Die gelegentliche Bezeichnung einer angeblich behandlungsbedürftigen Krankeit als "german disease" (z. B. niedriger Blutdruck bei Mädchen und jungen Frauen) kann als Hinweis auf die besonders weite Verbreitung der Medikalisierung in Deutschland gelten.
Die von Bartens kurz skizzierten Beispiele:
• Raschen Verbreitung von sogenannten "Prä-Erkrankungen", welche die leichte Erhöhung einiger Messwerte zum Ausgangspunkt haben, die bislang als völlig harmlos galten,
• Zunehmend werden Risikofaktoren wie erhöhtes Cholesterin schon als Krankheit angesprochen und für behandlungsbedürftig erklärt,
• Die Thematisierungs-Karriere des Restless-Legs-Syndrom durch den Hersteller eines Medikaments ist ein gelungenes Beispiel für Medikalisierung,
• Gleiches gilt für die Umbenennung von Impotenz in die erektile Dysfunktion (ED) und die Vermarktungstrategie von Viagra durch den Hersteller Pfizer.
• Die "Female Sexual Dysfunction" (FSD), das weibliche Pendant zur ED, ist reine Pathologisierung weiblicher Lust und stellt "ein Lehrbuchbeispiel" der Medikalisierung dar.
• Schließlich zeigt die Karriere der "Bipolar Disorder" wie systematisch eine Erfindung z.B. durch Fachzeitschriften und mit Hilfe der Industrie gegründeten und arbeitenden Fachgesellschaften vorbereitet und vorangetrieben wird.
Wohin die Reise ohne öffentliche Kritik und Gegenwehr gehen könnte umreißt der Leipziger Soziologe Ulrich Bröckling: "Zum Ausgangspunkt für ärztliches Handeln kann schließlich alles werden, was von Normwerten abweicht oder sich als Vorzeichen solcher Abweichungen finden lässt".
Ob dazu allerdings Datenbanken, in denen die Strategien der Krankheitsverkäufer dokumentiert werden, alleine ausreichen, muss angesichts der Stärke der materiellen Interessen hinter der Medikalisierung bezweifelt werden.
Der komplette SZ-Artikel "Die Krankheitsverkäufer" steht kostenlos im Internet zur Verfügung.
Auf jeweils 2 bis 5 Druckseiten hatten angelsächsische Wissenschaftler bereits 2006 etwas umfangreicher und mit ausführlichen Quellennachweisen in der Open-Access-Zeitschrift "PLOS Medicine" (Volume 3, Issue 4, April 2006) über das Phänomen des so genannten "disease mongering" berichtet.
"Disease Mongering" wird das Erfinden und Verkaufen von Krankheiten im Englischen genannt. Mongering bedeutet Handeln, Schachern und dabei einschüchtern - bei dem im Deutschen üblichen passiv wirkenden Wort "Medikalisierung" kommt gerade dieses aktive Erfinden und Verbreiten von Krankheiten nicht so deutlich zum Ausdruck..
Der Themenbogen dieser Beiträge wird sehr breit gespannt:
• "The fight against disease mongering: Generating knowledge for action",
• "Bigger and better: How Pfizer redefined erectile dysfunction",
- "Medicine goes to school: Teachers as sickness brokers for ADHD",
• "Female Sexual dysfunction: A case study of disease mongering and activist resistance",
• "The latest mania: Selling bipolar Disorder",
• "Pharmaceutical marketing and the invention of the medical consumer",
• "Combating disease mongering: Daunting but nonetheless essential",
• "Giving legs to restless legs: A case study of how the media helps make people sick",
• "Cholinesterase inhibitors: Drugs looking for a disease?" und
• "Disease mongering in drug promotion: Do governments have a regulatory role?"
Diese Ausgabe von "PLOS Medicine" erschien in der "Public Library of Science" und umfasst 48 Seiten, die kostenlos als PDF-Datei herunterladbar sind.
Bernard Braun, 8.6.2008
Lockerung des Werbeverbots für verschreibungspflichtige Medikamente - Ablehnung aus Deutschland
 Wie wir berichteten, hat die EU-Kommission einen Vorschlag unterbreitet, der auf eine Lockerung des Werbeverbots für verschreibungspflichtige Medikamente hinausläuft. 185 Stellungnahmen hat die EU-Kommission erhalten, die sie 9 Kategorien von Urhebern zugeordnet hat. Die Auswertung besteht im Wesentlichen aus einer Auszählung der Zustimmungen und Ablehnungen zu einzelnen Fragen.
Wie wir berichteten, hat die EU-Kommission einen Vorschlag unterbreitet, der auf eine Lockerung des Werbeverbots für verschreibungspflichtige Medikamente hinausläuft. 185 Stellungnahmen hat die EU-Kommission erhalten, die sie 9 Kategorien von Urhebern zugeordnet hat. Die Auswertung besteht im Wesentlichen aus einer Auszählung der Zustimmungen und Ablehnungen zu einzelnen Fragen.
Soll die Industrie Patienten über verschreibungspflichtige Medikamente informieren dürfen?
70 Prozent der 59 Organisationen und Personen aus dem Gesundheitswesen (healthcare professionals and organisations) verneinen die Frage, 7 Prozent sprechen sich dafür aus. Bei den 40 Patientenorganisationen sind 50 Prozent dagegen und 25 Prozent dafür. Wenig überraschend sprechen sich 96 Prozent der 26 pharmazeutischen Firmen für die Direktinformation aus, 4 Prozent beziehen nicht Stellung. Insgesamt stimmen 48 Prozent der Verfasser gegen den Vorschlag und 26 Prozent dafür.
Soll die Industrie Informationen zu verschreibungspflichtigen Medikamenten über Radio und Fernsehen verbreiten dürfen?
36 Prozent der Organisationen und Personen aus dem Gesundheitswesen stimmen dagegen, 4 Prozent dafür, 59 Prozent beziehen nicht Stellung.
38 Prozent der Patientenorganisationen stimmen dagegen, 7 Prozent dafür, 53 Prozent äußern sich nicht dazu.
Nur 19 Prozent der Stellungnahmen aus der Industrie sind positiv, 50 Prozent negativ, 31 Prozent äußern sich nicht.
Weitere Ergebnisse beziehen sich auf den Inhalt der Informationen, auf Qualitätskriterien und Überwachungsmechanismen.
Der Vorschlag der EU-Kommission hat also gegensätzliche Stellungnahmen hervorgerufen, rein numerisch mehr ablehnende als zustimmende. Eine breite Front der Ablehnung reicht in Deutschland von der Arzneimittelkommission der deutschen Ärzteschaft über die Bundesvereinigung Deutscher Apothekerverbände, den Gemeinsamen Bundesausschuss, das Deutsches Netzwerk Evidenzbasierte Medizin, die Deutsche Gesellschaft für Sozialmedizin und Prävention, die Deutsche Arbeitsgemeinschaft Selbsthilfegruppen, Deutsche Rheumaliga die BUKO-Pharma-Kampagne bis zur Bundesregierung. Zuletzt hat sich auch der Deutsche Ärztetag gegen die EU-Initiative ausgesprochen. Die Deutsche Schmerzliga unterstützt den Vorschlag in ihrer kurzen Stellungnahme uneingeschränkt.
Wie die EU-Kommission weiter verfahren wird, bleibt offen.
In einem lesenswerten Artikel im Deutschen Ärzteblatt (Heft 23 vom 6. Juni, S.1261) kommen u.a. der EU-Industriekommissar Günter Verheugen und deutsche EU-Abgeordnete zu Wort.
Summary of the public consultation respones, 22.5.2008
Information to Patients - Responses to the Public consultation on the key ideas of a legal proposal on information to patients
David Klemperer, 5.6.2008
Ist die bipolare Depression überdiagnostiziert? Trägt die Industrie dazu bei?
 Diese Fragen wirft eine Studie von Mark Zimmermann und Kollegen aus einer psychiatrischen Klinik in Rhode Island, USA auf. Die bipolare Störung ist eine ernste psychiatrische Erkrankung, die mit wechselnden Phasen von depressiver, bedrückter und manisch gehobener Stimmung einhergeht, in der Regel mit dazwischen liegenden Phasen normaler Stimmung. Die Störung gilt sowohl in den USA als auch in Deutschland als unterdiagnostiziert. Insbesondere geht man davon aus, dass bei vielen Patienten mit der Diagnose Depression tatsächlich eine bipolare Störung vorliegt.
Diese Fragen wirft eine Studie von Mark Zimmermann und Kollegen aus einer psychiatrischen Klinik in Rhode Island, USA auf. Die bipolare Störung ist eine ernste psychiatrische Erkrankung, die mit wechselnden Phasen von depressiver, bedrückter und manisch gehobener Stimmung einhergeht, in der Regel mit dazwischen liegenden Phasen normaler Stimmung. Die Störung gilt sowohl in den USA als auch in Deutschland als unterdiagnostiziert. Insbesondere geht man davon aus, dass bei vielen Patienten mit der Diagnose Depression tatsächlich eine bipolare Störung vorliegt.
Die Deutschen Gesellschaft für Bipolare Störungen behauptet auf ihrer Website, nur die Hälfte der von der Störung Betroffenen erhalte die korrekte Diagnose.
Folge der Fehl- und Unterdiagnose sind laut Zimmermann eine Unterversorgung mit stimmungsstabilisierenden Medikamenten, ein ungünstigerer Verlauf und höhere Kosten.
Zimmermann und Kollegen betreiben ein Projekt zur Verbesserung der Diagnosestellung psychiatrischer Störungen, in dem zwei Methoden verglichen werden - die unstrukturierte klinische Befragung und ein semistrukturiertes Interview (Structured Clinical Interview for DSM-IV / SCID), mit welchem die diagnostischen Kriterien präzise abgefragt werden.
Frühere Untersuchungen hatten gezeigt, dass die Anzahl der erhobenen Diagnosen mit dem genaueren Interviewinstrument SCID viel höher liegt als mit einer unstrukturierten Befragung. In ihrem klinischen Alltag gewannen die Untersucher den Eindruck, dass sich die Verhältnisse für die bipolare Störung umgekehrt hätten. Daher untersuchten sie diese Frage systematisch.
In den Jahren 2001 bis 2005 befragten sie 700 Patienten ihrer psychiatrischen Ambulanz mit dem Diagnose-Interviewinstrument. In einem weiteren Fragebogen gaben die Patienten darüber Auskunft, ob die Diagnose bipolare Störung bei ihnen schon einmal gestellt worden war.
Das strukturierte Interview ergab bei 90 der 700 Patienten die Diagnose bipolare Störung. 145 Patienten (20,7 Prozent) berichteten jedoch, die Diagnose sei bei ihnen bereits gestellt worden. Somit wurde die vom Patienten berichtete Diagnose nur in weniger als der Hälfte der Falle durch das Interviewinstrument bestätigt - ein deutlicher Hinweis auf Überdiagnose. Auf der anderen Seite hatten 30 der 90 Patienten, die mit dem Interviewinstrument eine bipolare Störung zeigten, die Diagnose von ihrem Arzt bis dahin nicht erhalten - ein Zeichen für die weiter bestehende Unterdiagnose.
Die Autoren diskutieren verschiedene mögliche Ursachen für die Überdiagnose, wie z.B. Uneinigkeit der Psychiater bezüglich der diagnostischen Kriterien. Als bedeutsam schätzen sie die Marketing-Aktivitäten der Industrie ein. Mit der Zulassung neuer Substanzen für die Behandlung der bipolaren Störung, wie z.B. Seroquel® (Substanz: Quetiapin) von AstraZeneca, werden sog. Awareness-Kampagnen durchgeführt und Informationen angeboten. Patienten werden durch Direktwerbung im Fernsehen und in anderen Medien auf das Krankheitsbild aufmerksam gemacht. Ein selbst durchzuführender Screeningtest führt häufig zu einem Verdachtsbefund (falsch-positives Ergebnis), der anscheinend von einigen Ärzten unkritisch übernommen wird.
Dieses Erklärungsmuster steht im Einklang mit Erkenntnissen über die Effekte der Direktwerbung für verschreibungspflichtige Medikamente aus anderen Quellen (s.u.).
• Abstract der Studie "Is Bipolar Disorder Overdiagnosed?"
• Informationen zur bipolaren Störung bei Wikipedia
Zwei Studien zu Effekten der Direktwerbung (Volltext kostenlos)
• Creating Demand for Prescription Drugs: A Content Analysis of Television Direct-to-Consumer Advertising. Annals of Family Medicine 5:6-13 (2007)
• Benefits and harms of direct to consumer advertising: a systematic review. Quality and Safety in Health Care 2005;14:246-250
David Klemperer, 19.5.2008
Kein Nutzennachweis aber Milliardenumsätze: Direktwerbung macht's möglich
 Die ENHANCE-Studie hatte ergeben, dass der Zusatz des neuen Blutfette-senkenden Wirkstoffs Ezetimib zur Standardsubstanz Simvastatin die Entwicklung der Arteriosklerose nicht besser beeinflusst als die Standardsubstanz allein. Wir berichteten. Trotzdem gelang es den Firmen Merck & Co./Schering-Plough, die das Medikament gemeinsam vermarkten, Milliardenumsätze zu erzielen.
Die ENHANCE-Studie hatte ergeben, dass der Zusatz des neuen Blutfette-senkenden Wirkstoffs Ezetimib zur Standardsubstanz Simvastatin die Entwicklung der Arteriosklerose nicht besser beeinflusst als die Standardsubstanz allein. Wir berichteten. Trotzdem gelang es den Firmen Merck & Co./Schering-Plough, die das Medikament gemeinsam vermarkten, Milliardenumsätze zu erzielen.
In einer neuen Studie legen kanadische und amerikanische Wissenschaftler dar, wie sich die Verschreibung von Ezetimib im Vergleich zu anderen Lipidsenkern und im Ländervergleich USA und Kanada entwickelt hat.
In den Jahren 2002 bis 2006 stieg die Anzahl der Verschreibungen für Lipidsenker in Kanada von 3719 auf 7401 pro 100.000 Einwohner, in den USA von 3927 auf 6827. Von 2003 bis 2006 stieg der Anteil für Ezetimib in Kanada von 0,2 Prozent auf 3,4 Prozent, in den USA von 0,1 Prozent auf 15,2 Prozent. Die Ausgaben für Ezetimib waren in den USA pro 100.000 Einwohner um den Faktor 4 höher als in Kanada. Die Pro-Kopf-Ausgaben für Ezetimib betrugen 2006 in Kanada 2,16 Dollar, in den USA 9,47 Dollar.
In den USA gewann Ezetimib also einen deutlich höheren Marktanteil mit entsprechend höheren Umsätzen
Als Gründe für die höheren Verschreibungsraten für Ezetimib nennen die Autoren die in den USA erlaubte Direktwerbung, die stärkere Werbung gegenüber Ärzten in den USA, die Nicht-Zulassung des Kombinationspräparates Vytorin® in Kanada sowie die Erstattung von Ezetimib nur als Reservemittel durch die bevölkerungsreichsten kanadische Provinzen.
Trotz fehlenden Nutzennachweises wurde die Substanz und insbesondere die Kombination Vytorin® aggressiv beworben. In den USA flossen im Jahr 2007 über 200 Millionen Dollar in die Ezetimib-Direktwerbung für Patienten (die USA und Neu Seeland sind die einzigen Länder auf der Welt, in denen die Direktwerbung für verschreibungspflichtige Medikamente erlaubt ist). Der weltweite Umsatz betrug 2007 mehr als 5 Milliarden Dollar.
Diese Studie bestätigt, dass die Direktwerbung gegenüber Patienten durch die Industrie zu höheren Kosten bei geminderter Qualität führen kann.
Dadurch wird auch erneut deutlich, dass die von der EU-Kommission angestrebte Erweiterung der Möglichkeiten für die Industrie, die Patienten direkt zu informieren, zu einer Verschlechterung der Qualität der Arzneimitteltherapie führen würde.
Abstract der Studie im New England Journal of Medicine
Ein Beispiel für die Werbung für Vytorin im amerikanischen Fernsehen.
David Klemperer, 14.5.2008
Brasilianische Studie: Werbeprospekte für Psychopharmaka irreführend
 Vor kurzem berichteten wir unter Überschrift "Dichtung und Wahrheit in der Werbung für Psychopharmaka" über die erste Studie, die sich mit dem Wahrheitsgehalt der Werbeaussagen für Psychopharmaka befasste. Dieses Thema beleuchtet nun eine weitere Studie aus Brasilien, die in der Juni-Ausgabe der Revista de Saúde Pública (Zeitschrift für Public Health) erscheint.
Vor kurzem berichteten wir unter Überschrift "Dichtung und Wahrheit in der Werbung für Psychopharmaka" über die erste Studie, die sich mit dem Wahrheitsgehalt der Werbeaussagen für Psychopharmaka befasste. Dieses Thema beleuchtet nun eine weitere Studie aus Brasilien, die in der Juni-Ausgabe der Revista de Saúde Pública (Zeitschrift für Public Health) erscheint.
In der Studie wurden Werbeprospekte für Psychopharmaka gesammelt und analysiert, die Ärzte in Kliniken und Gesundheitsstationen in der südostbrasilianischen Stadt Araraquara im Jahr 2005 erhielten. Die Bewertung des Wahrheitsgehaltes erfolgte durch zwei unabhängig voneinander arbeitende Untersucher. Stimmten diese in ihrem Urteil nicht überein entschied ein dritter Untersucher.
167 unterschiedliche Werbeprospekte wurden gefunden, 41,9 Prozent bezogen sich auf Antidepressiva, 24,5 Prozent auf angstlösende Medikamente. 15 Prospekte wurden ausgeschlossen, weil sie keinen Literaturhinweis enthielten. Die verbliebenen 152 Prospekte enthielten 304 Aussagen, die mit einer Quellenangabe versehen waren. Die Quellen wurden von den pharmazeutischen Firmen erbeten, 66,7 Prozent wurden zugänglich gemacht.
67,7 Prozent der Werbeaussagen stimmten mit den Quellen überein, der Rest nur teilweise oder gar nicht. Die Studie zeigt, dass ein Teil der Aussagen zur Wirksamkeit, der Sicherheit und den Kosten von Psychopharmaka nicht mit den wissenschaftlichen Quellen übereinstimmen und dabei stets die Wirklichkeit beschönigen.
Die Autoren fordern ein verbessertes Monitoring von Werbematerialien der Industrie. Die Analyse von Medikamentenwerbung solle auch Inhalt der Medizinerausbildung werden.
Arbeit im Volltext: Propagandas de medicamentos psicoativos: análise das informações científicas Rev Saúde Pública
Dichtung und Wahrheit in der Werbung für Psychopharmaka
David Klemperer, 8.5.2008
Einflussnahme der Industrie mindern - Forderungen einer Arbeitsgruppe der medizinischen Fakultäten in den USA
 Eine Arbeitsgruppe der Association of American Medical Colleges (AAMC) hat Vorschläge zur Begrenzung der Einflussnahme der Industrie auf die akademische Medizin vorgelegt. Die AMCC vertritt alle medizinischen Fakultäten in den USA (129) und in Kanada (17) sowie 400 Lehrkrankenhäuser (AAMC at a Glance). In dem 43-seitigen Bericht heißt es, dass die Beziehungen zwischen den medizinischen Fakultäten und Lehrkrankenhäusern auf der einen Seite und der Industrie auf der anderen Seite neu und klar geregelt werden müssen, nachdem die akademische Medizin in den letzten Jahrzehnten in ihren Kernaufgaben der Lehre und Forschung zunehmend von der Industrie abhängig geworden sei.
Eine Arbeitsgruppe der Association of American Medical Colleges (AAMC) hat Vorschläge zur Begrenzung der Einflussnahme der Industrie auf die akademische Medizin vorgelegt. Die AMCC vertritt alle medizinischen Fakultäten in den USA (129) und in Kanada (17) sowie 400 Lehrkrankenhäuser (AAMC at a Glance). In dem 43-seitigen Bericht heißt es, dass die Beziehungen zwischen den medizinischen Fakultäten und Lehrkrankenhäusern auf der einen Seite und der Industrie auf der anderen Seite neu und klar geregelt werden müssen, nachdem die akademische Medizin in den letzten Jahrzehnten in ihren Kernaufgaben der Lehre und Forschung zunehmend von der Industrie abhängig geworden sei.
Die Geschenke und die Unterstützung der Industrie könnten die Objektivität und Integrität der Medizinerausbildung, der Forschung und der Patientenversorgung gefährden. Es gebe mittlerweile ein gesichertes sozialpsychologisches und neurobiologisches Wissen um die Effekte interpersonaler Beziehungen und um die Wirkung von Geschenken auf die Entscheidungen derjenigen, die Geschenke erhalten. Dies gehe auf Kosten der Glaubwürdigkeit in der Öffentlichkeit.
Alle Fakultäten sollen daher klare Regelungen treffen. Dazu macht die Arbeitsgruppe eine Reihe von Vorschlägen. Hier eine Auswahl:
• Unterrichtprogramme sollen entwickelt werden mit dem Ziel, das Bewusstsein von Studenten und akademischen Lehrer für die Probleme zu verbessern, die durch bestimmte Interaktionen mit der Industrie auftreten können
• Einzelpersonen sollen keinerlei Geschenke von der Industrie annehmen
• Pharmavertreter sollen Ärzte nur nach Vereinbarung und nur in Bereichen treffen, in denen keine Patienten behandelt werden
• Industrie-gesponserte Fortbildungsveranstaltungen sollen akkreditiert sein, von der Fakultät zentral erfasst und beaufsichtigt werden
• Die Fakultäten sollten ihren Mitgliedern dringend davon abraten, sich über durch Industrie-gesponserte Agenturen (industry-sponsored speakers' bureaus) als Referenten vermitteln zu lassen
• Die Teilnahme an Veranstaltungen, die nicht akkreditiert sind, soll verboten werden, ebenso die Annahme einer Bezahlung für die Teilnahme an Industrie-gesponserten Veranstaltungen und die Annahme von Geschenken.
• Alle Zuwendungen der Industrie für die Ausbildung und Fortbildlung müssen zentral von der Fakultät verwaltet und ohne Beteiligung der Industrie vergeben werden
• Die Erstattung von Reisekosten durch die Industrie soll eingeschränkt werden.
• Die Fakultäten sollen jegliche Form von Ghostwriting verbieten (Wissenschaftler fungieren als Autoren für Arbeiten, die sie nicht geschrieben haben).
(siehe dazu auch: Ghost writing für Vioxx - Merck forscht und schreibt, Wissenschaftler geben ihren Namen und Arzneimittelstudien zwischen Geist und Ghostwritern).
Insgesamt zeichnet sich der Bericht dadurch aus, dass die Probleme der Einflussnahme der Industrie auf die US-amerikanische akademische Medizin angesprochen und als dringend als lösungsbedürftig bezeichnet werden. Inwieweit die Lösungsvorschläge tatsächlich den erforderlichen Abstand zur Industrie herstellen können, bleibt abzuwarten. Die Industrie sowie die von den engen Beziehungen profitierenden medizinischen Institutionen und Individuen werden jedes verbleibende Schlupfloch nutzen.
• Industry Funding of Medical Education Report of an AAMC Task Force, Association of American Medical Colleges, June 2008
• Group Urges Ban on Medical Giveaways (New York Times 28.4.2008)
David Klemperer, 1.5.2008
Dichtung und Wahrheit in der Werbung für Psychopharmaka
 Eine Reihe von Untersuchungen hat sich mit der Frage des Wahrheitsgehalts und der wissenschaftlichen Nachvollziehbarkeit von Aussagen in der Werbung für Medikamente befasst. Im Ergebnis zeigte sich konsistent, dass ein hoher Anteil von Behauptungen durch die angegebenen Quellen nicht bestätigt und ein Teil nicht mit Quellen belegt war.
Eine Reihe von Untersuchungen hat sich mit der Frage des Wahrheitsgehalts und der wissenschaftlichen Nachvollziehbarkeit von Aussagen in der Werbung für Medikamente befasst. Im Ergebnis zeigte sich konsistent, dass ein hoher Anteil von Behauptungen durch die angegebenen Quellen nicht bestätigt und ein Teil nicht mit Quellen belegt war.
Die Werbung für Psychopharmaka war bislang nicht untersucht worden. Dies holten Spielmans und Kollegen jetzt mit einer Studie nach, die in der April Ausgabe des Journal of Nervous and Mental Disease erschienen ist.
Die Wissenschaftler analysierten alle 69 Anzeigen, die im Jahr 2005 in je zwei hochrangigen psychiatrischen und allgemeinmedizinischen Fachzeitschriften erschienen sind (Archives of General Psychiatry, American Journal of Psychiatry, New England Journal of Medicine, Journal of the American Medical Association).
In den 69 Anzeigen fanden sich insgesamt 327 relevante Behauptungen. Die Behauptungen wurden kategorisiert in Wirksamkeit, Sicherheit, Merkmale der Krankheit, Wirkmechanismus und Grad der Verbreitung und Bequemlichkeit der Einnahme. 164 Behauptungen (50,2%) waren entweder durch eine nicht verfügbare oder durch gar keine Quelle belegt und somit nicht nachvollziehbar. Für 163 Behauptungen waren Quellen angegeben, die in 65 Prozent die Aussagen bestätigten. In der Kategorie Wirksamkeit wurden nur 53,2 Prozent der 94 Behauptungen bestätigt.
Falsche Behauptungen bezogen sich z.B. auf die Gewichtszunahme unter dem Neuroleptikum (Antipsychotikum) Risperidon und auf die Wirksamkeit der gegen die Alzheimerdemenz eingesetzten Substanz Memantine.
Die Studie bestätigt einmal mehr die Unzuverlässigkeit der "Information" in Anzeigen für Medikamente. Bislang ist die pharmazeutische Industrie den Beweis schuldig geblieben, dass sie in Anzeigen seriös, zuverlässig und wissenschaftlich fundiert über ihre Produkte informieren kann.
Hier ist ein Abstract: Spielmans GI, Thielges SA, Dent AL, Greenberg RP.: The accuracy of psychiatric medication advertisements in medical journals (J Nerv Ment Dis. 2008 Apr;196(4):267-73)
David Klemperer, 24.4.2008
Ghost writing für Vioxx - Merck forscht und schreibt, Wissenschaftler geben ihren Namen
 Eine neue Studie erlaubt einen tiefen Einblick in das Phänomen von "ghostwriting" und "ghost authorship". Ghost authorship besteht, wenn die Personen, die ein Studienprotokoll geschrieben, die Daten ausgewertet oder das Manuskript geschrieben haben nicht als Autor genannt werden. Pharmazeutische Firmen versuchen auf diese Weise, selbst gefertigten Studien einen neutralen Anstrich zu geben. Wir berichteten bereits über eine Arbeit von Gøtzsche et al. Ghostwriting und Ghost authorship sind zwar bekannte und vermutlich weit verbreitete Phänomene, aber schwer nachzuweisen, weil sich die Beteiligten naturgemäß in Schweigen hüllen. Zwei Gerichtsverfahren um das Medikament Rofecoxib (Vioxx®) haben nun die seltene Möglichkeit eröffnet, die Praxis im Sinne einer Fallstudie zu analysieren.
Eine neue Studie erlaubt einen tiefen Einblick in das Phänomen von "ghostwriting" und "ghost authorship". Ghost authorship besteht, wenn die Personen, die ein Studienprotokoll geschrieben, die Daten ausgewertet oder das Manuskript geschrieben haben nicht als Autor genannt werden. Pharmazeutische Firmen versuchen auf diese Weise, selbst gefertigten Studien einen neutralen Anstrich zu geben. Wir berichteten bereits über eine Arbeit von Gøtzsche et al. Ghostwriting und Ghost authorship sind zwar bekannte und vermutlich weit verbreitete Phänomene, aber schwer nachzuweisen, weil sich die Beteiligten naturgemäß in Schweigen hüllen. Zwei Gerichtsverfahren um das Medikament Rofecoxib (Vioxx®) haben nun die seltene Möglichkeit eröffnet, die Praxis im Sinne einer Fallstudie zu analysieren.
Als Datenquelle haben die Wissenschaftler, die als Kläger in den Verfahren auftraten, aus mehreren Millionen internen Dokumenten aus den Jahren 1996-2004, welche die Firma Merck den Gerichten zur Verfügung stellen musste, 250 für ihre Fallstudie ausgesucht - zu finden auf der Website The Drug Industry Document Archive.
Dabei wurden Dokumente gefunden, die belegen, dass Mitarbeiter von Merck für die Veröffentlichung von klinischen Studien Manuskripte erstellt und anschließend Wissenschaftler von Universitäten gewonnen haben, als Autoren zu fungieren, zumeist an erster oder zweiter Stelle. Teils geschah dies in Zusammenarbeit mit Veröffentlichungsfirmen ("medical publishing companies"), Firmen, deren Aufgabe es ist, im Auftrag von pharmazeutischen Unternehmen Medikamentenstudien in wissenschaftlichen Fachzeitschriften zu platzieren (s.a. Ghost Management: How Much of the Medical Literature Is Shaped Behind the Scenes by the Pharmaceutical Industry?
Für die Veröffentlichung von Übersichtsarbeiten fanden sich Dokumente, die belegen, dass Mitarbeiter der Marketinabteilung von Merck Pläne entwickelten, Manuskripte von Veröffentlichungsfirmen schreiben zu lassen und universitäre Wissenschaftler zu gewinnen, die sich gegen Bezahlung als Autor ausgeben ("ghost-writing"). Bei 22 von 24 klinischen Studien war die finanzielle Unterstützung von Merck offen gelegt, aber nur bei 36 von 72 Übersichtsarbeiten.
Die kostenlos im Volltext verfügbare Studie schildert anhand von Dokumenten detailliert, mit welchen Mitteln Merck auf die Veröffentlichungen zu Rofecoxib Einfluss genommen hat, ein Medikament, dass wegen der Erhöhung des Herzinfarktrisikos im September 2004 vom Markt genommen werden musste.
In einem begleitenden Editorial stellen Catherine DeAngelis und Phil Fontanarosa als Herausgeber des Journal of the American Medical Association 11 Forderungen auf zur Sicherung bzw. Wiederherstellung der Integrität und Glaubwürdigkeit biomedizinischer Forschung. Dazu zählt u.a. die Ächtung und Bestrafung von ghost authorship und die Pflicht, bei gesponserten Studien eine Datenanalyse von einem unabhängigen Statistiker durchführen zu lassen.
• Guest Authorship and Ghostwriting in Publications Related to Rofecoxib JAMA, 16.4.2008. Studie kostenlos im Volltext
• Impugning the Integrity of Medical Science: The Adverse Effects of Industry Influence Editorial kostenlos im Volltext
David Klemperer, 19.4.2008
350.000 Dollar jährliche Arzneimittelkosten pro Patient - Empfehlen Pharmahersteller eine zu hohe Medikamenten-Dosis?
 "Cerezyme®" ist ein Medikament, das bei Morbus Gaucher häufig verschrieben wird, einer seltenen Erbkrankheit mit einem Enzymmangel. Weltweit leiden nur etwa 5.000 Menschen darunter. Die Krankheit ist bei medikamentöser Behandlung an sich unproblematisch und auch Nebenwirkungen sind eher selten. Zu einem Problem und Konfliktstoff sind jetzt jedoch, wie die Zeitschrift New York Times berichtete, in den USA die hohen Kosten für das Medikament geworden. Je nach Gewicht des Patienten kann die Behandlung nur mit diesem Arzneimittel sich bei einem Patienten auf bis zu 350.000 Dollar (210.000 Euro) jährlich summieren.
"Cerezyme®" ist ein Medikament, das bei Morbus Gaucher häufig verschrieben wird, einer seltenen Erbkrankheit mit einem Enzymmangel. Weltweit leiden nur etwa 5.000 Menschen darunter. Die Krankheit ist bei medikamentöser Behandlung an sich unproblematisch und auch Nebenwirkungen sind eher selten. Zu einem Problem und Konfliktstoff sind jetzt jedoch, wie die Zeitschrift New York Times berichtete, in den USA die hohen Kosten für das Medikament geworden. Je nach Gewicht des Patienten kann die Behandlung nur mit diesem Arzneimittel sich bei einem Patienten auf bis zu 350.000 Dollar (210.000 Euro) jährlich summieren.
In Anbetracht der in den letzten Jahren auch in den USA massiv gestiegenen Kosten für die Arzneimittel melden sich jetzt in den USA gehäuft Mediziner zu Wort, die das herstellende Pharma-Unternehmen "Genzyme" beschuldigen, es würde eine viel zu hohe Dosierung empfehlen. Bis zu 200.000 Dollar könnte man pro Patient im Jahr einsparen, wenn die in anderen Ländern übliche niedrigere, aber zur Therapie genauso wirksame Dosierung erfolgte. Allerdings würde dies den Gewinn des Herstellers nachhaltig trüben: Mit Cerezyme machte man 2007 einen Umsatz von 1.1 Milliarden Dollar.
Nach Angaben des Herstellers ist die empfohlene Dosis für das Medikament alle zwei Wochen 60 Einheiten pro Kilogramm Gewicht. Bei dieser Dosierung betragen die Behandlungskosten für einen männlichen Patienten mit 70 kg Köpergewicht etwa 350.000 Dollar im Jahr. Aber die verschriebene Durchschnittsmenge beträgt im internationalen Durchschnitt nur 34 Einheiten und liegt in Israel mit 15 Einheiten noch erheblich darunter. In einer 2006 in der Zeitschrift "Blood" veröffentlichten Studie wurden Patienten aus den Niederlanden (mit sehr niedriger Dosierung) und aus Deutschland (mit hoher Dosierung) verglichen. Zwischen den Gruppen zeigten sich für die klinischen Haupteffekte keine Unterschiede, allerdings wiesen die deutschen Patienten etwas bessere Werte auf für zwei Neben-Indikatoren, die den Knochenzustand betrafen.
In dem jetzt in der New York Times veröffentlichten Artikel von Andrew Pollack wurde deutlich, dass die Diskussion um Cerezyme keineswegs einen Einzelfall betrifft, sondern die hohen Arzneimittelkosten und die Frage der notwendigen Dosierung von Medikamenten eine allgemeinere Problematik betreffen. Man vermutet, dass viele Pharmaunternehmen sich über zu hohe Dosierungsempfehlungen zusätzliche Gewinne verschaffen, Gewinne, die allerdings zu Lasten der US-Krankenversicherungen Medicare (für behinderte und ältere US-Bürger ab 65) oder Medicaid (für finanziell bedürftige, verarmte US-Bürger) gehen. Andere Fälle, über die die New York Times jetzt berichtete:
• Das Medikament "Avastin" (Hersteller: Genentech) wird von vielen Ärzten jetzt in niedrigerer Dosierung verordnet, seit eine Studie unlängst zeigte, dass die Hälfte der vom Hersteller empfohlenen Menge des Wirkstoffs therapeutisch ebenso gut wirkt. Dadurch werden pro Patient bis zu 50.000$ jährlich eingespart.
• In einem Brief, der im September 2007 in der Zeitschrift "Journal of Clinical Oncology" veröffentlicht wurde, argumentiert ein Mediziner, für alle drei Krebs-Medikamente des Unternehmens Genentech, Herceptin, Rituxan und Avastin, würden zu hohe Dosierungen empfohlen .
• Wissenschaftler berichteten 2007, dass eine zweistündige Infusion mit dem Medikament "Integrilin" (Hersteller: Schering-Plough) für viele Patienten ebenso wirksam und ausreichend sei wie die als Standard empfohlene 18-stündige Infusion.
• Festgestellt wird in der NYT schließlich auch, dass viele Ärzte die Dosierung von Anämie-Medikamenten der Hersteller Amgen sowie Johnson & Johnson inzwischen massiv reduzieren.
Der Artikel in der New York Times ist hier kostenlos nachzulesen: Andrew Pollack: Cutting Dosage of Costly Drug Spurs a Debate (New York Times, March 16, 2008)
Gerd Marstedt, 19.3.2008
GlaxoSmithKline entgeht Anklage wegen Gesetzeslücke
 Am 2. März 2004 hatte das Canadian Medical Association Journalberichtet, dass die Firma GlaxoSmithKline (GSK) Daten zurückgehalten hat, die auf ein erhöhtes Suizidrisiko für Kinder und Jugendliche bei Einahme des Antidepresivums Seroxat hinwiesen - die Veröffentlichung sei "kommerziell nicht akzeptabel", hieß es in einem firmeninternen Papier.
Am 2. März 2004 hatte das Canadian Medical Association Journalberichtet, dass die Firma GlaxoSmithKline (GSK) Daten zurückgehalten hat, die auf ein erhöhtes Suizidrisiko für Kinder und Jugendliche bei Einahme des Antidepresivums Seroxat hinwiesen - die Veröffentlichung sei "kommerziell nicht akzeptabel", hieß es in einem firmeninternen Papier.
Wie das British Medical Journal jetzt meldet, hat die Untersuchung der englischen Arzneimittelsicherheitsbehörde MHRA den Tatbestand der Verheimlichung in vollem Umfang bestätigt. Anklage wird aber nicht erhoben, weil die EU-Gesetzgebung zum damaligen Zeitpunkt nicht zur Meldung unerwünschter Arzneimittelwirkungen bei Indikationen verpflichtete, für die das Medikament nicht zugelassen war. In einem Brief an GSK weist der Leiter der englischen Arzneimittelsicherheitsbehörde auf die moralische Verpflichtung zur Veröffentlichung hin, welcher GSK nicht nachgekommen sei.
In den USA war GSK im Jahr 2004 vom Staat New York wegen wiederholtem und anhaltendem Betrug angeklagt. Eine mögliche Untersuchung und Verurteilung vermied die Firma durch einen Vergleich, in dem sie sich zu einer Zahlung von 2,5 Millionen Dollar und der Einrichtung eines Studienregisters verpflichtete.
• BMJ: Editorial A legal framework for drug safety (15.3.2008)
• MHRA Abschlussbericht, Pressemitteilung, Brief an GSK (6.3.2008)
• BMJ GlaxoSmithKline to set up comprehensive online clinical trials register (11.9.2004)
• CMAJ. Drug company experts advised staff to withhold data about SSRI use in children (2.3.2004)
David Klemperer, 14.3.2008
Pro und Kontra Direktwerbung für verschreibungspflichtige Medikamente: die Industrie beherrscht die Berichterstattung in den amerikanischen Nachrichtenmedien
 Werbung für verschreibungspflichtige Medikamente, die sich direkt an den Patienten richtet (direct to consumer advertising, DTCA) ist weltweit nur in den USA und in Neu Seeland erlaubt. In den USA hatte die Food and Drug Administration im Jahr 1997 durch Neufassung der Bestimmung über den Umfang der Pflichtinformationen einen Boom in der Fernsehwerbung für Medikamente ausgelöst. Durch Minderung der Informationsanforderungen wurde die Medikamentenwerbung TV-tauglich gemacht.
Werbung für verschreibungspflichtige Medikamente, die sich direkt an den Patienten richtet (direct to consumer advertising, DTCA) ist weltweit nur in den USA und in Neu Seeland erlaubt. In den USA hatte die Food and Drug Administration im Jahr 1997 durch Neufassung der Bestimmung über den Umfang der Pflichtinformationen einen Boom in der Fernsehwerbung für Medikamente ausgelöst. Durch Minderung der Informationsanforderungen wurde die Medikamentenwerbung TV-tauglich gemacht.
In einer im Januar 2008 veröffentlichten Studie " News media coverage of direct-to-consumer pharmaceutical advertising" untersuchen die Soziologin Heather Hartley und die Kommunikationswissenschaftlerin Cynthia-Lou Coleman die Berichterstattung zu den Kontroversen um DTCA in amerikanischen Tageszeitungen. Dabei ging es um die Frage, welcher der Akteure (Pharmazeutische Industrie, Wissenschaftler bzw. universitäre Forschungseinrichtungen, Gesundheitsbehörden, Kostenträger, Leistungserbringer und Konsumentenverbände) in den Zeitungen die meiste Präsenz hat.
Die Wissenschaftler gehen davon aus, dass die Medien sozusagen die Bühne darstellen, auf der unterschiedliche Interessengruppen ihre Kämpfe um Macht und Einfluss austragen. Der Zugang zu den Medien ermöglicht es, ein Problem aus der eigenen Perspektive darzustellen (framing) und damit auf die öffentliche Wahrnehmung von Problemen und Problemlösungen einzuwirken.
Acht amerikanische Tageszeitungen wurden für den Zeitraum August 1997 bis Juli 2003 untersucht auf alle Meldungen und Berichte, die sich mit Pro und Kontra von DTCA befassten.
145 Artikel mit 436 Quellen wurden gefunden und analysiert bezüglich der folgenden Fragen:
1. Wie oft erscheinen Akteure als Quelle in der Berichterstattung über DTCA (Prävalenz)?
2. Wie wirksam sind die Quellen (gemessen als Wahrscheinlichkeit, direkt zitiert zu werden, als Anzahl der Wörter pro Zitat und als erste Quelle im Artikel)
3. Wie sind die Anteile von Befürwortern und Gegnern von DTCA verteilt (relative Prävalenz)?
Insgesamt machte die die Pharmazeutische Industrie 20 Prozent der Quellen aus, als erste Quelle wurde sie in 12 Prozent aufgeführt. Wissenschaftler bzw. universitäre Forschungseinrichtungen waren mit 15 Prozent die zweithäufigste Quelle, unter den Erstquellen führten sie mit 19 Prozent. Die Konsumentenseite machte 9 Prozent der Quellen aus und 7 Prozent der Erstquellen.
Aufgrund dieser und zusätzliche Auswertungen kommen die Autoren zum Ergebnis, dass die Industrie unter allen Akteuren die besten Möglichkeiten hat, ihre Sicht der Dinge in den Medien darzustellen. Skeptiker und Gegner der DTCA kommen weniger zu Wort, insbesondere die Konsumenten und Leistungserbringer sind kaum präsent.
Abstract der Studie
Der Volltext kostet 15 $.
Eine besondere Aktualität hat die Studie durch die aktuellen Bestrebungen der Europäischen Kommission, der Pharmazeutischen Industrie zu erlauben, über ihre Produkte in Radio und Fernsehen zu "informieren" (Public Consultation. Legal proposal on information to patients vom 2. Feburar 2008). Sollte dies umgesetzt werden und sollten die Ergebnisse auf Europa übertragbar sein, würde es schwierig werden, Kritik in den Nachrichtenmedien anzubringen.
David Klemperer, 10.3.2008
ARD-Magazin: Preissteigerungen um 240 Prozent bei Krebsmedikamenten - mit Scheininnovationen
 Die Ausgaben für Krebsmedikamente in der gesetzlichen Krankenversicherung sind nach einem Bericht des ARD-Magazins "Report Mainz" drastisch gestiegen. Arzneimittel zur Behandlung von Krebstumoren verursachten danach im Jahre 2007 Kosten in Höhe von 1,4 Milliarden Euro, das entspricht hochgerechnet auf alle Kassen einer Kostensteigerung um 285 Prozent in den letzten fünf Jahren. Grundlage dieser Zahlen sind Berechnungen der Kaufmännischen Krankenkasse (KKH) auf der Basis offizieller GKV-Daten.
Die Ausgaben für Krebsmedikamente in der gesetzlichen Krankenversicherung sind nach einem Bericht des ARD-Magazins "Report Mainz" drastisch gestiegen. Arzneimittel zur Behandlung von Krebstumoren verursachten danach im Jahre 2007 Kosten in Höhe von 1,4 Milliarden Euro, das entspricht hochgerechnet auf alle Kassen einer Kostensteigerung um 285 Prozent in den letzten fünf Jahren. Grundlage dieser Zahlen sind Berechnungen der Kaufmännischen Krankenkasse (KKH) auf der Basis offizieller GKV-Daten.
Obwohl die Fallzahlen für Krebs deutlich gesunken sind, seien gleichzeitig die Ausgaben für Fertigarzneimittel zur Krebsbehandlung in der KKH um 240 Prozent gestiegen, erklärte KKH-Vorstandschef Ingo Kailuweit dem ARD-Magazin. Normal seien Kostensteigerungen von fünf bis sechs Prozent pro Jahr. "Wenn man von dieser Größenordnung von über 240 Prozent spricht, dann ist das exorbitant", fügte Kailuweit hinzu. "Das heißt also letztendlich, hier kommt das zum Tragen, was wir immer wieder kritisieren: Die Pharmaindustrie kann nach völlig freien Marktmechanismen den Preis für Arzneimittel festsetzen."
Im dem Beitrag wird außerdem Prof. Wolf-Dieter Ludwig, der Vorsitzende der Arzneimittelkommission der deutschen Ärzteschaft zitiert, der darauf hinweist, dass viele neue Krensmedikamente zwar teurer als ältere seien, aber leider keinen Zusatznutzen zeigen würden: "Die meisten der neuen Wirkstoffe haben noch nicht bewiesen, dass sie für Krebspatienten einen wirklichen Zusatznutzen bringen."
Dieselbe Argumentation vertritt auch Prof. Dieter Hölzel, der im Tumorregister München seit mehreren Jahrzehnten die Krebsdaten von 70 Krankenhäusern auswertet. Hölzel in einem Interview des Report-Magazins: "Wenn in diesen 25 Jahren große Fortschritte erreicht worden wären, müssten diese sechs Kurven weit auseinander gehen, sodass wir zum Beispiel dann sagen könnten: Siehe da, im Vergleich zu 1980 haben wir jetzt die Überlebenszeiten um zwei Jahre verlängert. In Wirklichkeit sehen wir hier eine geringfügige Verbesserung, die in der Größenordnung von drei Monaten liegt."
Eine "systemsprengende" Wirkung der Preissteigerungen erkennt Prof. Wolf-Dieter Ludwig: "Man spricht im Zusammenhang mit den neuen Wirkstoffen in der Krebstherapie auch von der systemsprengenden Wirkung für die gesetzliche Krankenversicherung. Es wird sicherlich in den nächsten Jahren notwendig sein, hier neue Regularien einzuführen, weil sonst das Gesundheitssystem nicht mehr finanzierbar ist."
Ein Protokoll des Fernsehbeitrags findet man hier: Milliardengeschäft Krebsmedikamente: Wie die Pharmaindustrie mit Scheininnovationen Kasse macht
Gerd Marstedt, 10.3.2008
Pflegekräfte - leichte Beute für die Pharmazeutische Industrie?
 In ihrer Studie "Soft Targets: Nurses and the Pharamceutical Industry" gehen die australischen Autoren Annemarie Jutel und David B. Menekes der Frage nach, wie die Pharmazeutische Industrie auf die Pflege Einfluss nimmt und wie die Pflege darauf reagiert. Ihre Literaturrecherche erbrachte lediglich sieben empirische Untersuchungen, weitere 25 Arbeiten befassten sich mit theoretischen Fragen oder stellten Kommentare oder Meinungsäußerungen dar. Somit kann die Studie weder ein umfassendes noch ein repräsentatives Bild zeichnen. Deutlich wird, dass sich eine Reihe von Aspekten aus dem gut erforschten Verhältnis von Ärzten und Industrie auf die Pflege übertragen lassen. Sowohl die Strategien der Einflussnahme als auch die Reaktion der Pflegekräfte ähneln sich stark. Die Pflege ist von der Industrie als Gruppe mit zunehmendem Einfluss auf die Auswahl von Produkten und Dienstleistungen erkannt, was Fachzeitschriften wie Nursing Standard zur Akquise von Inseraten nutzen.
In ihrer Studie "Soft Targets: Nurses and the Pharamceutical Industry" gehen die australischen Autoren Annemarie Jutel und David B. Menekes der Frage nach, wie die Pharmazeutische Industrie auf die Pflege Einfluss nimmt und wie die Pflege darauf reagiert. Ihre Literaturrecherche erbrachte lediglich sieben empirische Untersuchungen, weitere 25 Arbeiten befassten sich mit theoretischen Fragen oder stellten Kommentare oder Meinungsäußerungen dar. Somit kann die Studie weder ein umfassendes noch ein repräsentatives Bild zeichnen. Deutlich wird, dass sich eine Reihe von Aspekten aus dem gut erforschten Verhältnis von Ärzten und Industrie auf die Pflege übertragen lassen. Sowohl die Strategien der Einflussnahme als auch die Reaktion der Pflegekräfte ähneln sich stark. Die Pflege ist von der Industrie als Gruppe mit zunehmendem Einfluss auf die Auswahl von Produkten und Dienstleistungen erkannt, was Fachzeitschriften wie Nursing Standard zur Akquise von Inseraten nutzen.
Die empirischen Arbeiten zeigen, dass die befragten Pflegekräfte sich ziemlich offen gegenüber der Industrie verhalten. Eine große Mehrzahl bejaht und pflegt Kontakte zu Pharmavertretern. In der jeweiligen Befragung hatten z.B. 88 Prozent keine Bedenken gegen die Annahme von Geschenken, 82 Prozent betrachten Direktwerbung der Industrie (direct to consumer advertising) als Patienteninformation. Pflegekräfte, die Medikamente verschreiben dürfen (wie z.B. in England) betrachten Pharmavertreter als wichtige Informationsquelle und geben an, sich davon beeinflussen zu lassen. Nur eine kleine Minderheit äußert grundsätzliche Bedenken.
Ein buntes Bild ergeben die Kommentare und Meinungsäußerungen. Das Spektrum reicht von vollständiger Gleichsetzung der Interessen von Industrie und Pflege bis zur grundsätzlichen Ablehnung jeglicher Einflussnahmeversuche. Manche Pflegekräfte betrachten die Zuwendung der Industrie mit der Erschließung neuer Informationskanäle als Emanzipation von ärztlicher Dominanz, andere scheinen es als Kränkung zu empfinden, wenn sie keinen Besuch von Pharmavertretern erhalten.
Jutel und Menekes vermissen einen Aufschrei der Pflege gegen die Einflussnahme der Industrie. Sie erklären die positive Haltung ihrer KollegInnen mit Ausbildungsmängeln und daraus folgendem unzureichendem Wissen über Bereiche wie Marketingstrategien der Industrie, Psychologie der Beeinflussung, evidenzbasierte Medizin und kritische Bewertung von Studien und Gesundheitsinformationen.
Als Lösung schlagen die Autoren u.a. eine verbesserte Ausbildung in den genannten Bereichen vor sowie klare Strategien und Richtlinien innerhalb der Einrichtungen.
Studie im Volltext.
Soft Targets: Nurses and the Pharmaceutical Industry, PLoS Medicine Februar 2008
David Klemperer, 28.2.2008
Novartis erhält Höchststrafe für Einladung von Ärzten in den Spreewald
 Die Freiwillige Selbstkontrolle für die Arzneimittelindustrie e.V. (FSA) hat am 18.2.2008 in einer Pressemitteilung bekannt gegeben, dass gegen die Pharmafirma Novartis wegen Verstoß gegen den Verhaltenskodex der FSA das höchstmögliche Ordnungsgeld von 50.000 € verhängt wurde.
Die Freiwillige Selbstkontrolle für die Arzneimittelindustrie e.V. (FSA) hat am 18.2.2008 in einer Pressemitteilung bekannt gegeben, dass gegen die Pharmafirma Novartis wegen Verstoß gegen den Verhaltenskodex der FSA das höchstmögliche Ordnungsgeld von 50.000 € verhängt wurde.
Der Journalist Martin Grill hatte in einem Bericht im STERN vom 29.11.2007 Werbepraktiken von Novartis enthüllt. Ärzte bzw. Ärztinnen waren von Novartis mit ihren Partnerinnen bzw. Partnern für ein Wochenende in das Waldhotel Eiche im Spreewald eingeladen und durften sich dort u.a. an einer vierstündigen Kahnfahrt mit anschließendem Grillabend erfreuen. Aufhänger für den Vergnügungstrip für Ärzte war das neue blutdrucksenkende Medikament Exforge. Novartis hatte sich zum Ziel gesetzt, dass Ärzte bereits im ersten Jahr der Zulassung von Exforge 290.000 Patienten auf das vergleichsweise teure Medikament umstellen. Weitere im STERN -Bericht erwähnte Verstöße gegen den Verhaltenskodex, wie z.B. direkte Geldzahlungen an Ärzte im Zusammenhang mit der Umstellung von Patienten auf Exforge, werden noch verhandelt und können zu weiteren Ordnungsgeldern führen.
Die FSA teilt mit, Novartis zeige sich einsichtig und kooperativ und habe das Ordnungsgeld akzeptiert.
Die Ärztekammer Brandenburg hatte die Veranstaltung als Fortbildung genehmigt. Fragen des STERN-Journalisten Markus Grill hat der Ärztekammerpräsident Dr. Udo Wolter unbeantwortet gelassen. Dem zu vermutenden Verstoß gegen die Berufsordnung (§ 33 Abs.2 " Die Annahme von Werbegaben oder anderen Vorteilen ist untersagt, sofern der Wert nicht geringfügig ist") ist die Ärztekammer Brandenburg unseres Wissens nicht nachgegangen.
Beitrag im STERN von Markus Grill
David Klemperer, 21.2.2008
Pharma-Industrie: Werbung und Marketing hat Vorrang vor Forschung und Entwicklung
 Man kann darüber streiten, ob es "skandalös" ist, wenn in der Pharma-Industrie die Ausgaben für Werbung und Marketing doppelt so hoch sind wie jene für Forschung und Entwicklung oder ob dies in Anbetracht besonders hoher Forschungskosten betriebswirtschaftlich gerechtfertigt ist. Allerdings stellt sich dann die Frage, warum Arzneimittelhersteller bzw. die von ihnen beauftragten Firmen mit geschönten Daten an die Öffentlichkeit treten. Eine jetzt in der Zeitschrift "PLOS Medicine" veröffentlichte Studie hat jedenfalls gezeigt, dass die zumeist herangezogenen Zahlen der Firma "IMS" (ein international im Auftrag von Pharmaherstellern tätiges Unternehmen für Beratung und Datenverarbeitung) über die Ausgaben für Werbung, Sponsoring und Marketing im Pharma-Bereich weit unter dem liegen, was tatsächlich ausgegeben wird.
Man kann darüber streiten, ob es "skandalös" ist, wenn in der Pharma-Industrie die Ausgaben für Werbung und Marketing doppelt so hoch sind wie jene für Forschung und Entwicklung oder ob dies in Anbetracht besonders hoher Forschungskosten betriebswirtschaftlich gerechtfertigt ist. Allerdings stellt sich dann die Frage, warum Arzneimittelhersteller bzw. die von ihnen beauftragten Firmen mit geschönten Daten an die Öffentlichkeit treten. Eine jetzt in der Zeitschrift "PLOS Medicine" veröffentlichte Studie hat jedenfalls gezeigt, dass die zumeist herangezogenen Zahlen der Firma "IMS" (ein international im Auftrag von Pharmaherstellern tätiges Unternehmen für Beratung und Datenverarbeitung) über die Ausgaben für Werbung, Sponsoring und Marketing im Pharma-Bereich weit unter dem liegen, was tatsächlich ausgegeben wird.
Die beiden Wissenschaftler Marc-André Gagnon und Joel Lexchin von der York-Universität (Toronto, Kanada) hatten für ihre Studie Angaben von zwei Marktforschungsinstituten sowie Zahlen der Nationalen Wissenschaftsstiftung für das Jahr 2004 untersucht. In den Medien wurden für das Jahr 2004 zumeist Angaben von IMS oder auch solche der "Pharmaceutical Research and Manufacturers of America (PhRMA)" zitiert. Danach gaben die US-Pharmaunternehmen knapp 30 Milliarden Dollar für Forschung und Entwicklung, aber nur 28 Milliarden für alle Marketing-Aktivitäten aus.
Die Wissenschaftler kamen aufgrund ihrer Recherchen, bei denen sie Daten der Firma CAM nutzten (ein international tätiges Marktforschungsinstitut), jedoch zu anderen Werten. Danach investierten die US-Pharma-Unternehmen im Jahr 2004 insgesamt 57,5 Milliarden Dollar ins Marketing - durch kostenlose Weitergabe von Produkten an Ärzte und Kliniken, durch Anzeigen und TV-Spots, Briefe, Referenten-Besuche bei Ärzten, Seminare und Kongresse zur Vorstellung neuer Medikamente. Für Forschung und Entwicklungsausgaben betrugen die Ausgaben hingegen 31,5 Milliarden Dollar, also etwas mehr als die Hälfte der Werbungskosten. Von 235 Milliarden Dollar Umsatz wurden also 2004 nur 13 Prozent in Forschung und Entwicklung, jedoch 24 Prozent in Marketing-Aktivitäten investiert. Vermutlich - so die Wissenschaftler - lagen die Werbeausgaben sogar noch höher, weil nicht alle Aktivitäten von den Forschungsinstituten erfasst werden konnten.
Die Studie im Volltext: Marc-André Gagnon, Joel Lexchin: The Cost of Pushing Pills: A New Estimate of Pharmaceutical Promotion Expenditures in the United States (PLoS Med 5(1): e1 doi:10.1371/journal.pmed.0050001)
Bereits 2006 hatte der internationale Dachverband der Verbraucherschutzorganisationen "Consumers International" den Pharmaherstellern in seiner von der EU geförderten Studie "Branding the Cure" (etwa: "Die Vermarktung der Therapie") sogar unethisches Verhalten vorgeworfen. Es würden nicht nur Mediziner mit Werbegeschenken und Seminaren zur Verschreibung bestimmter Medikamente beeinflusst, sondern darüber hinaus auch Selbsthilfegruppen durch teilweise hohe Spenden davon abgehalten, die Mitglieder der Gruppen unabhängig und neutral zu informieren. Ebenso betrachtet man in diesem Bericht das EU-Vorhaben mit großer Sorge, die bislang in Europa nicht erlaubten Werbeverbote für verschreibungspflichtige Medikamente, die sich direkt an Patienten und Konsumenten richten, zu lockern.
Der Bericht im Volltext: Branding the Cure - A consumer perspective on Corporate Social Responsibility, Drug Promotion and the Pharmaceutical Industry in Europe
Gerd Marstedt, 10.1.2008
Pharmaindustrie und 3. Welt: Vernachlässigung ihrer Krankheiten und Kranken sowie ihre Entdeckung als lukrativer Markt
 Während in Deutschland und vergleichbaren Ländern Europas und Nordamerikas heftige Debatten um die Anzahl und Aufgaben der "Apotheken um die Ecke" und die Anteile der Internetapotheken geführt werden und ein zähes Ringen um die Zulassung innovativer oder scheininnovativer Medikamente gegen alle möglichen Zivilisationskrankheiten stattfindet, scheitert eine Basisversorgung mit Arzneimitteln bereits wenige Flugstunden in südlicher oder südöstlicher Richtung an einer systematischen Vernachlässigung der Entwicklung von Arzneimitteln für die dort weit verbreiteten Krankheiten und an der, wenn überhaupt, nur auf äußersten staatlichen und öffentlichen Druck abgemilderten Hochpreispolitik.
Während in Deutschland und vergleichbaren Ländern Europas und Nordamerikas heftige Debatten um die Anzahl und Aufgaben der "Apotheken um die Ecke" und die Anteile der Internetapotheken geführt werden und ein zähes Ringen um die Zulassung innovativer oder scheininnovativer Medikamente gegen alle möglichen Zivilisationskrankheiten stattfindet, scheitert eine Basisversorgung mit Arzneimitteln bereits wenige Flugstunden in südlicher oder südöstlicher Richtung an einer systematischen Vernachlässigung der Entwicklung von Arzneimitteln für die dort weit verbreiteten Krankheiten und an der, wenn überhaupt, nur auf äußersten staatlichen und öffentlichen Druck abgemilderten Hochpreispolitik.
Die in Hochglanzprospekten vieler Pharmahersteller immer wieder propagierte besondere Verantwortung und Ethik der Arzneimittelhersteller verhindert in Afrika oder Lateinamerika nicht, dass es entweder gar keine oder nur veraltete Mittel gegen die dort weitverbreiteten Erkrankungen gibt oder vorhandene Arzneimittelmittel um ein Vielfaches zu teuer sind.
Die bereits seit 1942 in Großbritannien existierende und heute international operierende Nichtregierungsorganisation "Oxfam (Oxford Committee for Famine Relief)" hatte bereits 2002 zusammen mit anderen Organisationen den Bericht "Beyond Philanthropy" (K. Bluestone, A. Heaton, and C. Lewis (2002) 'Beyond Philanthropy: The Pharmaceutical industry, corporate social responsibility and the developing world’, Oxfam, Save the Children UK, and VSO) veröffentlicht, in dem die Pharmaindustrie aufgefordert wurde, zu einer besseren Gesundheitsversorgung in den Entwicklungsländern qualitativ und finanziell beizutragen.
Die damals genannten 5 Schwerpunkte waren die Preispolitik, der Umgang mit Patenten, die Mitarbeit in öffentlich-privaten Initiativen, Forschung und Entwicklung spezifischer Medikamente und die Vermittlung des angemessenen Umgangs mit Medikamenten. Wie der Titel des Reports andeutet, ging es bereits damals nicht nur um Menschenfreundlichkeit, sondern durchaus auch um die längerfristigen wirtschaftlichen Interessen der Arzneimittelhersteller an diesen Märkten. 100.000 zum Jahrespreis von 2.000 Euro verkaufte Packungen erbringen weniger Umsatz und Gewinn als 1.000.000 zum Preis von 1.000 Euro verkaufte Packungen desselben Medikaments.
Das jüngste, am 27. November 2007 veröffentlichte "Briefing Paper 109" von Oxfam, kommt unter der Überschrift "Investing for life. Meeting poor people’s needs for access to medicines through responsible business practices" und auf 56 Seiten zu nicht erheblich anderen Beschreibungen der Pharmaindustrie-Strategien in der Dritten Welt als 5 Jahre zuvor.
Bei der Vorstellung des Berichts brachte die deutsche Koordinatorin des Medikamenten-Schwerpunkts von Oxfam, Corinna Heineke, den Sachstand auf folgende Nenner:
• Mehr als 85 % der Menschen weltweit haben keinen oder keinen ausreichenden Zugang zu Medikamenten. Noch immer konsumieren heute die reichsten 15 Prozent der Welt über 90 Prozent aller Medikamente, während in Armut lebende Menschen in Entwicklungsländern keinen Zugang zu bezahlbaren Medikamenten haben.
• Laut Oxfams Bericht investieren die Pharmaunternehmen nicht ausreichend in Forschung und Entwicklung für Medikamente, die vor allem Entwicklungsländer benötigen. Zwischen 1999 und 2004 kamen nur drei innovative Arzneien auf den Markt, die Krankheiten in Entwicklungsländern behandeln - von insgesamt 163 neu vermarkteten Medikamenten. "Zum Beispiel ist das neueste Medikament gegen Tuberkulose 30 Jahre alt. Dabei sterben jedes Jahr zwei Millionen Menschen an TBC", so Heineke.
• Neben dem Mangel an neuen Medikamenten sind auch die von den Pharmaunternehmen geforderten Preise zu hoch. Zwar bieten dem Oxfam-Bericht zufolge einige Unternehmen gestufte Preise an, dies aber nur in sehr begrenztem Umfang und nur für viel diskutierte Krankheiten wie HIV/Aids und Malaria. Die Preisstufen gelten zudem meist nicht weltweit und sind für arme Menschen in Entwicklungsländern oft immer noch zu teuer. Oft bedarf es für Preissenkungen aber erst erheblichen öffentlichen Drucks und langwieriger patentrechtlicher Auseinandersetzungen.
• Beispielsweise verkaufte der Pharmakonzern Abbott sein AIDS-Medikament Kaletra in Ländern geringen bis mittleren Einkommens wie Guatemala für 2.200 US-Dollar pro Patient und Jahr. Das durchschnittliche Pro-Kopf-Einkommen in dem zentralamerikanischen Land liegt bei nur 2.400 US-Dollar jährlich. Erst nachdem Thailand eine Zwangslizenz erteilt hatte, um den Preis für Kaletra auf 1.000 US-Dollar zu senken, reduzierte Abbott die Kosten weltweit auf 1.000 US-Dollar pro Patient und Jahr. Ein weiteres Beispiel ist die Preispolitik, die der französische Pharmamulti Sanofi-Aventis bei seinem Herz-Kreislauf-Medikament Plavix verfolgte: Es wurde zu einem 60-mal höheren Preis verkauft als die generische Version des indischen Herstellers Emcure. Im März 2007 reagierte das Unternehmen auf eine thailändische Zwangslizenz, indem es den Preis um 70 Prozent reduzierte.
• Erneut weisen die Berichterstatter darauf hin, dass sich die Pharmaunternehmen mit dieser Strategie sogar selber und auch ihren an wirtschaftlich leistungsfähigen Entwicklungsländern interessierten Herkunftsländern kurz-, mittel- und langfristig ökonomisch schaden.
Dass dieses Argument sehr ambivalent ist, zeigt eine im neuesten "Pharma-Brief", dem Rundbrief der BUKO Pharma-Kampagne" (Nr. 8, November 2007) (siehe Näheres weiter unten) zu findende Kurzbesprechung der von "Consumers International" (mit 220 Mitgliedsorganisationen in 115 Ländern die weltweit größte unabhängige Konsumentenorganisation) veröffentlichten Studie "Drugs, Doctors and Dinners. How drug companies influence health in the developing world".
Dort wird auf 44 Seiten zuerst beschrieben, dass und wie parallel zu den von Oxfam berichteten Strategien die Schwellen- und Entwicklungsländer einen immer größeren Beitrag zum globalen Umsatzwachstum der Pharmaindustrie liefern. Der Bericht liefert dann zahlreiche konkrete Beispiele aus verschiedenen Entwicklungsländern mit welchen Mitteln die Industrie die dortigen Ärztinnen und Ärzte "im großen Maßstab beeinflusst, manipuliert und mit Geschenken besticht" (BUKO).
Die Oxfam-Studie "Investing for Life" untersucht die Geschäftspolitik der zwölf größten internationalen Pharma-Konzerne hinsichtlich Preisgestaltung, Forschung und Entwicklung von Medikamenten, die insbesondere armen Ländern zugute kommen, und in Hinsicht auf geistige Eigentumsrechte. Der 56 Seiten umfassende Bericht ist hier herunterladbar.
Regelmäßige sachkundige Berichte u.a. über die Strategien der Pharmaunternehmen in den Ländern der Dritten Welt aber auch in der Ersten Welt finden Interessierte im übrigen auch im 10mal jährlich mit jeweils 8 Seiten Umfang erscheinenden Informationsdienst "Pharma-Brief. Rundbrief der BUKO Pharma-Kampagne".
Der komplette Brief kann als PDF-Datei kostenlos auf der Homepage der BUKO Pharma-Kampagne heruntergeladen werden oder gegen eine geringe Gebühr in schriftlicher Form bestellt werden. Auf der BUKO-Website finden sich häufig auch noch weitere aktuellen oder archivierten Materialien aus dem Bereich der unabhängigen Arzneimittel- und Pharmaberichterstattung bis zurück ins Jahr 1996
Bernard Braun, 26.11.2007
Bluthochdruck-Medikamente: Von der Pharma-Industrie gesponserte Studien kommen zu günstigeren Schlussfolgerungen
 Eine Vielzahl wissenschaftlicher Veröffentlichungen hat inzwischen gezeigt, dass klinische Studien, die direkt oder indirekt von Pharma-Unternehmen finanziert wurden, zu sehr viel günstigeren Ergebnissen für die untersuchten Medikamente kommen und damit die Absatzchancen des Herstellers nachhaltig erhöhen (vgl. z.B.: "Arzneimittelstudien bei Brustkrebs: Von der Pharmaindustrie finanzierte Studien kommen zu einer besseren Medikamenten-Bewertung"). Eine im "British Medical Journal" veröffentlichte Auswertung von Meta-Analysen über den Effekt unterschiedlicher Medikamente gegen Bluthochdruck brachte nun ein Ergebnis, das erneut die Fragwürdigkeit interessengelenkter und finanziell nicht unabhängiger Studien aufzeigt.
Eine Vielzahl wissenschaftlicher Veröffentlichungen hat inzwischen gezeigt, dass klinische Studien, die direkt oder indirekt von Pharma-Unternehmen finanziert wurden, zu sehr viel günstigeren Ergebnissen für die untersuchten Medikamente kommen und damit die Absatzchancen des Herstellers nachhaltig erhöhen (vgl. z.B.: "Arzneimittelstudien bei Brustkrebs: Von der Pharmaindustrie finanzierte Studien kommen zu einer besseren Medikamenten-Bewertung"). Eine im "British Medical Journal" veröffentlichte Auswertung von Meta-Analysen über den Effekt unterschiedlicher Medikamente gegen Bluthochdruck brachte nun ein Ergebnis, das erneut die Fragwürdigkeit interessengelenkter und finanziell nicht unabhängiger Studien aufzeigt.
Zwar stellte die Forschungsgruppe aus Stanford und San Francisco einerseits fest, dass die Studien-Ergebnisse selbst nicht beeinflusst waren von der Art der Finanzierung. Andererseits wurde jedoch auch deutlich, dass die jeweils formulierten Schlussfolgerungen ("Conclusions") deutlich wohlwollender und positiver zugunsten des Medikaments ausfallen, wenn die Studie von einem Pharma-Unternehmen ganz oder teilweise gesponsert war.
Basis der Auswertung waren insgesamt 124 Meta-Analysen, die ihrerseits schon veröffentlichte klinische Studien über den Effekt von Arzneimitteln gegen Bluthochdruck bilanziert hatten. Die Meta-Analysen wurden zunächst danach klassifiziert, ob sie von Pharma-Unternehmen gesponsert waren, wobei eine "konservative" Vorgehensweise gewählt wurde: Bei einer gemischten Finanzierung durch teils Pharma-Gelder, teils Gelder öffentlicher oder akademischer Einrichtungen, wurde das Urteil "nicht pharma-abhängig" vergeben. Es zeigte sich dann, dass insgesamt 49 Meta-Analysen (also 40%) eindeutige Beziehungen zu Pharma-Unternehmen aufwiesen.
Die zentrale Befunde waren dann:
• Meta-Analysen mit besserer methodischer Qualität berichteten häufiger über ein positives Ergebnis für das untersuchte Medikament
• Es gab keinen Zusammenhang zwischen der Finanzierung und den Studienergebnissen selbst, also der jeweils ermittelten Wirkung der Medikamente oder ihren Nebenwirkungen
• Ein deutlicher Zusammenhang war indes herstellbar zwischen der Finanzierung und der Art der jeweils gezogenen Schlussfolgerung. Dabei wurden die ursprünglich hierfür gewählten 5 Bewertungskategorien (günstig, ungünstig, unklar, neutral, andere) wiederum recht konservativ zusammengefasst zu nur zwei verbleibenden Urteilen: "günstig" und "nicht günstig"
• Die Wahrscheinlichkeit einer günstigen Schlussfolgerung war dann 4mal so hoch, wenn die Meta-Analyse pharma-gesponsert war
• Wenn dann im Rahmen einer komplizierteren (multivariaten) Analyse noch weitere Aspekte berücksichtigt wurden, die die Art der finanziellen Abhängigkeit genauer berücksichtigten, stieg dieser Wert sogar auf das Fünffache.
Die Studie dokumentiert damit auch nach Aussage der Wissenschaftler sehr eindeutig, dass es in pharma-gesponserten Studien sehr viel öfter eine deutliche Diskrepanz gibt zwischen den Untersuchungs-Resultaten und zugrunde liegenden Daten einerseits und den daraus abgeleiteten Schlussfolgerungen und Empfehlungen andererseits. Hier neigen Wissenschaftler offensichtlich dazu, ihren Interpretationsspielraum voll auszuschöpfen zugunsten ihres Finanziers, auch wenn die Daten dies nicht recht belegen können.
Hier ist ein kostenloses Abstract der Studie: Financial ties and concordance between results and conclusions in meta-analyses: retrospective cohort study (BMJ, doi:10.1136/bmj.39376.447211.BE, published 16 November 2007)
Gerd Marstedt, 18.11.2007
Effekte des Pharma-Sponsoring auf die Ergebnisse klinischer Studien: Nebenwirkungen von Medikamenten werden unterbewertet
 Wieder mal hat eine Metaanalyse gezeigt, dass klinische Studien, die direkt oder indirekt von der Pharmaindustrie gesponsert werden, zu günstigeren Ergebnissen für das untersuchte Arzneimittel kommen als unabhängige Untersuchungen. Am Beispiel sogenannter "inhalativer Steroide", die häufig zur Behandlung von Atemwegserkrankungen verordnet werden, zeigt eine spanische Forschungsgruppe auf, dass die Nebenwirkungen dieser Medikamente in pharma-gesponserten Studien aufgrund methodischer Raffinessen in der Untersuchungsanlage deutlich niedriger ausfallen als in anderen Studien, die von unabhängigen Forschungseinrichtungen durchgeführt wurden.
Wieder mal hat eine Metaanalyse gezeigt, dass klinische Studien, die direkt oder indirekt von der Pharmaindustrie gesponsert werden, zu günstigeren Ergebnissen für das untersuchte Arzneimittel kommen als unabhängige Untersuchungen. Am Beispiel sogenannter "inhalativer Steroide", die häufig zur Behandlung von Atemwegserkrankungen verordnet werden, zeigt eine spanische Forschungsgruppe auf, dass die Nebenwirkungen dieser Medikamente in pharma-gesponserten Studien aufgrund methodischer Raffinessen in der Untersuchungsanlage deutlich niedriger ausfallen als in anderen Studien, die von unabhängigen Forschungseinrichtungen durchgeführt wurden.
Forum Gesundheitspolitik hat schon mehrfach über Metaanalysen berichtet, in denen ein Einfluss der Pharma-Industrie auf die Ergebnisse wissenschaftlicher Studien deutlich wurde. Auch wenn die Mechanismen und Strukturen dieser Einflussnahme erst langsam in ihren Umrissen bekannt werden ("Ghost-Writing", "Ghost-Management", Pharma-Direktwerbung und Internet-Auftritte, Pharmareferenten, Sponsoring von Kongressen und Selbsthilfegruppen, Zuwendungen für Entscheidungsträger in Gesundheitsgremien etc.; vgl.: Einflussnahme der Pharma-Industrie), so zeigen doch viele Vergleiche von Untersuchungsergebnissen, dass sich die finanzielle Unterstützung von Forschungsgruppen durch Pharma-Unternehmen auch direkt in den Ergebnissen niederschlägt und so zur Steigerung der Arzneimittel-Verkaufszahlen beiträgt.
Die Forschungsgruppe aus Valencia (Spanien) hat die Ergebnisse von 504 Veröffentlichungen miteinander verglichen, die sich im Zeitraum 1993-2002 mit der Behandlung von Atemwegserkrankungen durch "inhalative Steroide" (auch bezeichnet als Glukokortikosteroide oder auch Glukosteroide) beschäftigten. 275 Studien wurde als "pharma-unterstützt" eingestuft, 229 als unabhängig. Besondere Aufmerksamkeit galt den Ergebnissen über Nebenwirkungen der Medikamente. Dabei zeigte sich: Nur 35% der pharma-unterstützten Studien, aber fast doppelt so viele (65%) der unabhängigen Studien berichteten über signifikante Nebenwirkungen der untersuchten Arzneimittel.
Die Wissenschaftler konnten sogar die Ursachen dieser unterschiedlichen Befunde herausfinden. Maßgeblich war fast immer ein Untersuchungsdesign, das bei pharma-gesponserten Studien ein positiveres Ergebnis hinsichtlich der Nebenwirkungen von vornherein begünstigte. So zeigte sich etwa: Pharma-Studien waren seltener randomisiert (Zuteilung der Teilnehmer zu Kontroll- und Untersuchungsgruppen nach Zufall), die Arzneimittel-Dosierung war niedriger oder es wurden eher gesunde Patienten und weniger chronisch Erkrankte (z.B. Asthma-Patienten) einbezogen. Nachdem die Wissenschaftler eine multivariate Analyse unter Einhluss der Untersuchungs-Methoden und der Ergebnisse durchgeführt hatten, waren die Unterschiede zwischen unabhängigen Studien und pharma-unterstützten Studien nahezu gleich oder die Differenzen waren zumindest deutlich geringer. Dies bedeutet: Die Pharma-Studien haben ihre für das Medikament positiveren Ergebnisse im Wesentlichen durch ein methodisch weniger strenges Design erzielt.
Die Forscher leiten aus ihren Ergebnissen auch eine gesundheits- und informationspolitische Forderung ab: Unsere Befunde zeigen, wie wichtig die schon bestehende Anforderung wissenschaftlicher Zeitschriften nach einer vollständigen Offenlegung der Finanzierungsquellen für klinische Studien ist. Eher noch ist eine Verschärfung dieser Bedingungen zu überdenken. Zusätzlich sollte man überprüfen, ob nicht in die "Medline"-Datenbank eine zusätzliche und obligatorische Rubrik einzubauen wäre, in der die Finanzierungsquelle von Studien genannt werden muss, so dass man dieses Such-Kriterium bei Literaturrecherchen mitberücksichtigen kann.
Ein Abstract der Studie ist hier nachzulesen: Antonio Nieto u.a.: Adverse Effects of Inhaled Corticosteroids in Funded and Nonfunded Studies (Arch Intern Med. 2007;167:2047-2053)
Gerd Marstedt, 25.10.2007
"Ghost Management" der Pharmaindustrie: Stammen viele wiss. Veröffentlichungen aus der Feder von Marketingfirmen?
 20-40 Prozent aller Veröffentlichungen in medizinischen Fachzeitschriften über Arzneimittelstudien werden vermutlich nicht von den im Artikel genannten Autoren, sondern von kommerziellen Unternehmen geplant und geschrieben. Geschäftsziel dieser Firmen, von denen es allein in den USA vermutlich einige hundert gibt, ist das Marketing für Arzneimittel auf dem Weg über wissenschaftliche Publikationen und Workshops, wobei die tatsächlichen Ghostwriter und ihre zahlreichen Zuarbeiter im Verborgenen bleiben. Zu dieser Aussage kommt ein jetzt in der Zeitschrift "PLOS Medicine" veröffentlichter Artikel, der auch deutlicht macht, dass auch unabhängige Meta-Studien und Übersichtsreferate auf diese Weise mitbeeinflusst werden und unwissentlich das verborgene Marketing der Pharmaunternehmen für ihre Produkte mit befördern.
20-40 Prozent aller Veröffentlichungen in medizinischen Fachzeitschriften über Arzneimittelstudien werden vermutlich nicht von den im Artikel genannten Autoren, sondern von kommerziellen Unternehmen geplant und geschrieben. Geschäftsziel dieser Firmen, von denen es allein in den USA vermutlich einige hundert gibt, ist das Marketing für Arzneimittel auf dem Weg über wissenschaftliche Publikationen und Workshops, wobei die tatsächlichen Ghostwriter und ihre zahlreichen Zuarbeiter im Verborgenen bleiben. Zu dieser Aussage kommt ein jetzt in der Zeitschrift "PLOS Medicine" veröffentlichter Artikel, der auch deutlicht macht, dass auch unabhängige Meta-Studien und Übersichtsreferate auf diese Weise mitbeeinflusst werden und unwissentlich das verborgene Marketing der Pharmaunternehmen für ihre Produkte mit befördern.
Anfang 2007 enthüllten dänische, britische und kanadische Wissenschaftler, dass bei einer Vielzahl von Arzneimittelstudien "Ghost-Writer" beteiligt sind, Personen, die bei den Hersteller-Firmen beschäftigt sind und nachweislich an den Studien beteiligt waren, aber nicht als Mitautor der Studie genannt werden (vgl. Autorenlisten wissenschaftlicher Aufsätze als vierte Stufe der Lüge? Arzneimittelstudien zwischen Geist und Ghostwritern). Über eine noch subtilere und zugleich in weitaus größerem Umfang realisierte Form der Einflussnahme von Pharma-Unternehmen auf wissenschaftliche Veröffentlichungen berichtet jetzt die Open-Access-Zeitschrift "PLOS Medicine": Das "Ghost Management". Einige hundert Unternehmen mit Tausenden von Mitarbeitern sind demzufolge im Auftrag von Pharma-Unternehmen hauptsächlich damit beschäftigt, die Veröffentlichung von Artikeln über Arzneimittelstudien in wissenschaftlichen Zeitschriften zu lancieren. Solche Firmen wie "Current Medical Directions" oder "Complete Healthcare Communications (CHC)" planen minutiös Veröffentlichungen, Workshops und Werbe-Aktivitäten, erstellen in Kooperation mit Bibliothekaren Referate und Zeitschriftenaufsätze und versprechen Pharma-Unternehmen auf diese Weise, "das Vertrauen von Ärzten in Ihre Markenprodukte zu maximieren". Der Slogan von CHC auf der Homepage: "CHC - The Leader in Strategic Publication Planning to Maximize Prescriber Confidence in Your Brands".
In welchem Umfang wird heute von der Pharma-Industrie für die Publikation ihrer klinischen Studien in medizinischen Fachzeitschriften auf ein Ghost-Management zurück gegriffen? Da die geschäftlichen Verbindungen zwischen Firmen, die allein auf pharmazeutisches Marketing durch wissenschaftliche Publikationen spezialisiert sind und auftraggebenden Pharma-Unternehmen fast immer geheim bleiben, fällt eine präzise Antwort auch Sergio Sismondo, Pfofessor an der Queen's University in Ontaria Kanada, dem Autor des Aufsatzes in PLOS-Medicine, nicht leicht.
Einige Hinweise hat er jedoch zunächst gefunden im Rahmen eines Prozesses Ende der 90er Jahre, an dem der Arzneimittelhersteller Pfizer und die Marketing-Firma "Current Medical Directions (CMD)" im Zusammenhang des Medikaments "Sertraline" beteiligt waren. Bei diesen Verhandlungen gab es Einsicht in insgesamt 85 wissenschaftliche Manuskripte, in denen über das Medikament berichtet wurde. Ein Großteil dieser Manuskripte stammte wohl von kommerziellen Verfassern und die meisten wurden auch in renommierten Fachzeitschriften veröffentlicht. Eine Literatur-Recherche von Prof. Sismondo zum Suchbegriff "Sertraline" für die Jahre 1998-2000 fand dann knapp 500 Artikel mit diesem Begriff und gut 200 Artikel, in denen der Begriff sogar im Titel auftauchte. Seine Schlussfolgerung war: Etwa 18-40% der wissenschaftlichen Veröffentlichungen zu diesem Medikament wurde direkt oder indirekt vom Hersteller Pfizer und der Marketingfirma CMD beeinflusst.
Ein weiterer, zumindest qualitativer Hinweis auf die Reichweite des Ghost-Management ergibt sich für den Wissenschaftler aus der Zahl der Firmen, die im Bereich Medizinische Bildung und Kommunikation tätig sind. So fand eine Studie im Jahre 2001 insgesamt 182 solcher Unternehmen, drei Jahre zuvor waren es nur 153 gewesen. (vgl. Gil A. Golden u.a.: Medical education and communication companies: An updated in-depth profile) Eine eigene Internet-Recherche von Prof. Sergio Sismondo brachte es nur auf 23 Treffer, ein Ergebnis, das sich jedoch leicht daraus erklären lässt, dass viele Unternehmen dieses wissenschaftliche Marketing lieber im Verborgenen blühen lassen oder dass dies nur einen Teil ihrer Aktivitäten ausmacht. Damit stimmt auch überein, dass die beiden überaus bedeutsamen, hier schon zitierten Unternehmen CMD und CHC nicht in der Trefferliste des Wissenschaftlers waren.
Die überaus subtilen und hochgradig organisierten Publikationsstrategien der Firmen werden aus ihren eigenen Beschreibungen deutlich, so erklärt eines der MECCs (medical education and communication company) als Ziel: "Produkt-Akzeptanz und -konsum durch die systematische und geplante Verbreitung von Meldungen und Daten an geeignete Zielgruppen, und dies zu den günstigsten Zeitpunkten über die effektivsten Kommunikations-Kanäle". CHC hat nach eigenen Angaben "die Systemvoraussetzungen und Qualifikationen verfeinert, um das intellektuelle Herz des pharmazeutischen Marketing zu entwickeln, die Veröffentlichungs-Planung. Und das Ergebnis für Ihr Produkt? Kontinuierliche Aufmerksamkeit, Interesse und Vertrauen bei verschreibenden Ärzten". Angeboten werden dazu das Management von Artikel-Erstellungen (unter Mithilfe von Bibliothekaren, Layoutern, Statistikern etc.) und ihr Einreichen bei Zeitschriften und Konferenzen. Auf der Website findet man eine Liste mit 10 fiktiven Arzneimittelstudien und dazu zumindest 24 wissenschaftlichen Artikeln, die daraus erstellt werden könnten.
Ein nicht unerheblicher Teil der MECCs ist im Besitz großer Verlagshäuser, zum Beispiel ist "Excerpta Medica" ein Teil des Geschäfts von "Elsevier", "Wolters Kluwer Health" verweist auf seine Zugehörigkeit zum Verlagshaus "Lippincott Williams & Wilkins" mit fast 275 Fachzeitschriften. Die Problematik des Ghost Management liegt nach Ansicht von Prof. Sismondo nicht nur darin, dass die wissenschaftliche Fundierung der Aufsätze bei einer Delegierung an wissenschafts-externe Unternehmung unklar bleibt. Ebenso fragwürdig ist die am Pfizer-Beispiel zum Medikament Sertraline deutlich gewordene quantitative Ballung einseitiger Berichterstattung, die dann auch Einfluss gewinnt auf Meta-Studien und Cochrane-Reviews, die ja - nolens volens - auch die Artikel von MECCs einbeziehen.
Eine rasche und unkomplizierte Möglichkeit der Abhilfe erkennt der Wissenschaftler nicht. Er spricht allerdings einige Empfehlungen aus. Verlage von Fachzeitschriften sollten Manuskripte, die direkt von Marketingfirmen eingereicht werden, zurückweisen, sollten Autoren mehrfach befragen über nicht genannte Mitautoren und Sponsoren und bei Zuwiderhandlungen auch Strafen verhängen. Ähnliche Vorschläge werden auch für Universitäten gemacht, die etwa eine Zusammenarbeit mit MEECs für ihre Wissenschaftler untersagen sollten.
• Hier ist eine Pressemitteilung der Queen's University, Kingston, Ontario (Canada) Pharmas affect medical studies, contends Queen’s prof
• Der Artikel ist hier (mit vielen Quellenangaben) im Volltext zu lesen: Sergio Sismondo Ghost Management: How Much of the Medical Literature Is Shaped Behind the Scenes by the Pharmaceutical Industry?
Gerd Marstedt, 4.10.2007
Beispiel Schizophrenie: Wie Pharmaunternehmen im Internet Krankheiten definieren
 Über den Einfluss der Pharma-Industrie auf Forschungseinrichtungen, Entscheidungsträger im Gesundheitssystem und Selbsthilfegruppen gibt es bereits eine Reihe von Studien. Ob und in welcher Form Pharma-Unternehmen jetzt auch das Medium Internet nutzen, um mit bestimmten Informationen den Absatz ihrer Produkte zu steigern, hat der neuseeländische Wissenschaftler John Read am Beispiel der Krankheit Schizophrenie näher untersucht. Ergebnis: Informationen über diese Krankheit auf solchen Websites, die von der Pharma-Industrie direkt oder indirekt gesponsert sind, unterscheiden sich ganz massiv von Aussagen auf anderen Seiten ohne solche finanzielle Basis. Die psychische Erkrankung wird sehr viel häufiger so dargestellt, dass eine medikamentöse Therapie (anstelle psychotherapeutischer Interventionen) geboten erscheint.
Über den Einfluss der Pharma-Industrie auf Forschungseinrichtungen, Entscheidungsträger im Gesundheitssystem und Selbsthilfegruppen gibt es bereits eine Reihe von Studien. Ob und in welcher Form Pharma-Unternehmen jetzt auch das Medium Internet nutzen, um mit bestimmten Informationen den Absatz ihrer Produkte zu steigern, hat der neuseeländische Wissenschaftler John Read am Beispiel der Krankheit Schizophrenie näher untersucht. Ergebnis: Informationen über diese Krankheit auf solchen Websites, die von der Pharma-Industrie direkt oder indirekt gesponsert sind, unterscheiden sich ganz massiv von Aussagen auf anderen Seiten ohne solche finanzielle Basis. Die psychische Erkrankung wird sehr viel häufiger so dargestellt, dass eine medikamentöse Therapie (anstelle psychotherapeutischer Interventionen) geboten erscheint.
Basis der jetzt in der Zeitschrift "Social Science & Medicine" veröffentlichten Studie waren Inhaltsanalysen von insgesamt 64 Websites, und zwar jenen, die bei Google und Yahoo auf den ersten 50 Plätzen erschienen, wenn man das Suchwort "Schizophrenie" angab. Diese Seiten wurden zwei Gruppen zugeordnet: Pharma-gesponsert oder ohne Pharma-Unterstützung. Die Zuordnung zur ersten Gruppe erfolgte, wenn Herausgeber der Website ein Pharma-Unternehmen war, wenn dort Arzneimittelwerbung auftauchte oder wenn im Impressum oder an anderer Stelle auf die Pharma-Finanzierung hingewiesen wurde. In einer Reihe von Fällen wurde die Zuordnung noch einmal durch Kontaktaufnahme mit dem Seitenbetreiber geklärt.
Die Internet-Seiten wurden dann einer Inhaltsanalyse unterzogen, wozu verschiedene Kategorien Verwendung fanden. Dazu wurden vom Wissenschaftler vorab Skalen konstruiert, um die jeweiligen Aussagen einordnen zu können. Eine solche Skala war die der Krankheitsursachen. Hier wurde anhand von fünf unterschiedlichen Aspekten berücksichtigt, ob für die Krankheit Schizophrenie eher biologische und genetische, oder aber psycho-soziale Entstehungsursachen genannt werden. Weitere Skalen, um die Inhalte der Websites zu charakterisieren, waren folgende: Krankheitsursachen (biologisch-genetisch vs. psycho-sozial), bevorzugte Therapie (medikamentös vs. psychotherapeutisch), Schweregrad der Krankheit (sachliche vs. übertreibende Darstellung der Problematik), Gewaltbereitschaft schizophren Erkrankter (keine Hervorhebung vs. Statements über Gewalt als ein zentrales Merkmal der Krankheit).
In der Gegenüberstellung der Kernaussagen der beiden Gruppen von Internet-Seiten zeigte sich dann:
• Pharma-gesponserte Informationen über die Schizophrenie betonen den besonderen Schweregrad der Krankheit, ihren degenerativen Verlauf und Begriff wie "schwerwiegend", "ernsthaft", "bedrohlich" usw. tauchen sehr viel häufiger auf. Bei 70% der pharma-gesponserten Texte ist dies der Fall, bei den anderen nur bei 26%.
• Eine biologisch-genetische Ursache wird auf Seiten, die mit Pharma-Unternehmen in Verbindung stehen, deutlich häufiger genannt, psycho-soziale Faktoren der Krankheitsentstehung seltener.
• Pharma-Seiten verweisen sehr viel häufiger auf den Erfolg und die Angemessenheit medikamentöser Therapien und eher selten auf psychotherapeutische Möglichkeiten.
In der Diskussion der Ergebnisse verweist John Read darauf, dass Internet-Informationen für Patienten, die nicht als direkte Werbung erscheinen, nun offensichtlich ein weiteres Feld sind, auf dem die Pharma-Industrie versucht, Einfluss zu nehmen das Medizinsystem. Der wissenschaftliche Fortschritt, der mit der Konstruktion des bio-psycho-sozialen Modells von Krankheitsursachen errungen wurde, wird mit der überaus einseitigen Darstellung der Krankheit Schizophrenie durch Pharma-gesponserte Informationen vollständig ignoriert. Und dies allein, um den Absatz von Medikamenten gegen die psychische Erkrankung anzukurbeln.
Ein Abstract der Studie ist hier nachzulesen: John Read: Schizophrenia, drug companies and the internet (Social Science & Medicine, Article in Press, doi:10.1016/j.socscimed.2007.07.027)
Gerd Marstedt, 27.9.2007
Big Pharma's Data Collectors versus Maine, Vermont and New Hampshire - Wie viel dürfen Pharmafirmen über Ärzte wissen?
 Weltweit sammeln darauf spezialisierte Firmen Daten über die konkret von Ärzten verordneten Medikamente und verkaufen diese Informationen mit genauen Angaben zum Arzt an die Hersteller dieser Medikamente. Diese Informationen werden dann für gezielte Marketingaktivitäten bei diesen Ärzten benutzt.
Weltweit sammeln darauf spezialisierte Firmen Daten über die konkret von Ärzten verordneten Medikamente und verkaufen diese Informationen mit genauen Angaben zum Arzt an die Hersteller dieser Medikamente. Diese Informationen werden dann für gezielte Marketingaktivitäten bei diesen Ärzten benutzt.
Die Ärzte, die ein bestimmtes Medikament der Firma X nicht oder wenig verordnen, werden gezielt von entsprechend munitionierten Pharmavertretern besucht und über die vermeintlichen Vorteile einer häufigeren Verordnung des Medikaments informiert. Dass dabei auch ein Bündel von Werbeanreize eine Rolle spielen kann, ist hinlänglich bekannt. So genannte A-Ärzte, d.h. Ärzte, die ein bestimmtes Präparat der Firma X schon häufig verordnen, werden weniger besucht, dafür kann dort der Kollege der Firma Y aufgrund von Hinweisen aus demselben Datenfundus auftauchen.
Wer in etwas lockerer Form hören will, wie diese Praxis und auch alle weiteren Marketingaktivitäten der Pharmaindustrie bei Ärzten ablaufen, kann jetzt die von der Kassenärztlichen Vereinigung Hessen und der AOK Hessen produzierte und schon an alle 8.000 hessischen Ärzte versandte CD "Pharmamarketing" auch als Nichtarzt und außerhalb Hessens im Handel erhalten (ISBN 978-3-00-021057-0).
Über die Zulässigkeit dieser systematischen und nicht-anonymisierten Datensammlung haben sich die Politiker in den US-Bundesstaaten Maine und Vermont über eine Informations-CD hinaus so viel Gedanken gemacht, dass sie beide Gesetze (so genannte "Physician Prescription Confidentiality Laws") verabschiedeten, die diese Praxis im Prinzip unterbinden und am 1. Januar 2008 in Kraft treten sollen.
Drei der teilweise auch in Deutschland auf diesem Feld aktiven Firmen, IMS Health, Wolters Kluwer Health und Verispan, haben jetzt mit dem Ziel, ihr Inkrafttreten zu verhindern, vor einem Bundesgericht Klagen bzw. Rechtsbeschwerden gegen diese Gesetze und die Bundesstaaten erhoben.
Die Beschwerdeführer sind der Überzeugung, dass diese Gesetze wie ein ähnliches im Bundesstaat New Hampshire verfassungswidrig sind, und vor allem gegen das "First Amendment" der US-Verfassung verstoßen, indem sie die Weitergabe legal erlangter Information verböten und außerdem gegen das "14th Amendment" verstoßen, indem sie den interstaatlichen Handel erschwerten.
Ohne die Möglichkeit Daten zu haben, die einem identifizierbaren Verordner zugewiesen werden könnten, würde die Gesellschaft ein mächtiges Instrument verlieren, um einen Überblick über die Sicherheit neuer Arzneimittel zu bekommen und sicher sein zu können, dass Patienten, die Arzneimittel einnehmen nicht davon geschädigt würden - so die drei Datensammler und -vermarkter.
Gegen das Gesetz in New Hampshire war bereits im Frühjahr 2007 erfolgreich von denselben Interessenten geklagt und ein erster Sieg errungen worden: Ein Bundesrichter sah das Verfassungsrecht auf freie Rede gefährdet und gab den Klägern recht. Das durch New Hampshire beantragte Berufungsverfahren ist noch nicht entschieden.
In Vermont erzeugte aber der erste Richterspruch immerhin den Effekt, dass dort trotz des Gesetzes solche Daten gesammelt und den Arzneimittelfirmen weiterverkauft werden dürfen, wenn es der einzelne Arzt erlaubt.
Trotz der Klageeinreichung der drei Pharmadatenhändler hält der geschäftsführende Direktor der "Vermont Medical Society", Paul Harrington, am Gesetz mit folgenden Argumenten fest: "We feel the laws are appropriate in that they keep the physicians' prescribing information out of the hands of the drug company marketers and curtail the drug companies being able to effectively go into the physicians' offices, having the prescribing information and tailoring their marketing, knowing what the physician is prescribing."
Wen die Legitimität des weitgehend unbekannten aber legalen Treiben dieser Firmen auch in Deutschland interessiert und stört, findet sicherlich in den kommenden Verfahren gegen die drei Bundesstaaten eine Menge Pro- und Contra-Argumente zum bisher offenherzigen Umgang mit individuellen Daten in dem ansonsten beispielsweise für eine umfassende Versorgungsforschung strikt anonym gehaltenen Gesundheitswesen Deutschlands. Ob das Grundgesetz, das SGB V und weitere Gesundheitsgesetze diese extrem interessengebundene Art von Datensammlung und -handel gegen jegliche Änderungsabsicht immunisieren, sollte dabei auch mal geprüft werden!?
Auf der Website der "Kaiser Family Foundation" findet sich mit Stand vom 31. August 2007 ein Überblick zu dem Komplex und der inneramerikanischen Berichterstattung "Prescription Drugs - Medical Data Collection Firms File Suits in Maine, Vermont over Physician Prescription Confidentiality Laws".
Wer sich für die O-Töne der drei Beschwerdeführer interessiert, findet hier die Gemeinsame Presserklärung von IMS Health, Wolters Kluwer Health and Verispan "Challenge State Laws Restricting Access to Critical Healthcare Information Prescribing Information Vital to Improving Healthcare Quality and Patient Safety; Similar Law in New Hampshire Ruled Unconstitutional". In dieser Erklärung finden sich noch einige Daten über die drei klagenden Firmen und ihre Tätigkeit.
Bernard Braun, 1.9.2007
Werbebudgets der US-Pharmaunternehmen haben sich in 10 Jahren verdreifacht - Kontrolle funktioniert nicht
 Die Ausgaben der US-amerikanischen Pharmaindustrie haben sich im Zeitraum von 1996 bis 2005 etwa verdreifacht und sind von 11 Milliarden auf 30 Milliarden Dollar (etwa 22 Mrd. Euro) gestiegen. Die Ausgaben für die direkte, an Konsumenten gerichtete Werbung machen zwar insgesamt nur etwa 14% der Werbeetats aus, dieser Posten stieg allerdings besonders stark an: Um 330 Prozent. Obwohl in den letzten Jahren immer häufiger Medikamente wegen gesundheitsgefährlicher Nebenwirkungen wieder vom Markt genommen wurden (wie zuletzt Vioxx), kommt nach einer jetzt veröffentlichten Studie, die amerikanische Aufsichtsbehörde FDA (Food and Drug Administration) ihrer Kontrollfunktion immer weniger nach. Die Zahl der schriftlichen Beanstandungen wegen unzulässiger Medikamenten-Werbung, die die FDA an Pharmaunternehmen verschickte, fiel von 142 im Jahr 1997 auf lediglich 21 im Jahr 2006.
Die Ausgaben der US-amerikanischen Pharmaindustrie haben sich im Zeitraum von 1996 bis 2005 etwa verdreifacht und sind von 11 Milliarden auf 30 Milliarden Dollar (etwa 22 Mrd. Euro) gestiegen. Die Ausgaben für die direkte, an Konsumenten gerichtete Werbung machen zwar insgesamt nur etwa 14% der Werbeetats aus, dieser Posten stieg allerdings besonders stark an: Um 330 Prozent. Obwohl in den letzten Jahren immer häufiger Medikamente wegen gesundheitsgefährlicher Nebenwirkungen wieder vom Markt genommen wurden (wie zuletzt Vioxx), kommt nach einer jetzt veröffentlichten Studie, die amerikanische Aufsichtsbehörde FDA (Food and Drug Administration) ihrer Kontrollfunktion immer weniger nach. Die Zahl der schriftlichen Beanstandungen wegen unzulässiger Medikamenten-Werbung, die die FDA an Pharmaunternehmen verschickte, fiel von 142 im Jahr 1997 auf lediglich 21 im Jahr 2006.
Die jetzt im New England Journal of Medicine veröffentlichte Studie hat sehr unterschiedliche Datenquellen herangezogen, unter anderem repräsentative Daten über Werbeausgaben für unterschiedliche Medien von TNS Media oder auch Daten über das Sponsoring von Wissenschaftlern und Medizinern von IMS Health. Ergebnisse der Studie waren:
• Ausgaben für direkte Verbraucher-Werbung stiegen von 1 Milliarde $ (1996) auf 4,2 Milliarden $ 2005.
• Das Marketing durch Sponsoring, Geschenke, Bildungsveranstaltungen u.ä. für Mediziner und Wissenschaftler stieg im selben Zeitraum von 3,7 auf 6,8 Milliarden $.
• Den größten Anteil machen kostenlos verteilte Arzneimittel-Muster aus, deren Wert von 6,1 auf 18,4 Milliarden $ stieg.
• Die Werbung entfällt größtenteils auf nur etwa 20 Medikamente, auf die mehr als die Hälfte (54%) aller Direktwerbungskosten entfielen. Dabei handelt es sich überwiegend um Medikamente, die neu auf den Markt gekommen sind oder zur Therapie chronischer Erkrankungen entwickelt wurden.
• Die Zahl der direkten Beanstandungen durch die FDA fiel von 142 im Jahr 1997 auf lediglich 21 im Jahr 2006. Am Ende des Beobachtungszeitraums betrafen solche Beanstandungen ("regulatory letters") hinsichtlich der Verletzung gesetzlicher Vorschriften bereits zu 84% die direkte Konsumenten-Werbung. Entweder wurden Risiken und Nebenwirkung bagatellisiert oder gar nicht erwähnt oder Angaben zur Wirkung der Medikamente völlig übersteigert und unrealistisch dargestellt.
Die Autoren diskutieren ihre Befunde über die nachlassende Kontrollfunktion der FDA sehr vorsichtig. Entweder, so ihre Argumentation, sind Pharmaunternehmen vorsichtiger geworden. Oder aber - und zu dieser Einschätzung neigen sie eher - die Behörde ist personell viel zu schlecht ausgestattet. Lediglich vier Mitarbeiter sollen dort im Jahr 2004 für die Kontrolle der direktern Verbraucherwerbung zuständig sein.
Direkte Werbung für verschreibungspflichtige Medikamente, die sich im Fernsehen oder in Zeitschriften direkt an Verbraucher richtet, ist in den USA seit etwa zehn Jahren möglich. Für die Pharma-Industrie ist dies von großem Interesse. Im Jahre 2001 hatte ein Wissenschaftler des Dartmouth College berichtet, dass jeder zusätzliche Werbedollar, der für ein Arzneimittel ausgegeben wird, etwa 5 Dollar zusätzlichen Umsatz bringt. In der EU-Kommission gibt es derzeit erneut Initiativen, diese Form der Werbung auch in den Ländern der Europäischen Union zu ermöglichen. Eine Vielzahl von Einrichtungen, darunter die Buko Pharma-Kampagne, der Bundesverband der Verbraucherzentralen, die Aids-Hilfe, Medico International, der Verein Demokratischer Pharmazeutinnen und Pharmazeuten hat gegen diese Pläne protestiert. Hingewiesen wurde darauf, dass in den USA die Arzneimittel-Kosten nach der Aufhebung von Werbe-Beschränkungen sprunghaft angestiegen sind und dass damit Ärzte in unnötige Konflikte geraten, wenn Patienten eine Verschreibung bestimmter Medikamente fordern.
• Hier ist eine Pressemitteilung der Universität Pittsburgh mit den wichtigsten Befunden: Spending on Direct-To-Consumer Advertising by Pharmaceutical Companies More Than Triples in Past Decade
• Die Studie ist auch im Volltext kostenlos verfügbar: Julie M. Donohue u.a.: A Decade of Direct-to-Consumer Advertising of Prescription Drugs (NEJM August 16, 2007, Number 7, Volume 357:673-681)
Gerd Marstedt, 17.8.2007
Bericht der "Los Angeles Times" dokumentiert die Tricks und Erfolge der Pharma-Industrie im Gesundheitswesen
 In einem umfassenden Bericht beschäftigt sich in dieser Woche die Journalistin Melissa Healy in der Tageszeitung "Los Angeles Times (LAT)" mit den Marketing-Strategien der Pharma-Industrie, ihrer offenen und versteckten Einflussnahme auf Wissenschaftler und Ärzte, Patienten und Politiker. Die sechsteilige Reportage bringt keine grundsätzlichen neuen Erkenntnisse ans Licht, macht aber in der Zusammenschau unterschiedlichster Lobby- und Marketing-Ansätze deutlich, in wie starkem Maße Pharma-Unternehmen ihre ökonomischen Interessen erfolgreich durchsetzen - nach Meinung vieler im Bericht zitierter Wissenschaftler keineswegs immer im Sinne der bestmöglichen Versorgung von Patienten.
In einem umfassenden Bericht beschäftigt sich in dieser Woche die Journalistin Melissa Healy in der Tageszeitung "Los Angeles Times (LAT)" mit den Marketing-Strategien der Pharma-Industrie, ihrer offenen und versteckten Einflussnahme auf Wissenschaftler und Ärzte, Patienten und Politiker. Die sechsteilige Reportage bringt keine grundsätzlichen neuen Erkenntnisse ans Licht, macht aber in der Zusammenschau unterschiedlichster Lobby- und Marketing-Ansätze deutlich, in wie starkem Maße Pharma-Unternehmen ihre ökonomischen Interessen erfolgreich durchsetzen - nach Meinung vieler im Bericht zitierter Wissenschaftler keineswegs immer im Sinne der bestmöglichen Versorgung von Patienten.
Der erste Teil der Reportage hat den Titel "Unter Einfluss: Cleveres Marketing weckt unseren Appetit auf verschreibungspflichtige Arzneimittel. Verbraucher, Ärzte, Forscher - niemand ist immun." Dargestellt werden hier einerseits die ökonomischen Dimensionen des Problems. So haben US-Pharma-Unternehmen im Jahre 2006 rund 5 Milliarden Dollar für direkte, an Patienten gerichtete Werbung ausgegeben (die in den USA anders als bei uns auch für verschreibungspflichtige Medikamente erlaubt ist) und geschätzte 19 Milliarden, um Ärzte für ihre Produkte einzunehmen. Als Konsequenz dieser Einflussnahme zeigt sich, dass die Kosten für verschreibungspflichtige Medikamente in den USA (in Höhe von fast 280 Milliarden Dollar 2006) zu 80% für Marken-Produkte ausgegeben werden, obwohl es für den allergrößten Teil dieser Arzneien weitaus preisgünstigere und absolut wirkungsgleiche Generika gibt. Kritiker betonen, dass das Arzt-Patient-Gespräch heute durch die Einflussnahme der Pharma-Unternehmen oftmals von neuen Regie-Anweisungen gesteuert wird.
• "Under the Influence: Savvy Marketing Whets Our Appetite for Prescription Pharmaceuticals. Consumers, Doctors, Researchers - No One Is Immune"
Unter dem Titel "Von der finanziellen Steuerung zur Forschung: Wenn Pharma-Unternehmen Studien zu neuen Arzneimitteln durchführen, kann dies auch die Forschungsergebnisse beeinflussen - nachhaltig" beschreibt die Journalistin die Einflussnahme auf Wissenschaftler und akademische Gremien, medizinische Experten und Entscheidungsträger. Die Pharma-Unternehmen, so heißt es in der LAT, bauen eine Truppe aus hochangesehenen Universitäts-Experten auf, finanzieren Stiftungen, Forschungsprogramme und Lehrstühle und bezahlen medizinische Zentren zur Durchführung klinischer Studien. Die dadurch erzielten Vorteile sind recht eindeutig. So hat eine Gruppe staatlich bestellter Experten im Mai 2003 die Leitlinien zur Behandlung des Bluthochdrucks neu definiert. 9 der 11 Mitglieder der Expertengruppe hatten finanzielle Beziehung zu Firmen, die von der neuen Leitlinie profitieren. 6 von ihnen hatten Studien durchgeführt, die von solchen Unternehmen finanziert wurden, die im Besitz von Patenten für Bluthochdruck-Medikamente sind.
Ein zweites Beispiel aus dem Bericht: Im Juli 2004 wurde eine ähnliche Leitlinien-Revision vorgenommen, und zwar zur Diagnose und Behandlung hoher Cholesterinwerte bei Erwachsenen. Aufgrund der neuen Leitlinie wurden mit einem Schlag 8 Millionen US-Amerikaner zu neuen potentiellen Abnehmern cholesterin-senkender Mittel. Und dies nur drei Jahre, nachdem eine ähnliche Änderung von Behandlungskriterien zusätzliche 23 Millionen Bürger als potentiell behandlungsbedürftig definiert hatte. So kann es nicht verwundern, dass heute in den USA 64% der Patienten, bei denen Bluthochdruck festgestellt wurde, mit einem von zwei Medikamententypen behandelt wird - in Deutschland und Großbritannien sind es nur 59%, in Spanien nur 49%.
• "From Funding to Findings: When Drug Companies Conduct Research on New Pharmaceuticals, Outcomes May Be Affected - Greatly"
"Herr Doktor, hier habe ich eine Kleinigkeit für Sie: Die vielschichtigen Verkaufsstrategien umfassen nicht nur Bestechungsgeschenke" Unter dieser Schlagzeile beschreibt Melissa Healy das umfassende Marketing der Pharma-Unternehmen zur Erhöhung ihrer Verkaufszahlen. Von großer Bedeutung sind dabei die Pharmareferenten, rund 100.000 an der Zahl, die täglich in den Praxen der etwas 311.000 niedergelassenen Ärzte vorsprechen oder auch das Sponsoring von Weiterbildungsveranstaltungen, die von Ärzten besucht werden, damit sie ihre Zulassung behalten.
• "Doctor, Just a Little Something for You: Complex Sales Strategies Go Way Beyond Freebies"
Ein weiteres Kapitel des Berichts bringt vielfältige Beispiele, die die Problematik einer direkten Werbung für verschreibungspflichtige Medikamente dokumentieren oder auch das Sponsoring von Selbsthilfegruppen:
• "Next Step: Create the Demand; Direct, Emotional Ads for Prescription Drugs Are Everywhere. But They're Just One Way To Get to the Consumer"
Die Marketing-Strategie geht auf: Dieser Berichtsteil belegt zunächst anhand einiger in den letzten Jahren veröffentlichter Studien, dass sich Ärzte von den Maßnahmen der Pharma-Industrie durchaus beeinflussen lassen. Zwar waren in einer Befragung im Jahre 2001 84% jüngerer Ärzte der festen Überzeugung, dass Geschenke oder kostenlose Essenseinladung der Pharma-Unternehmen bei ihren Kollegen im Rahmen der Verschreibung von Medikamenten durchaus Wirkung zeigen. Nur sich selbst hielten zugleich 61% für immun gegenüber solchen Anfechtungen. Mehrere Studien haben indes Gegenteiliges gezeigt. In einer erst unlängst in der Public Library of Science (PLOS) veröffentlichten Untersuchung wurde deutlich, dass etwa die Hälfte von knapp 100 Ärzten, denen ein Pharma-Referent gerade einen nur kurzen Besuch angestattet hatte, gleichwohl sagten: Die Ausführungen seien überaus informativ und lehrreich gewesen und sie würden das beschriebene Medikament zukünftig wohl öfter verschreiben.
In welchem Ausmaß sich das Marketing der Arzneimittelhersteller rentiert, hat im Jahre 2001 ein Wissenschaftler des Dartmouth College veröffentlicht. Jeder zusätzliche Werbedollar, der für ein Arzneimittel ausgegeben wird, bringt etwa 5 Dollar zusätzlichen Umsatz, für Ausgaben im Bereich des Sponsoring von Bildungsveranstaltungen ist der Ertrag mit 3,56 $ nicht ganz so hoch.
• "In Short, Marketing Works: By Targeting Consumers and Doctors - Directly and Indirectly - Drug Makers Are Driving Sales. Why Argue With Success?"
Im abschließenden Kapitel berichtet die LAT schließlich über erste (zaghafte) gesetzliche Ansätze in den USA, um den Einfluss der Pharma-Industrie im Gesundheitswesen zumindest graduell einzuschränken. So haben inzwischen etwa 30 Bundesstaaten Gesetze erlassen oder zumindest geplant, die eine Offenlegung finanzieller Zuwendungen an Ärzte verlangen, eine Einschränkung der Werbung für verschreibungspflichtige Medikamente oder eine Begrenzung der an Ärzte verteilten Geschenke durch Pharma-Repräsentanten.
• "And Now, a Push for Change: Legislators Have Begun To Question the Drug Industry's Pervasive Influence in Health Care. Some Doctors Are Backing Them Up"
Gerd Marstedt, 9.8.2007
Der lange Arm der Pharma-Industrie in der Arztpraxis: Marketing für hochpreisige Medikamente
 "Anwendungsbeobachtungen" verursachen in Deutschland Kosten in Höhe von 930 Millionen Euro jährlich, die überwiegend von den Gesetzlichen Krankenkassen zu bezahlen sind. Ziel dieser in ärztlichen Praxen durchgeführten Studien ist nach Meinung von Pharmaunternehmen eine Verbesserung der Arzneimittelsicherheit, nach Ansicht vieler Wissenschaftler, aber auch Kassenärztlicher Vereinigungen sind sie überwiegend Marketing-Instrumente zur Erhöhung der Umsätze bestimmter (meist hochpreisiger) Medikamente, aber keine Studien mit wissenschaftlicher Aussagekraft. Diese Einstufung wurde jetzt durch eine neue Studie untermauert, die im Auftrag der KBV von Dr. Eva Susanne Dietrich, Direktorin des Wissenschaftlichen Instituts der Techniker Krankenkasse (TK) für Nutzen und Effizienz im Gesundheitswesen (WINEG) und Mitarbeiterin Franziska Zieroldt erarbeitet wurde.
"Anwendungsbeobachtungen" verursachen in Deutschland Kosten in Höhe von 930 Millionen Euro jährlich, die überwiegend von den Gesetzlichen Krankenkassen zu bezahlen sind. Ziel dieser in ärztlichen Praxen durchgeführten Studien ist nach Meinung von Pharmaunternehmen eine Verbesserung der Arzneimittelsicherheit, nach Ansicht vieler Wissenschaftler, aber auch Kassenärztlicher Vereinigungen sind sie überwiegend Marketing-Instrumente zur Erhöhung der Umsätze bestimmter (meist hochpreisiger) Medikamente, aber keine Studien mit wissenschaftlicher Aussagekraft. Diese Einstufung wurde jetzt durch eine neue Studie untermauert, die im Auftrag der KBV von Dr. Eva Susanne Dietrich, Direktorin des Wissenschaftlichen Instituts der Techniker Krankenkasse (TK) für Nutzen und Effizienz im Gesundheitswesen (WINEG) und Mitarbeiterin Franziska Zieroldt erarbeitet wurde.
Die Wissenschaftler hatten alle 118 Erstmeldungen über Anwendungsbeobachtungen (AWB), die bei der Kassenärztlichen Bundesvereinigung im zweiten Halbjahr 2005 eingegangen waren, näher unter die Lupe genommen und ihre wissenschaftliche Qualität nach einem detaillierten Erhebungsbogen bewertet. Dort wurde eingetragen, welches methodische Konzept vorgesehen war, ob überhaupt ein Studienplan gab mit Angaben, welche Effekte zu beobachten sind (z.B. unerwünschte Nebenwirkungen, Arzneimittelwirkung, Lebensqualität) vorhanden war, ob es Kriterien gab, wann die Studie abzubrechen wäre (z.B. bei Todesfällen) usw.
Bei der Auswertung dieser Bögen zeigten sich dann erhebliche Mängel:
• Nur die Hälfte der Anwendungsbeobachtungen enthielt Angaben über das methodische Vorgehen, z.B. ob eine Kontrollgruppe vorgesehen war oder nicht.
• Ebenfalls nur die Hälfte zeigte einen Studienplan, aus dem hervorging, welche Effekte im Einzelnen beobachtet und protokolliert werden sollten. Von den vorgelegten Studienplänen waren überdies sehr viele nach Einschätzung der Wissenschaftler nicht oder nur sehr begrenzt geeignet. Unter dem Strich wiesen 85% der AWBs gar keinen oder keinen wissenschaftlich adäquaten Studienplan auf.
• Zwar war für einen Großteil der Studien (78%) vorgesehen, unerwünschte Nebenwirkungen zu dokumentieren. Andere überaus wichtige Untersuchungsaspekte über Arzneimittel-Wirkungen waren jedoch eher selten eingeplant: Veränderungen der Lebensqualität bei Patienten nur bei 41%, zu Erkrankungen und Gesundheitsbeschwerden bei 32%, zur Dauer der Therapie bei 22%.
• Festgestellt wurde darüber hinaus, dass ein Großteil der untersuchten Medikamente im Hochpreis-Segment angesiedelt war: Im Durchschnitt betrugen die Kosten einer Verordnung 370 Euro, bei rund 40 Euro durchschnittlichen Verordnungskosten.
• Nur bei 19 Prozent aller AWBs fand sich in den Unterlagen ein Hinweis auf eine geplante Veröffentlichung der Studienergebnisse. Empfehlungen des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) schreiben für Anwendungsbeobachtungen jedoch einen wissenschaftlichen Abschluss vor, wie sogar der Verband Forschender Arzneimittelhersteller auf seiner Seite Anwendungsbeobachtungen: Instrument für die Arzneimittelsicherheit anführt: "Über die Durchführung und Ergebnisse (...) ist innerhalb angemessener Frist ein Abschlussbericht zu erstellen, der eine biometrische Auswertung und eine Bewertung aus medizinischer Sicht enthält." Die weithin fehlende Publikationsabsicht ist danach ein klares Indiz, dass die AWB sehr viel eher als Marketinginstrument denn als fundierte wissenschaftliche Studie anzusehen ist.
In einer Pressemitteilung der TK Millionenaufwand und kaum Nutzen: TK-Institut WINEG fordert qualitativ hochwertige Praxis-Tests für Arzneimittel wird nicht nur der fragwürdige Erkenntnisgewinn durch Anwendungsbeobachtungen beklagt, sondern auch deren Problematik für die Kosten im Gesundheitssystem: "Diese so genannten Anwendungsbeobachtungen schlagen in Deutschland Jahr für Jahr mit 930 Millionen Euro zu Buche. Den Löwenanteil davon - mehr als zwei Drittel - tragen die gesetzlichen Krankenkassen, denn sie kommen für die Arzneimittel auf, die in den Studien verordnet werden. (...) Die neuen Medikamente, die in den Anwendungsbeobachtungen verordnet werden, sind im Durchschnitt fast zehnmal so teuer wie die Arzneien, die die Patienten zuvor zum Beispiel gegen ihren hohen Blutdruck oder ihr Asthma erhalten haben. Während eine durchschnittliche Verordnung in der gesetzlichen Krankenversicherung (GKV) bei rund 40 Euro liegt, stehen auf den Rezepten bei den Anwendungsbeobachtungen jeweils Medikamente für rund 370 Euro."
Die Wissenschaftler fordern deshalb, dass das Geld, das die GKV jedes Jahr in die Anwendungsbeobachtungen steckt, stattdessen in qualitativ hochwertige Studien fließt: "Wir haben errechnet, dass für die von den Krankenkassen und der Pharmaindustrie jährlich investierte Summe 130.000 Patienten in umfassenden Studien behandelt werden könnten. Diese könnten Aufschluss über den tatsächlichen Nutzen der Medikamente in der Praxis geben und so würde jeder Patient von ihnen profitieren."
Bereits im Mai 2003 hatte die Kassenärztliche Vereinigung Niedersachsen ihre Mitglieder in einem Mitteilungsblatt KVN-Rezept-Info-Nr. 7 über Anwendungsbeobachtungen auf die Problematik aufmerksam gemacht: "Zwischen 1994 und heute führte die pharmazeutische Industrie in Deutschland 3000 Anwendungsbeobachtungen durch. Ein beachtlicher Aufwand, der nach einer entsprechenden Auswertung der KBV jedoch häufig keine Verbesserung des wissenschaftlichen Kenntnisstandes zum Ziel hatte, sondern lediglich Marketingzwecken diente. (...) Nicht wenige Anwendungsbeobachtungen sind daher reine Marketing-Maßnahmen und dienen weniger dem wissenschaftlichen Erkenntnisgewinn als der Verkaufsförderung. Dies wird daran deutlich, dass zum Teil Untersuchungen für sehr alte Präparate durchgeführt werden. Diese Anwendungsbeobachtungen dienen im Wesentlichen dazu, die Präparate verstärkt ins Bewusstsein der Ärzte zu rufen. Das Studiendesign reicht hingegen in den seltensten Fällen aus, um tatsächlich wissenschaftliche Erkenntnisse zu den Präparaten zu sammeln."
Ganz ähnlich hatte auch die KV Bayern die ihr angeschlossenen Ärzte gewarnt: "Bei sorgfältiger Planung und Durchführung können Anwendungsbeobachtungen sicher zu neuen Erkenntnissen führen. Tatsächlich dienen aber nur maximal 20 Prozent aller Anwendungsbeobachtungen wissenschaftlichen Zwecken, wie eine Analyse der Kassenärztlichen Bundesvereinigung ergab. Der überwiegende Teil der Anwendungsbeobachtungen ist ein reines Marketinginstrument der Pharmaindustrie und führt zu ungerechtfertigten Ausgabenzuwächsen innerhalb der Gesetzlichen Krankenversicherung." (vgl. KVB Tipps und Hinweise zu Verordnungen - Verordnungsmanagement)
Die Praktiken der Pharmaindustrie am Beispiel der Anwendungsbeobachtrungen waren im Übrigens bereits mehrfach Gegenstand kritischer Polit-Magazine. So berichtete etwa das Magazin "PlusMinus" im November 2005 über die ärztlichen Honorare bei Anwendungsbeobachtungen: Zusatz-Verdienst: Was Ärzte so nebenbei erhalten. Und "Frontal21 - das Magazin im ZDF" zeigte unter dem Titel Getäuschte Patienten - Ärzte im Dienst der Pharmakonzerne im November 2006 Beispiele, dass sich die Anwendungsbeobachtungen für Pharmaunternehmen finanziell ganz massiv lohnen.
Hier finden Sie die wichtigsten Ergebnisse der Studie des Wissenschaftlichen Instituts der Techniker Krankenkasse (TK) für Nutzen und Effizienz im Gesundheitswesen:
Evaluation der wissenschaftlichen Qualität von Anwendungsbeobachtungen
Gerd Marstedt, 28.2.2007
Arzneimittelstudien bei Brustkrebs: Von der Pharmaindustrie finanzierte Studien kommen zu einer besseren Medikamenten-Bewertung
 Klinische Studien bei Brustkrebs-Erkrankungen bewerten den therapeutischen Nutzen der eingesetzten Medikamente sehr viel eher positiv, wenn die Studien von der Pharma-Industrie gesponsert wurden. Dies ist das Ergebnis einer Analyse von insgesamt 140 Veröffentlichungen, die von Krebsforschern aus North-Carolina und Massachusetts durchgeführt wurde und im April 2007 in der Zeitschrift "Cancer" veröffentlicht wird.
Klinische Studien bei Brustkrebs-Erkrankungen bewerten den therapeutischen Nutzen der eingesetzten Medikamente sehr viel eher positiv, wenn die Studien von der Pharma-Industrie gesponsert wurden. Dies ist das Ergebnis einer Analyse von insgesamt 140 Veröffentlichungen, die von Krebsforschern aus North-Carolina und Massachusetts durchgeführt wurde und im April 2007 in der Zeitschrift "Cancer" veröffentlicht wird.
Die Wissenschaftler hatten aufgrund einer Datenbank-Recherche 140 Veröffentlichungen über Brustkrebs-Studien aus 10 renommierten medizinischen Fachzeitschriften der Jahrgänge 1993, 1998 und 2003 noch einmal genauer unter die Lupe genommen. Die Artikel wurden dann nach verschiedenen Kriterien bewertet:
• Pharma-gesponsert oder nicht? Artikel wurden als pharma-gesponsert eingestuft, wenn Pharma-Unternehmen die komplette Studie finanziert oder zumindest die Medikamente zur Verfügung gestellt hatten oder wenn zumindest ein Autor im Dienste eines Pharma-Unternehmens stand.
• Studienausgang eher positiv oder negativ? Dies wurde danach bewertet, wie die Schlussfolgerungen der Veröffentlichung hinsichtlich der Sicherheit und Effektivität des eingesetzten Medikaments im Vergleich zur Standardtherapie lauteten.
• Art der Studie: Die betrachteten Studien wurden ferner nach dem methodischen Konzept unterschieden, zum Beispiel, ob eine Kontrollgruppe mit zufällig ausgewählten Teilnehmern beteiligt war, und auch danach, in welchem Brustkrebs-Stadium die Studie durchgeführt wurde.
Als ein erstes Ergebnis der Analyse stellen die Forscher heraus, dass das Interesse von Pharmaunternehmen an Brustkrebserkrankungen und Möglichkeiten der medikamentösen Therapie offensichtlich zugenommen hat. Waren 1993 nur 44% und 1998 nur 38% der Studien pharma-gesponsert, so lag dieser Anteil 2003 schon bei 58%. Ein zweites wichtiges Ergebnis betrifft die methodischer Anlage der Studien. Sogenannte "einarmige" Untersuchungskonzepte, in denen nur eine Versuchsgruppe vorhanden ist, sind methodisch erheblich schlechter als "zweiarmige" Konzepte, die aus einer Versuchs- und einer Kontrollgruppe bestehen, und bei denen die Patienten diesen Gruppen per Zufall zugewiesen werden. Hier zeigte sich nun, dass die mit Pharma-Beteiligung durchgeführten Studien erheblicher häufiger schlichte (einarmige) Versuchskonzepte verwenden, und zwar doppelt so oft (66%) wie nicht-pharma-gesponserte Studien (33%). Dieses in methodischer Hinsicht sehr viel weniger fundierte Vorgehen wurde ebenso daran deutlich, dass an den Pharma-Studien meist sehr viel weniger Patienten teilnahmen.
Das zentrale Erkenntnisinteresse der Wissenschaftler betraf allerdings den Zusammenhang zwischen der Studien-Finanzierung und dem Studienausgang. Bei einer anfänglichen Analyse aller 140 Veröffentlichungen konnte keine Abhängigkeit der Ergebnisse von der Finanzierung gefunden werden. Dieser Effekt wurde jedoch sofort offenbar, als die Forscher die Studien nach ihrer methodischen Konzeption einzeln betrachteten oder wenn sie nur die letzten Veröffentlichungen aus dem Jahr 2003 berücksichtigten. Hier zeigte sich dann:
• Bei Analyse nur der methodisch fundierten Studien mit Kontrollgruppen und zufälliger Zuweisung der Patienten kommen pharma-gesponserte Studien zu deutlich besseren Ergebnissen (etwa 80% positiv, 20% negativ) im Vergleich zu unabhängig finanzierten Studien (etwa 60% zu 40%)
• Bei Analyse nur der Studien aus dem Jahr 2003 zeigt sich dieser Effekt auch ganz unabhängig von der methodischen Anlage. So finden bei methodisch fundierten Konzepten pharma-finanzierte Studien zu 90% ein positives Ergebnis, unabhängig finanzierte Studien hingegen nur zu 50%.
Die Wissenschaftler zitieren in ihren Schlussworten noch eine Reihe früherer Untersuchungen über den Zusammenhang von Pharma-Finanzierung und Studienergebnis und diskutieren auch mögliche Hintergründe:
• Scope and impact of financial conflicts of interest in biomedical research: a systematic review (JAMA. 2003;289:454-465)
• The uncertainty principle and industry-sponsored research (Lancet. 2000;356: 635-638)
• Evaluation of conflict of interest in economic analyses of new drugs used in oncology (JAMA. 1999;282:1453-1457)
• Reporting and dissemination of industry versus non-profit sponsored economic analyses of six novel drugs used in oncology (Ann Oncol. 2000;11:1591-1595)
• Industry-sponsored economic studies in oncology vs studies sponsored by nonprofit organisations (Br J Cancer. 2003;89:1405-1408)
In der Bilanzierung ihrer Befunde weisen sie einerseits darauf hin, dass die Forschungs-Ausgaben von Pharma-Unternehmen schon seit 1992 die öffentlichen Forschungsgelder bei weitem übersteigen. Sie konstatieren dann: "Für viele Therapieformen besteht hinsichtlich des optimalen Zeitpunkts, der Reihenfolge und auch der Therapiedauer noch keine Klarheit. Für eine optimale Therapie ist es wichtig, dass wir wissen, welche Patientengruppen sich am besten eignen und bei welchen gefährliche Nebenwirkungen auftreten, und auch, dass wir Bescheid wissen über die notwendige Zeitdauer der Therapie. Diese Fragen zu stellen, dürfte allerdings nicht immer im Interesse jener Unternehmen sein, die bewährte und durch Studien bestätigte Therapien verkaufen."
Ein Abstract der Veröffentlichung ist hier nachzulesen: Association Between Pharmaceutical Involvement and Outcomes in Breast Cancer Clinical Trials (CANCER April 1, 2007 / Volume 109 / Number 7)
Gerd Marstedt, 27.2.2007
Jede vierte Selbsthilfegruppe wird von Pharmaunternehmen gesponsert
 Im Jahre 2005 gab es rund 70.000 regionale Selbsthilfegruppen zu nahezu allen chronischen Krankheiten und Behinderungen, in denen ca. 3 Millionen Betroffene oder ihre Angehörigen organisiert sind. Auf Landesebene existieren insgesamt ca. 800 Selbsthilfeorganisationen, auf der Bundesebene ca. 300. Sie allen leiden unter chronischer Finanznot, auch wenn sie vielfältige Fördermittel der Sozialversicherungen, des Bundes und der Länder erhalten. Diese finanzielle Unterausstattung führt dazu, dass immer mehr Selbsthilfegruppen Sponsor-Gelder der Pharma-Industrie annehmen. Eine jetzt von Bremer Wissenschaftlern durchgeführte Studie hat gezeigt: Bei einem Viertel der Selbsthilfegruppen liegt die Finanzierung über Sponsoring bei knapp 20 Prozent, fünf Prozent der Gruppen und Organisationen erhalten die Hälfte ihres Budgets aus Sponsoringmitteln.
Im Jahre 2005 gab es rund 70.000 regionale Selbsthilfegruppen zu nahezu allen chronischen Krankheiten und Behinderungen, in denen ca. 3 Millionen Betroffene oder ihre Angehörigen organisiert sind. Auf Landesebene existieren insgesamt ca. 800 Selbsthilfeorganisationen, auf der Bundesebene ca. 300. Sie allen leiden unter chronischer Finanznot, auch wenn sie vielfältige Fördermittel der Sozialversicherungen, des Bundes und der Länder erhalten. Diese finanzielle Unterausstattung führt dazu, dass immer mehr Selbsthilfegruppen Sponsor-Gelder der Pharma-Industrie annehmen. Eine jetzt von Bremer Wissenschaftlern durchgeführte Studie hat gezeigt: Bei einem Viertel der Selbsthilfegruppen liegt die Finanzierung über Sponsoring bei knapp 20 Prozent, fünf Prozent der Gruppen und Organisationen erhalten die Hälfte ihres Budgets aus Sponsoringmitteln.
Die Problematik dieser Förderung liegt vor allem darin, dass die den Gruppen auch übermittelten Arzneimittel-Informationen eher von wirtschaftlichen Interessen der Pharma-Unternehmen als von neutralen wissenschaftlichen Forschungsergebnissen geprägt sind. "Die Arzneimittelkonzerne haben erkannt, dass die Selbsthilfegruppen über einen großen Einfluss verfügen. Dort empfohlene Medikamente werden auch verordnet und gekauft", erklärt Schubert. Das nutzen die Konzerne für ihr Marketing aus. "Die Informationen, die die Patienten über Selbsthilfegruppen bekommen, sind längst nicht mehr frei von Wirtschaftsinteressen", so Schubert weiter. Eklatant sei, dass sich viele Selbsthilfegruppen dieser Einflussnahme nicht bewusst sind. Dies sei verhängnisvoll, da die Selbsthilfe heute auch Mitspracherechte in professionellen Gremien des Gesundheitswesens habe. Prof. Glaeske: "Wichtig ist daher, dass auf allen Seiten Transparenz über die Herkunft der Informationen herrscht. Nur wenn erkennbar ist, wer hinter einer Botschaft steckt, können die Patienten gezielt nach anbieterunabhängigen Informationen Ausschau halten. Einzig dadurch können sie sich wirklich eine eigene Meinung bilden und effektiv an der Verbesserung ihrer Erkrankung mitwirken."
Die von Glaeske/Schubert im Auftrag der SelbsthilfeFördergemeinschaft der Ersatzkassen erstellte Studie enthält auch eine Vielzahl von Informationen über Marketing-Strategien der Pharmaindustrie, die in der Öffentlichkeit oftmals unbemerkt bleiben. Auf mehreren Seiten des Berichts (S.18-21) werden vielfältige Beispiele für solche verborgenen Aktivitäten aufgezeigt:
• Arzneimittel-Produktwerbung: Findet im Rahmen von Vorträgen und Kongressen statt, unter Umgehung des Heilmittelwerbegesetzes, Beispiele: Methylphenidat bei Kindern unter sechs Jahren mit ADHS, Herceptin bei an Brustkrebs erkrankten Frauen ohne Metastasen.
• Rekrutierung von Selbsthilfe-Mitgliedern und anderen Betroffenen für wissenschaftliche Studien erfolgt über Mitgliederzeitschriften und über das Internet, Beispiele: "dPV-Nachrichten" der Deutschen Parkinson-Vereinigung - regelmäßig Aufrufe zur Studienteilnahme; Internetauftritt des Deutschen Neurodermitis Bundes e.V.
• Gründung von Förderkreisen von Selbsthilfeorganisationen und Pharma-Industrie, Beispiel: Deutscher Psoriasis Bund.
• Gründung, Beratung, Leitung von Selbsthilfegruppen durch die Pharmaindustrie, Beispiele: Im Jahr 2000 gründete die Firma Roche die "Koalition Brustkrebs", die Pharma-Unternehmen Bristol-Myers Squibb und Roche versuchten erfolglos Selbsthilfegruppen zum Thema Darmkrebs einzurichten.
• Initiation von Web-Sites, Beispiele: www.selbsthilfe.de (bis 2006: Bundesverband der Pharmazeutischen Industrie, BPI, heute medandmore communication GmbH), www.leben-mit-MS.de (Serono), www.ms-life.de (Biogen Idec GmbH), www.selbsthilfegruppen.de (bis 30.4.2005: BASF AG, heute: Schlieper Online-Consulting)
• Marketing als Gesundheitsaufklärung getarnt, Beispiele: Ausstrahlung pharmagesponserter Patientensender in Krankenhäusern, der Verband forschender Arzneimittelhersteller (VFA) versucht mit einer als Patienteninformation über Arzneimittel angekündigten Diskussionsrunde Patientenverbände als Lobby gegen das Werbeverbot für rezeptpflichtige Arzneimittel einzusetzen.
• Einflussnahme in Internet-Foren: Pharma-Mitarbeiter tarnen sich als Betroffene, beteiligen sich an den Diskussionen und lancieren Therapieempfehlungen bzw. bewerben Arzneimittel.
• Entwicklung und Ausführung von Patientenschulungen an Selbsthilfegruppen, Corporate Citizenship - Profit mit Non-Profit, Beispiele: Die Augsburger Pharmafirma Betapharm entwickelte über ihre Tochterunternehmen "betacare gGmbH" und "betainstitut gGmbH" als Strategie des sozialen Engagements ein 3-Stufen-Modell: Sponsoring, Corporate Social Responsibility, Corporate Citizenship. Diese Strategie hat die Firma von Platz 15 (1998) auf Platz 4 (2004) der deutschen Generika-Hersteller befördert. Die Hexal-Tochter "Oncocare gGmbH" betreibt in Berlin eine Krebsberatungsstelle.
Dokumente zum Artikel:
• Pressemitteilung der Universität Bremen: Universität Bremen: Patienten werden gezielt manipuliert - Pharmaindustrie unterwandert Selbsthilfe
• Die Studie von Glaeske/Schubert als PDF-Datei: Ein Werkstattbericht zur Entwicklung und Förderung des internen Diskurses zwischen Krankenkassen und Selbsthilfegruppen - "Einfluss des pharmazeutisch-industriellen Komplexes auf die Selbsthilfe"
• vgl. auch unseren Artikel Pharmaindustrie unterwandert Selbsthilfegruppen
Gerd Marstedt, 8.2.2007
Pharmareferenten: Die meisten Ärzte würden ihr Fehlen vermissen
 Für Informationsmaterialien der Pharmaindustrie hat sich gezeigt, dass sie oftmals irreführend und wissenschaftlich nicht fundiert sind oder sogar tatsachenverstellende Behauptungen enthalten. Dessen ungeachtet hat sich jetzt in einer Befragung der Brendan-Schmittmann-Stiftung die Mehrheit der befragten Vertragsärzte überaus positiv über die Informationsarbeit von Pharmareferenten geäußert, die ein wesentlicher Multiplikator für solche Informationen sind. Der Nutzen der Gespräche mit den Pharmareferenten wird von 63% der befragten Ärzte als "wertvoll" bezeichnet, nur für 19% sind sie "wertlos", 17% können den Nutzen nicht beurteilen". Die höchste Wertschätzung bei den Besuchen der Pharmareferenten erfahren die Fortbildungsangebote (83%), die fachlichen Informationen (77%) und die Arzneimittelmuster (71%). Mehr als die Hälfte (55%) der Vertragsärzte würden das Fehlen von Pharmareferenten als Verlust empfinden, lediglich 23% sähen dies dagegen "als Entlastung". Für die Vertragsärzte sind die Pharmareferenten eine tragende Säule in der Organisation ihrer Fortbildung: Für 57% spielen sie eine große Rolle, für 29% keine Rolle und 14% können dies nicht beurteilen. Im Durchschnitt empfangen die Vertragsärzte wöchentlich etwa sieben Pharmareferenten (Hausärzte acht und Fachärzte vier). Mehr Details zur Befragung sind hier zu finden: Studie: Informationen durch Pharmareferenten sind für die Vertragsärzte von hohem Nutzen.
Für Informationsmaterialien der Pharmaindustrie hat sich gezeigt, dass sie oftmals irreführend und wissenschaftlich nicht fundiert sind oder sogar tatsachenverstellende Behauptungen enthalten. Dessen ungeachtet hat sich jetzt in einer Befragung der Brendan-Schmittmann-Stiftung die Mehrheit der befragten Vertragsärzte überaus positiv über die Informationsarbeit von Pharmareferenten geäußert, die ein wesentlicher Multiplikator für solche Informationen sind. Der Nutzen der Gespräche mit den Pharmareferenten wird von 63% der befragten Ärzte als "wertvoll" bezeichnet, nur für 19% sind sie "wertlos", 17% können den Nutzen nicht beurteilen". Die höchste Wertschätzung bei den Besuchen der Pharmareferenten erfahren die Fortbildungsangebote (83%), die fachlichen Informationen (77%) und die Arzneimittelmuster (71%). Mehr als die Hälfte (55%) der Vertragsärzte würden das Fehlen von Pharmareferenten als Verlust empfinden, lediglich 23% sähen dies dagegen "als Entlastung". Für die Vertragsärzte sind die Pharmareferenten eine tragende Säule in der Organisation ihrer Fortbildung: Für 57% spielen sie eine große Rolle, für 29% keine Rolle und 14% können dies nicht beurteilen. Im Durchschnitt empfangen die Vertragsärzte wöchentlich etwa sieben Pharmareferenten (Hausärzte acht und Fachärzte vier). Mehr Details zur Befragung sind hier zu finden: Studie: Informationen durch Pharmareferenten sind für die Vertragsärzte von hohem Nutzen.
Zwar sind die befragten 743 Ärzte nicht repräsentativ für die in Deutschland niedergelassenen Mediziner. Die Ergebnisse der Studie verdeutlichen jedoch, dass die in den letzten Jahren zunehmend publizierte Kritik an Marketing- und PR-Strategien der Pharmaindustrie mit dem Ziel einer Einflussnahme auf Ärzte, Patienten und Selbsthilfegruppen bei den Ärzten selbst noch nicht durchschlagend angekommen ist. Diese Kritik kam dabei nicht nur von journalistischer Seite, sondern auch von Ärzten selbst. So hat die KV Niedersachsen im Niedersächsischen Ärzteblatt (Januar 2007) dieses Problematik in einem Artikel dargestellt: Schleichwege: Wie Werbung die Therapie entscheidet. Berliner Ärzte hatten in "Berliner Ärzte elektronisch", der Zeitschrift der Berliner Ärztekammer, im Dezember 2006 in mehreren Artikeln die Einflussnahme der Pharmaindustrie untersucht und kamen zu dem Fazit: "Arzneimitteldesinformation ist eher Regel als Ausnahme." (vgl. Forum Gesundheitspolitik: Desinformation über Arzneimittel: eher Regel als Ausnahme).
Und nach einem Bericht des Deutschen Ärzteblatts kritisierte jetzt auch der Vorsitzende der Arzneimittelkommission der deutschen Ärzteschaft, Wolf-Dieter Ludwig, die Marketingstrategien der pharmazeutischen Industrie: Sie versorgten Ärzte mit geschönten Informationen und nähmen auf Patientenselbsthilfegruppen Einfluss. "Die Hochglanzbroschüren, die Pharmareferenten Ärzten gerne überreichen, bieten häufig nur Halbwahrheiten. [...] Ludwig sagte, er befürchte, dass infolge der Marketingaktionen der Pharmakonzerne ungehemmt neue Arzneimittel verschrieben werden. Welche Risiken die neuen Mittel bergen, sei zum Zeitpunkt der Zulassung oft noch nicht bekannt. Das habe etwa der Fall des Schmerzmittels Vioxx gezeigt, das 2004 vom Markt genommen wurde, weil man ein erhöhtes Risiko für Herzinfarkte entdeckte." (vgl. Ärzteschaft kritisiert Pharma-Marketingstrategien Deutsches Ärzteblatt, 26. Januar 2007)
Die pointierten Aussagen aus Reihen der Ärzteschaft über "Halbwahrheiten" und "Desinformation" der Pharma-Unternehmen sind kein Novum, sondern können sich unter anderem auf eine Analyse des Instituts für evidenzbasierte Medizin (DieM) stützen, deren Ergebnisse im arznei telegramm 2/2004 veröffentlicht worden sind: Sind die Aussagen medizinischer Werbeprospekte korrekt?. 54 zufällig ausgesuchte Praxen niedergelassener Ärztinnen und Ärzte im Bereich Allgemeinmedizin und Innere Medizin im Raum Nordrhein waren bezüglich einer Studienteilnahme angesprochen worden, 80% nahmen an der Evaluation teil. Sie wurden gebeten, alle in der Praxis im Juni des Jahres 2003 abgegebenen oder zugesandten schriftlichen Informationen der pharmazeutischen Industrie zu sammeln. In die Evaluation wurden dann 175 Prospekte mit mindestens einer konkreten medizinischen Aussage eingeschlossen. Für alle inhaltlichen medizinischen Aussagen wurden in den Prospekten dann Literaturangaben oder andere Quellenangaben gesucht. Im Ergebnis zeigte sich: 302 (58%) waren nicht transparent, 177 (34%) waren nicht mit Quelle übereinstimmend (nicht kongruent). Die Wissenschaftler ziehen das Fazit. "Von den aufgrund der Quellenangaben nachvollziehbaren Informationen decken sich die meisten Werbeprospekte und die darin enthaltenen Aussagen nicht mit der zugrundegelegten wissenschaftlichen Originalliteratur. Insgesamt werden die Informationen in 94% der Werbeprospekte der pharmazeutischen Industrie nicht durch valide wissenschaftliche Untersuchungen nachvollziehbar belegt."
Kritische Worte kommen auch von einem Gremium, das relativ unverdächtig ist hinsichtlich einer zu stark ideologisch gefärbten Sichtweise der Problematik, dem Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen. In seinem Gutachten 2005: Koordination und Qualität im Gesundheitswesen kommt der Rat unter der Überschrift "Detailing" auch zu der Feststellung, dass die Einflussnahme der Pharmaindustrie (durch Pharma-Referenten) auf das Verschreibungsverhalten der Ärzte durchaus erfolgreich und nachhaltig ist. Dort heißt es (S. 650):
"Je häufiger Ärzte Vertriebsagenten sehen,
• desto eher sind sie geneigt, Arzneimittel in Fällen einzusetzen, in denen eine nichtmedikamentöse Therapie die beste Option ist,
• desto häufiger vertreten sie Ansichten, die eher den Angaben aus der Werbung als denen in wissenschaftlichen Publikationen entsprechen,
• desto wahrscheinlicher ist es, dass sie Antibiotika unangemessen verschreiben,
• desto unwahrscheinlicher ist es, dass sie Generika206 rezeptieren und
• desto wahrscheinlicher verordnen sie teure Medikamente auch dann, wenn vergleichbar wirksame, aber billigere verfügbar sind.
Ärzte sind sich zwar der werbenden, verzerrenden Darstellung der produktbezogenen Informationen bewusst. Sie leugnen jedoch - trotz gegenteiliger empirischer Befunde - häufig, dass diese ihr Verhalten beeinflussen. Sie glauben vielfach an ihre persönliche Immunität gegenüber den Marketingmaßnahmen der Industrie. Allerdings korreliert die Zahl entgegengenommener Werbegeschenke empirisch positiv mit der Wahrscheinlichkeit einer solchen Einstellung."
Kritisch gesehen wird auch, dass von der Pharmaindustrie schätzungsweise 1,4 Milliarden Euro für Gehälter, Spesen, Provisionen etc. von Pharmareferenten ausgegeben wird und dann gefragt: "Ob diese hohen Marketing-Ausgaben der pharmazeutischen Industrie aus gesellschaftlicher Sicht wünschenswert sind, ist fraglich." Nach anderen Schätzungen machen diese Ausgaben sogar 2,5 Milliarden Euro jährlich aus, für die Arbeit von rund 20.000 Pharmareferenten, die in 12 Monaten etwa 20 Millionen Arzt-Gespräche führen oder zumindest Praxiskontakte aufnehmen. (Quelle: Heike Korzilius, Sabine Rieser: Pharmaberater: Für manche Fachmann, für andere Buhmann (Deutsches Ärzteblatt 104, Ausgabe 4 vom 26.01.2007, Seite A-156)
In diesem Aufsatz wird auch über einige Ansätze zur Überwindung der Unklammerung durch Pharma-Unternehmen berichtet. So ist der niedergelassene Allgemeinarzt Dr. med. Eckhard Schreiber-Weber aus Bad Salzuflen Mitbegründer der "Initiative unbestechlicher Ärztinnen und Ärzte" Mein Essen zahl ich selbst, die sich am 31.1.2007 formell als Verein konstituieren will. Ziel der Initiative ist es, ein Netzwerk von Ärztinnen und Ärzten zu schaffen, die ihr Verschreibungsverhalten unabhängig von Interessen der Pharmaindustrie strikt am Patienten ausrichten. Auch sollen Ärzte dafür sensibilisiert werden, wie beeinflussbar sie sind. Und die Kassenärztliche Vereinigung (KV) Bayerns hat im vergangenen Jahr einen Versuch gestartet, den Marketing- und PR-Aktivitäten der Pharma-Unternehmen eigenständige Informationen entgegenzusetzen. Drei Apothekerinnen besuchen in einer Modellregion in Mittelfranken verordnungsauffällige Ärzte und beraten diese in Fragen einer wirtschaftlichen Arzneimittel-Therapie. Der Vorsitzende der KV, Dr. med. Axel Munte fordert im Mitglieder-Journal KVB-Impuls (2/2006) "Plädoyer für mehr soziale Verantwortung der Pharmaindustrie" "Die Ärzteschaft und Krankenkassen müssen daher gemeinsam mit den Pharmafirmen Regelungen finden, um Milliarden bei den Werbeausgaben einzusparen, so dass die Preise reduziert und die Forschung für echte Innovationen intensiviert werden können."
Gerd Marstedt, 27.1.2007
Der "Medicare Drug War" 2004 in den USA: Ein Lehrstück über die Einflussnahme der Pharmaindustrie auf die Arzneimittelgesetzgebung
 Man mag vom us-amerikanischen politischen System und insbesondere seinem Sozial- und Gesundheitssystem sonst halten was man mag: Die zivilgesellschaftliche Transparenz über manche Gesetzgebungsprozesse und ihre Folgen im Bereich wichtiger Leistungen ist teilweise bedeutend größer und konkreter als in Deutschland. Dazu tragen hauptsächlich Non-Profit-Organisationen bei, die gestützt auf ihre zahlreichen Mitglieder immer wieder bemerkenswerte Berichte veröffentlichen.
Man mag vom us-amerikanischen politischen System und insbesondere seinem Sozial- und Gesundheitssystem sonst halten was man mag: Die zivilgesellschaftliche Transparenz über manche Gesetzgebungsprozesse und ihre Folgen im Bereich wichtiger Leistungen ist teilweise bedeutend größer und konkreter als in Deutschland. Dazu tragen hauptsächlich Non-Profit-Organisationen bei, die gestützt auf ihre zahlreichen Mitglieder immer wieder bemerkenswerte Berichte veröffentlichen.
Eine derartige Organisation ist "Public Citizen" mit im Jahr 2004 160.000 Mitgliedern. In ihrer programmatisch titulierten Publikationsreihe "Congress Watch" erschien im Juni 2004 der Bericht "The Medicare Drug War", der seinen wesentlichen Inhalt im Untertitel auf den Punkt bringt: "An Army of Nearly 1.000 Lobbyists Pushes a Medicare Law that Puts Drug Company and HMO Profits Ahead of Patients and Taxpayers."
Selbst wenn man sich nicht für jegliches Detail der damals virulenten Gesetzgebung zur Arzneimittelversorgung der Medicare-Mitglieder in den USA interessiert, sind die dortigen Beeinflussungsmanöver vor allem der Pharmahersteller deshalb auch für Deutschland interessant, weil viele dieser Unternehmen (z.B. Novartis, Hoffman-La Roche, GlaxoSmithKline) ihre Arzneimittel auch in Deutschland anbieten und an möglichst hohen Gewinnen interessiert sind. Warum sollten also diesselben Akteure plötzlich in Deutschland politisch zurückhaltender sein als in den USA?
Mangels vergleichbarer Untersuchungen in Deutschland sollen daher einige Fakten dieser "Pharma-Attacken" auf die parlamentarischen Entscheidungsgremien dargelegt werden:
• Im Vorjahr der Entscheidung, 2003, gaben die Pharmaindustrie und die HMO-Krankenversicherer 141 Millionen US-Dollar für Lobbyistentätigkeit im Bereich der Arzneimittelpolitik aus. Den Großteil, nämlich 108 Millionen US-Dollar zahlte die Pharmaindustrie.
• Dieselben Akteure beschäftigten allein für diesen Bereich 952 Lobbyisten im Bereich der Gesetzgebungsinstitutionen und des Weißen Hauses.
• Mit 824 individuellen Lobbyisten, einem Allzeit-Hoch, setzten die Arzneimittelhersteller allein auf jedes Senatsmitglied 8 Vertreter an.
• Von den 222 Lobbyisten, die von HMOs und Health Plans auf die Parlamentarier angesetzt waren, vertraten 42 % auch die Pharmaindustrie.
• 431 der Pharma-Lobbyisten, was einem Anteil von 45 % dieser Gruppe entspricht, waren vorher innerhalb von Regierungsbehörden angestellt. Im Report werden die prominentesten dieser Sorte von Lobbyisten auch namentlich vorgestellt. Umgekehrt werden aber auch die ehemaligen Pharma-Manager genannt, die aktuell in der Bush Administration beschäftigt waren
Die 39-seitige PDF-Datei des Reports "The Medicare Drug War" können Sie hier einsehen und herunterladen.
Bernard Braun, 21.12.2006
Desinformation über Arzneimittel: eher Regel als Ausnahme
 Wer mal nicht nur von "bösen Pharmakritikern" oder "linken Gazetten" über die "haarsträubenden Zustände im intransparenten medizinisch-industriellen Komplex" (Berliner Ärzte 12/2006: 16) informiert werden will, der kann jetzt auf die Dezember-2006-Ausgabe der "Berliner Ärzte elektronisch", der Zeitschrift der Berliner Ärztekammer, zugreifen. In mehreren Beiträgen werden darin Ergebnisse einer ebenfalls außergewöhnlichen Veranstaltung der Berliner Ärztekammer vorgestellt, nämlich des Symposiums "Arzneimittel(des)information", das anlässlich des 40-jährigen Bestehens des in Berlin erscheinenden unabhängigen Bulletins "Der Arzneimittelbrief" stattfand.
Wer mal nicht nur von "bösen Pharmakritikern" oder "linken Gazetten" über die "haarsträubenden Zustände im intransparenten medizinisch-industriellen Komplex" (Berliner Ärzte 12/2006: 16) informiert werden will, der kann jetzt auf die Dezember-2006-Ausgabe der "Berliner Ärzte elektronisch", der Zeitschrift der Berliner Ärztekammer, zugreifen. In mehreren Beiträgen werden darin Ergebnisse einer ebenfalls außergewöhnlichen Veranstaltung der Berliner Ärztekammer vorgestellt, nämlich des Symposiums "Arzneimittel(des)information", das anlässlich des 40-jährigen Bestehens des in Berlin erscheinenden unabhängigen Bulletins "Der Arzneimittelbrief" stattfand.
Die Spannbreite und Brisanz sowie der Informationswert lassen sich aus den Titeln der Beiträge entnehmen, die von Ärzten oder auch so einer renommierten Gesundheitsjournalistin wie Rosemarie Stein verfasst wurden. Sie lauten:
• Dr. med. Günther Jonitz: Vollmundigen Versprechungen nicht trauen
• Rosemarie Stein: Arzneimitteldesinformation eher Regel als Ausnahme
• Rosemarie Stein: Der Werbung zum Trotz: Vernünftig verordnen
Zum Ziel einer am Nutzen für die Patienten orientierten Verordnungsweise tragen zwei weitere Beiträge sehr speziell bei:
• Eine kleine Auswahl der pharma-unabhängigen Arzneimittel-Informationsquellen
• Kochen, Michael M und Niebling, Wilhelm: Informationen zur rationalen Arzneimitteltherapie in der hausärztlichen Praxis am Beispiel der Protonenpumpenhemmer. Dieser Aufsatz wurde im August diesen Jahres nicht in der für teuer Geld der "Deutschen Gesellschaft für Allgemeinmedizin und Familiennedizin (DEGAM)" erkauften, werbefreien "Zeitschrift für Allgemeinmedizin (ZFA)" abgedruckt. Dabei spielte der Druck eines Herstellers und Inserenten in anderen Zeitschriften des Verlags der ZFA, des Thiemeverlags, offensichtlich die entscheidende Rolle. Trotz einer zwischenzeitlichen Einigung zwischen DEGAM und dem Thiemeverlag, können die LeserInnen der "Berliner Ärzte" jetzt den Beitrag lesen und erahnen, mit welch harten Bandagen hier Märkte vor sachkundiger kritischer Information geschützt werden.
Hier erreichen Sie das Inhaltsverzeichnis der Zeitschrift "BERLINER ÄRZTE elektronisch" und die dortigen Links zu den PDF-Dateien der einzelnen Artikel.
Bernard Braun, 13.12.2006
Pharma-Industrie will Patienten mit Direktwerbung stärker beeinflussen
 Kaum zwei Jahre ist es her, dass die Pharmaindustrie mit ihrem Versuch gescheitert ist, Laienwerbung für rezeptpflichtige Arzneimittel (sog. DTCA, direct-to-consumer advertising) in Europa durchzusetzen. Jetzt gibt es massive neue Vorstöße der Industrie, auf verschiedenen Ebenen direkten Einfluss auf die Patienenmeinung zu gewinnen. Eine wichtige Zielgruppe des Vorstoßes sind Patienten- und Selbsthilfegruppen. Sie sollten schon bei dem ersten gescheiterten Versuch für die Einführung von DTCA
Kaum zwei Jahre ist es her, dass die Pharmaindustrie mit ihrem Versuch gescheitert ist, Laienwerbung für rezeptpflichtige Arzneimittel (sog. DTCA, direct-to-consumer advertising) in Europa durchzusetzen. Jetzt gibt es massive neue Vorstöße der Industrie, auf verschiedenen Ebenen direkten Einfluss auf die Patienenmeinung zu gewinnen. Eine wichtige Zielgruppe des Vorstoßes sind Patienten- und Selbsthilfegruppen. Sie sollten schon bei dem ersten gescheiterten Versuch für die Einführung von DTCA
als Hilfslobby dienen, um den Wünschen der Firmen bei der Politik Gehör zu verschaffen. So beschrieb ein durchgesickertes Strategiedokument des britischen Pharmaindustrieverbands ABPI die Rolle, die die Firmen den Patienten zugedacht hatten.
Im Frühjahr machten fünf konservative und liberale Europa-Abgeordnete einen neuen Vorstoß für Direktwerbung für rezeptpflichtige Arzneimittel. Dabei blieb es nicht. Mit dem durch die EU-Kommission
neu gegründeten Arzneimittelforum (Pharmaceutical Forum) findet sich ein weiterer Fürsprecher von DTCA. Das Gremium bietet vor allem der Industrie einen direkten Draht zur EU-Kommission. Ende September forderte das Forum "bessere Information" für Patienten. Unter dem Vorwand, Qualitätsverbesserungen in der Information zu erzielen, soll ein "Public Private Partnership" Modellinformationen zunächst für Diabetes erstellen. Mit am Tisch sitzt die Pharmaindustrie.
Ausführliche Informationen über die neuesten Versuche der Pharmaindustrie, ihre Produkte und insbesondere auch rezeptpflichtige Arzneimittel durch direkte Werbung besser zu vermarkten, berichtet der BUKO-Pharmabrief: Mit Macht zu mehr Marketing. Bei dem Aufsatz handelt es sich um die überarbeitete Fassung eines Artikels von Jörg Schaaber, zuerst erschienen in der Zeitschrift "Dr. med. Mabuse", Nr. 164, 2006, der auch beim Mabuse-Verlage zum Download verfügbar ist: Mit Macht zu mehr Marketing - Industrie will PatientInnen stärker beeinflussen.
Die BUKO Pharma-Kampagne setzt sich kritisch mit den Schattenseiten des Arzneimittelmarktes in Süd und Nord auseinander. Über die Initiative berichtet auch ein Aufsatz von Heike Korzilius im Deutschen Ärzteblatt 103, Ausgabe 40 vom 06.10.2006, Seite A-2602: 25 Jahre Buko-pharma-kampagne: Der Pharmaindustrie auf die Finger geschaut
Gerd Marstedt, 10.12.2006
Das Geschäft mit der Krankheit
 Das Gesundheitswesen in Deutschland ist ein zukunftsträchtiger und ökonomisch überaus relevanter Markt. Weltweit gilt der "Gesundheitsmarkt" als 3,5 Billionen Dollar schwer, allein in Deutschland betragen die Ausgaben der GKV jährlich über 140 Milliarden Euro und die Umsätze für Arzneimittel betrugen 2005 knapp 35 Millionen Euro. Nach einer neuen Länderanalyse der Unternehmensberatung Frost & Sullivan soll sich der Gesamtumsatz im europäischen Gesundheitswesen, zu dem Arzneimittel, Medizintechnik und medizinische Leistungen beitragen, bis 2008 um jährlich 6,4% erhöhen.
Das Gesundheitswesen in Deutschland ist ein zukunftsträchtiger und ökonomisch überaus relevanter Markt. Weltweit gilt der "Gesundheitsmarkt" als 3,5 Billionen Dollar schwer, allein in Deutschland betragen die Ausgaben der GKV jährlich über 140 Milliarden Euro und die Umsätze für Arzneimittel betrugen 2005 knapp 35 Millionen Euro. Nach einer neuen Länderanalyse der Unternehmensberatung Frost & Sullivan soll sich der Gesamtumsatz im europäischen Gesundheitswesen, zu dem Arzneimittel, Medizintechnik und medizinische Leistungen beitragen, bis 2008 um jährlich 6,4% erhöhen.
Vor diesem Hintergrund nimmt es nicht Wunder, dass Pharma-Unternehmen und Hersteller von Medizintechnik ihre Marktanteile auch mit Strategien zu erhöhen trachten, die bei Licht betrachtet dem Leitbild eines mündigen und informierten Patienten erheblich widersprechen. Die Zeitschrift "Public Library of Science" hat jetzt ein Schwerpunktheft herausgegeben, das sich in mehreren Beiträgen (auf Englisch) dem "Geschäft mit der Krankheit" widmet. Es werden vielfältige Hintergrund-Informationen präsentiert zu Marketingstrategien der Pharmaindustrie, zur Rolle der Medien sowie zur Frage, ob Regierungen eine regulierende Funktion ausüben können.
Einige Aufsätze aus dem Sonderheft:
• "Bigger and Better: How Pfizer Redefined Erectile Dysfunction" - Über die Strategien des Pfizer-Konzerns zur Vermarktung und Umsatzssteigerung von Viagra
• "Medicine Goes to School: Teachers as Sickness Brokers for ADHD" - Wie versucht wird, schon Lehrer in Schulen in eine Strategie der Medikalisierung beim "Attention deficit hyperactivity disorder (ADHD)", dem sog. Aufmerksamkeitsdefizitsyndrom einzubinden
• "Female Sexual Dysfunction: A Case Study of Disease Mongering and Activist Resistance" - Wie weibliche Sexualprobleme medikalisiert werden und sofortige Hilfe versprochen wird
• "The Latest Mania: Selling Bipolar Disorder" - Wie Psychopharmaka als alltägliche Stimmungsaufheller verkauft werden
PDF-Datei (4.4 MB, 47 Seiten) The Fight against Disease Mongering (Das Geschäft mit der Krankheit)
Gerd Marstedt, 28.11.2006
Pharmaindustrie unterwandert Selbsthilfegruppen
 Nach einem älteren Bericht des Nachrichtenmagazins Panorama gibt es vielfältige Hinweise, dass Pharma-Unternehmen versuchen, durch Sponsoring von Selbsthilfegruppen oder sogar durch Initiativen und finanzielle Zuschüsse zur Gründung neuer Selbsthilfegruppen, den Absatz für ihre Produkte zu steigern. Panorama: "Selbsthilfegruppen sind für Kranke oft ein wichtiger Halt - sie beraten und unterstützen Patienten, sie gelten als kritisch und sind ausschließlich am Wohl des Kranken interessiert. Wer sich an eine solche Gruppe wendet, erwartet unabhängige Unterstützung. Doch immer öfter entdecken Pharmaunternehmen Selbsthilfegruppen als Marketing-Instrument. Sie sind ideal, um für ein bestimmtes Medikament oder eine Therapie zu werben. Besonders interessant sind chronisch Kranke, die dauerhaft mit teuren Medikamenten behandelt werden. Pharmafirmen gründen sogar eigene Selbsthilfegruppen, wenn sie ein neues Medikament auf den Markt bringen. Die Selbsthilfegruppen nehmen Spenden von der Pharmaindustrie - und gleichzeitig tauchen Werbebotschaften in ihren Verbandszeitschriften und im Internet auf. Sie beteuern, dass sie trotz der Spenden unabhängig bleiben, was Pharmakritiker wie Professor Peter Schönhöfer stark bezweifeln. Und so merken viele Patienten noch nicht einmal, dass sie von der Pharmaindustrie manipuliert werden."
Nach einem älteren Bericht des Nachrichtenmagazins Panorama gibt es vielfältige Hinweise, dass Pharma-Unternehmen versuchen, durch Sponsoring von Selbsthilfegruppen oder sogar durch Initiativen und finanzielle Zuschüsse zur Gründung neuer Selbsthilfegruppen, den Absatz für ihre Produkte zu steigern. Panorama: "Selbsthilfegruppen sind für Kranke oft ein wichtiger Halt - sie beraten und unterstützen Patienten, sie gelten als kritisch und sind ausschließlich am Wohl des Kranken interessiert. Wer sich an eine solche Gruppe wendet, erwartet unabhängige Unterstützung. Doch immer öfter entdecken Pharmaunternehmen Selbsthilfegruppen als Marketing-Instrument. Sie sind ideal, um für ein bestimmtes Medikament oder eine Therapie zu werben. Besonders interessant sind chronisch Kranke, die dauerhaft mit teuren Medikamenten behandelt werden. Pharmafirmen gründen sogar eigene Selbsthilfegruppen, wenn sie ein neues Medikament auf den Markt bringen. Die Selbsthilfegruppen nehmen Spenden von der Pharmaindustrie - und gleichzeitig tauchen Werbebotschaften in ihren Verbandszeitschriften und im Internet auf. Sie beteuern, dass sie trotz der Spenden unabhängig bleiben, was Pharmakritiker wie Professor Peter Schönhöfer stark bezweifeln. Und so merken viele Patienten noch nicht einmal, dass sie von der Pharmaindustrie manipuliert werden."
Im Bericht kommt auch ein Pharmamarketing-Experte zu Worte, der aussagt, es sei durchaus üblich, dass die Pharmaindustrie gerade bei neuen Indikationen und Therapieansätzen Selbsthilfegruppen initiiert. Weitere Hinweise für die These von Panorama: Sogar die Premium-Adresse - www.selbsthilfe.de - ist von der Industrie gekauft, hinter dem guten Namen verbirgt sich der Bundesverband der Pharmazeutischen Industrie. Und sogar Heinz Windisch, Patientenvertreter und Präsident des Verbands der Krankenversicherten Deutschlands (VKVD), ist (nebenher) tätig im Auftrag des Pharmakonzerns Abbott. Der dem Panorama-Bericht zugrunde liegende Text ist als PDF-Datei abrufbar: "Tricksen und tarnen - Pharmaindustrie unterwandert Selbsthilfegruppen"
Panorama hat nichts grundlegend Neues aufgedeckt. Schon im März 2005 berichtete Erika Feyerabend in einem Artikel für die Zeitschrift "Mabuse" unter dem Titel "Problematische Partnerschaften - Selbsthilfegruppen und die Pharmaindustrie" über diese Praktiken der Pharma-Industrie. "Jedes zehnte Pharma-Unternehmen pflegt Kontakte zu Selbsthilfegruppen. Der Bundesverband der Pharmazeutischen Industrie (BPI) träumt von 'direktem Patientenmarketing mit geringsten Streuverlusten', das heißt von gezielter Werbung für verschreibungspflichtige Medikamente bei den betroffenen Gruppen. Elegant kann das geltende Werbeverbot für verschreibungspflichtige Medikamente umgangen werden, indem Firmen Wirkstoffe oder gleich die eigenen Firmenprodukte in Vereinszeitungen oder Kongress-Präsentationen anpreisen." Ein Reprint des Aufsatzes als PDF-Datei kann hier heruntergeladen werden: Problematische Partnerschaften - Selbsthilfegruppen und die Pharmaindustrie.
Auch die Journalistin Martina Keller beschäftigt sich in einem Artikel in der ZEIT (19.05.2005, Nr.21) unter dem Titel "Pharmaindustrie - Geben und einnehmen" mit der zumindest fragwürdigen Allianz von Pharma-Unternehmen und Selbsthilfegruppen. Als ein Beispiel berichtet sie über das so genannte Zappelphilipp-Syndrom, medizinisch die Aufmerksamkeits-Defizit-Störung (ADS). "Betroffenen Kindern helfen Medikamente wie Ritalin mit dem Wirkstoff Methylphenidat, der in den Gehirnstoffwechsel eingreift. Allerdings können die Mittel auch Übelkeit, Schlafstörungen und Stimmungsschwankungen verursachen. Die Spätfolgen sind noch unerforscht. Obwohl Methylphenidat, um Missbrauch zu verhindern, auf der Liste der Betäubungsmittel steht, wird es Kindern seit Jahren immer häufiger verordnet, nicht selten in Fällen, in denen die Diagnose ADS einer sorgfältigen Untersuchung nicht standhält." Das Pharma-Unternehmen Lilly unterstützt nun alle größeren ADS-Gruppen mit Spenden und zur Gründung des Hamburger Arbeitskreises ADS/ADHS gab der Konzern 40.000 Euro. Die PR-Agentur Gianni & Meissner aus Frankfurt half überdies, die Ziele der Initiative zu entwickeln, organisierte die Eröffnungsveranstaltung in einem Hamburger Hotel und formulierte einen Leitfaden für Eltern und Lehrer. Der Artikel ist hier abrufbar: Pharmaindustrie - Geben und einnehmen.
Gerd Marstedt, 30.10.2006
Einflussnahme der Pharma-Industrie auf Medikamentenverschreibungen
 In einem Mitglieder-Rundbrief "Arzneimittel aktuell - Verordnungs-Management" hat jetzt die Kassenärztliche Vereinigung Bayerns (KVB) auf Strategien der Pharma-Industrie aufmerksam gemacht, mit denen diese versucht, das Verschreibungsverhalten der Ärzte zu ihren Gunsten zu beeinflussen. Auf drei Vorgehensweisen wird hingewiesen:
In einem Mitglieder-Rundbrief "Arzneimittel aktuell - Verordnungs-Management" hat jetzt die Kassenärztliche Vereinigung Bayerns (KVB) auf Strategien der Pharma-Industrie aufmerksam gemacht, mit denen diese versucht, das Verschreibungsverhalten der Ärzte zu ihren Gunsten zu beeinflussen. Auf drei Vorgehensweisen wird hingewiesen:
1.) Einflussnahme über die Praxissoftware: Im Schreiben der KVB heißt es: "Solche Praxissoftware birgt klar die Gefahr einer Manipulation des ärztlichen Verschreibungsverhaltens und ist darüber hinaus ein Kostentreiber im Gesundheitswesen. Wie könnte so eine Manipulation aussehen? Beim Aufrufen der Option 'Preisvergleichsliste' werden die Präparate des Hauptsponsors als die preiswertesten offeriert. Erst durch Scrollen des Balkens gelangt man zu den tatsächlich preiswertesten Präparaten. Oder aber: In der vorab gefüllten 'Hausapotheke' sind die Produkte des Hauptsponsors bevorzugt enthalten. Auch nutzen einige Programme die Option, ausgewählte Arzneimittel nahezu automatisch durch ein Produkt des Hauptsponsors zu ersetzen."
2.) Einflussnahme über Anwendungsbeobachtungen: Dazu die KVB: "Anwendungsbeobachtungen sind oft reine Marketinginstrumente, um zumeist unnötige Analogpräparate mit fehlender oder nur marginaler therapeutischer Verbesserung in den Markt zu drücken. Bei den über 600 derzeit bei der KBV gemeldeten Anwendungsbeobachtungen handelt es sich zu einem großen Teil um Präparate, die seit 20 Jahren und länger auf dem Markt sind. (...) Bei vielen Patienten, die im Rahmen einer Anwendungsbeobachtung teure Analogpräparate erhalten, folgt eine von den Pharma-Firmen beabsichtigte Dauermedikation, die Ihr Budget belastet!"
3.) Einflussnahme über Ärztemuster: "Ärztemuster nach § 47 AMG sind keine Produkte zur Umsatzförderung eines Unternehmens, so-lange Sie zu Erprobungszwecken in der kleinsten Packungsgröße und nicht über den zulässigen Umfang hinaus abgegeben werden. Die Realität sieht leider anders aus: Es ist anzunehmen, dass Ärztemuster von pharmazeutischen Unternehmen zu Werbezwecken missbraucht werden."
In einem weiteren Informationspapier "Gesponserte Praxis-Software" macht die KVB in mehreren Beispielen darauf aufmerksam, welchen Einfluss die (von der Pharma-Industrie oftmals gesponserte) Praxissoftware hat. So gibt es etwa den Fall: "Beim Aufrufen der Option 'Preisvergleichsliste' werden die Präparate des Sponsors als die preiswertesten offeriert. Und erst durch Scrollen des Balkens gelangt man zu den tatsächlich reiswertesten Präparaten."
Das Schreiben der KVB ist hier als PDF-Datei abrufbar: KVB Arzneimittel aktuell - Verordnungs-Management
Gerd Marstedt, 6.2.2006
Pharma-Werbung beeinflusst ärztliche Medikamenten-Verschreibung
 Mehr als drei Milliarden US-Dollar gibt die Pharmaindustrie in den USA jährlich für die direkte Verbraucherwerbung für verschreibungspflichtige Medikamente aus. Doch diese Investition in unter anderem teure TV-Werbespots lohnt sich durchaus. Welchen Einfluss die Werbung auf das Verordnungsverhalten der Ärzte hat, hat jetzt eine Studie in den USA auf überaus beeindruckende Weise gezeigt. Die Studie wurde 2003 und 2004 in den Staaten Kalifornien und New York durchgeführt.
Mehr als drei Milliarden US-Dollar gibt die Pharmaindustrie in den USA jährlich für die direkte Verbraucherwerbung für verschreibungspflichtige Medikamente aus. Doch diese Investition in unter anderem teure TV-Werbespots lohnt sich durchaus. Welchen Einfluss die Werbung auf das Verordnungsverhalten der Ärzte hat, hat jetzt eine Studie in den USA auf überaus beeindruckende Weise gezeigt. Die Studie wurde 2003 und 2004 in den Staaten Kalifornien und New York durchgeführt.
Testpersonen wurden mehreren Gruppen zugeteilt, die bei Arztbesuchen unterschiedliche Rollen spielten sollten. Entweder sollten sie Patienten mit einer depressiven Erkrankung oder einer sozialen Verhaltensauffälligkeit spielen. Dabei hatten sie die Anweisung, bei den Arztbesuchen jeweils
• einmal um ein ganz bestimmtes Medikament zu bitten,
• einmal die Verschreibung irgend eines Medikamtents zu erbitten
• und einmal keine Wünsche zu äußern.
Auf diese Weise wurden insgesamt etwa 300 unangemeldete Arztbesuche durchgeführt. Das Ergebnis war frappierend, die Ärzte richteten sich in sehr starkem Maße nach den Wünschen der Patienten im Hinblick auf die Medikamentenverschreibung. Bei Patienten mit einer Depression verschrieben sie in 53%, 76% bzw. 31% der Fälle Antidepressiva (Wunsch nach bestimmtem Antidepressivum, Wunsch nach irgend einem Medikament, keine Wünsche). Bei den Patienten mit einer Verhaltensauffälligkeit betrugen die Verschreibungsquoten 55%, 39% und 10%.
Direkte, für Konsumenten bestimmte Werbung für Medikamente, so lautet das Fazit der Wissenschaftler, hat somit erheblichen Einfluss auf die Qualität der medizinischen Behandlung und auf medikamentöse Über- und Unterversorgung. Ärzte befolgen die aus aus der Werbung übernommenen Patientenwünsache sehr sorgsam. Pharmawerbung bei Ärzten wie Patient ist durchaus gewinnbringend.
Ein Abstract der Studie gibt es in der Zeitschrift JAMA: Influence of Patients’ Requests for Direct-to-Consumer Advertised Antidepressants
Gerd Marstedt, 11.12.2005
Wie innovativ und "gesund" ist die Pharmaindustrie? Bluff und Wirklichkeit
 Wer sich mit Arzneimitteln und der Politik der Pharmaunternehmen beschäftigt, bekommt es mit einigen der größten Phänomene des Gesundheitswesens zu tun:
Wer sich mit Arzneimitteln und der Politik der Pharmaunternehmen beschäftigt, bekommt es mit einigen der größten Phänomene des Gesundheitswesens zu tun:
• Die Verordnung von Arzneimitteln beendet im deutschen wie in vielen anderen vergleichbaren Gesundheitssystemen die erdrückende Mehrheit aller ambulanten Arztkontakte.
• Die Ausgaben für verordnete Arzneimittel sind z.B. in Deutschland höher als die Ausgaben für die gesamte ambulante ärztliche Tätigkeit.
• Die Wirksamkeit wie das Preis-Nutzen-Verhältnis vieler neuer und die Qualität zahlreicher seit langem zugelassener Arzneimittel oder deren Verordnungsqualität sind umstritten oder nachweislich schlecht.
• Um dennoch eine hochwertige, wirksame und weitgehend wirtschaftliche Versorgung mit Arzneimitteln zu erreichen bedarf es einer intensiven Debatte auf der Basis wissenschaftlich gesicherten Wissens unabhängiger Akteure.
Um die zuletzt genannte unabhängige Transparenz über eine Reihe wichtiger Strukturen, Annahmen und Bedingungen des Arzneimittelmarktes bemüht sich ausführlich ein seit einigen Monaten in deutscher Übersetzung aus dem amerikanischen Englisch vorliegendes Buch. Die Verfasserin, Marcia Angell, ist Ärztin und arbeitete 21 Jahre und zuletzt als Chefredakteurin beim renommierten "New England Journal of Medicine". Sie präsentiert materialreich und bisher unwiderlegt unter dem provokanten Titel "Der Pharma-Bluff - Wie innovativ die Pharmaindustrie wirklich ist" eine Reihe kritischer und erschreckender Sachverhalte:
• In den USA ist der Gewinn der 10 größten Pharmaunternehmen nicht zuletzt wegen der industriefreundlichen Patentgesetzgebung höher als der der übrigen 490 größten börsennotierten US-Unternehmen.
• Im Jahr 2002 ließ die "Food and Drug Administration" (FDA), also die Behörde, die Arzneimittel in den USA zulässt, 78 neue Mittel zu, von denen 17 einen neuen Inhaltsstoff aufwiesen. Davon wiesen aber lediglich 7 einen Vorteil gegenüber bereits etablierten Medikamenten auf.
• Trotz gegenteiliger Behauptungen der Pharmaunternehmen wird in den USA die teure Forschung größtenteils von öffentlichen und damit steuerfinanzierten Einrichtungen vorangetrieben. Statt der angeblich Anfang dieses Jahrzehnts für jedes neue Arzneimittel ausgegebenen 802 Millionen US-Dollar geht Angell von einem durchschnittlichen Betrag von 100 Millionen US-Dollar aus.
• Zwischen 1998 und 2002 brachten die US-Pharmafirmen pro Jahr durchschnittlich 12 wirklich innovative Arzneimittel auf den Markt. Das waren lediglich 14 Prozent aller Neuzulassungen. Entsprechend handelt es sich bei 77 Prozent der derzeit jährlich zugelassenen Arzneimittel um Nachahmer- oder auch "Me-too"-Präparate.
• Neu zugelassene Arzneimittel müssen keineswegs wesentlich besser sein als alt bewährte, aber nicht mehr patentgeschützte und damit unprofitablere Mittel.
• Bis zu 35 Prozent der Gesamteinnahmen der Pharmaindustrie werden in den USA für die Verwaltung und das Marketing ausgegeben, und damit deutlich mehr als für die offiziell genannte Summe für Forschung.
• In den USA werden 60 Prozent der obligatorischen zertifizierten Fortbildung von der Pharmaindustrie finanziert. Auch 50 Prozent der Aufwendungen und Arbeitsplätze der FDA werden über die Gebühren der antragstellenden Unternehmen finanziert.
• Trotz der erschreckenden Belege für den problematischen Zustand und Einfluss der Pharmaindustrie macht Angell Vorschläge, wie sich diese Gesundheitsbranche retten kann. Dazu zählen Anreize für innovatives Handeln, die Unabhängigkeit der FDA von Industriegebühren, die Überwachung klinischer Studien durch ein unabhängiges Institut, kürzere Patentlaufzeiten, der komplette Rückzug der Pharmaindustrie aus der ärztlichen Fortbildung, das Verbot von an Patienten gerichtete Anzeigen, mehr Transparenz und eine wirksame Regulierung der Arzneimittelpreise.
Eine kostenlose sechsseitige Zusammenfassung der 13 Kapitel des Buches kann von der Website der AOK-Verlagsgesellschaft Kompart heruntergeladen werden. Wer alle 288 Seiten lesen will, kann dies für 24,80 Euro tun (ISBN 3-9806621-9-5).
Bernard Braun, 28.11.2005
Internationale Studienlage eindeutig: Irreführung durch Pharmaindustrie eher Regel als Ausnahme
 Kompetente, wissenschaftliche abgesicherte, unabhängige und nur den gesundheitlichen Interessen von Patienten verpflichtete Informationen gehören zu den wichtigsten Voraussetzungen für eine wirksame und wirtschaftliche Gesundheitsversorgung. Dies trifft besonders für die Verordnung und Einnahme von Medikamenten zu. Hier handelt es sich um die häufigste medizinisch-ärztliche Intervention in entwickelten Gesellschaften.
Kompetente, wissenschaftliche abgesicherte, unabhängige und nur den gesundheitlichen Interessen von Patienten verpflichtete Informationen gehören zu den wichtigsten Voraussetzungen für eine wirksame und wirtschaftliche Gesundheitsversorgung. Dies trifft besonders für die Verordnung und Einnahme von Medikamenten zu. Hier handelt es sich um die häufigste medizinisch-ärztliche Intervention in entwickelten Gesellschaften.
Allein die Gesetzliche Krankenversicherung (GKV) gibt seit vielen Jahren jährlich um die 15 Prozent ihrer Leistungsausgaben (2004 waren dies absolut 21,8 MRD Euro) für verordnete Arzneimittel aus. Weitere Milliarden zahlen die BürgerInnen für frei erhältliche Arzneimittel in Apotheken.
Welche Möglichkeiten es gibt, bestimmte Krankheiten überhaupt mit Arzneimitteln zu behandeln und für welche Mittel oder welche Wirkstoffe von welchen Pharmaherstellern diese enormen Geldsummen am besten ausgegeben werden oder nicht, ist eine gesundheitlich und ökonomisch zentrale Angelegenheit.
Trotzdem sprechen kritische Betrachter des Arzneimittelmarktes seit langem davon, dass "unabhängige und ausgewogene Information ... Mangelware (ist)" (so in der Nr. 8/2005 des ausgezeichneten und frei oder für eine freiwillige Spende erhältlichen "Pharma-Briefs" der BUKO Pharma-Kampagne in Bielefeld). Mit Informationsdiensten wie dem auf dieser Website bereits ausführlicher vorgestellten Blatt "Gute Pillen - Schlechte Pillen" gibt es erste Versuche, den Mangel zu beheben. Da aber gleichzeitig die Fülle, der Einfallsreichtum und die Lesefreundlichkeit firmengesteuerter Informationen für Ärzte und Patienten unvermindert zunimmt, stellt sich die Frage, wie man damit umgeht. Auch wenn ein prinzipielles "gesundes Misstrauen" sicher nicht fehl am Platze ist, reicht dies allein nicht aus, um die Notwendigkeit einer kritischen Distanz zu solchen Informationen unanzweifelbar und nachvollziehbar zu belegen und in der Öffentlichkeit zu verankern. Entscheidend sind systematische empirische Belege dafür, "dass die Irreführung durch die Pharmaindustreie eher die Regel denn die Ausnahme ist" ("Pharma-Brief Nr. 8/2005, S. 1).
Die Belege hierfür finden sich in zwei ausgezeichneten Literaturdatenbanken:
Die vom "Department of Essential Drugs & Medicines Policy" der Weltgesundheitsorganisation (WHO) und der "Health Action International Europe" zwischen 1999 und 2003 aufgebaute und koordinierte "Drug promotion database - what's known and what is missing?" trägt über 2.500 internationale wissenschaftliche Studien über die Informations- und Promotion-Aktivitäten der Arzneimittelhersteller zusammen. In der Datenbank kann einerseits mit Schlagworten nach Studien gesucht werden, deren Ergebnisse dann in ausführlichen Abstracts eingesehen werden können. Daneben gibt es aber auch eine Reihe umfangreicher, thematischer Reviews, welche die jeweilige wissenschaftliche Erkenntnislage integriert darstellen. Wer also z.B. zu den Fragen "What attitudes do people (professional and lay) have to promotion?", What impact does pharmaceutical promotion have on attitudes and knowledge? oder "What impoact does pharmaceutical promotion have on behaviour" Näheres wissen will, wird hier fündig.
Die Hauptergebnisse dieser Reviews werden von den WHO-Experten in aller Klarheit so zusammengefasst:
• "Drug promotion strongly influences prescribing behaviour, but doctors underestimate this influence. Company funding of doctors, of educational events, and of research are important elements in this influence.
• Of various interventions to control or counter the influences of promotion, the only ones that have been found effective are government regulation, training of students (both before and after graduation), media exposure of abusive promotion, and free and abundant provision of reliable non-commercial therapeutic information to professionals and the public."
Die von der seit 1983 (mit Vorläuferorganisation) bestehenden Non-Profit-Organisation "Healthy Skepticism Inc" getragene Literaturdatenbank Healthy Skepticicsm bietet aktuell eine Bibliothek mit 3.034 wissenschaftlichen Studien über Arzneimittel-Promotion an. Den Zugang erhält man entweder als zahlender Nutzer (zwischen 13 und 300 Euro pro Jahr) oder auch als Freiabonnent (z.B. als Student oder in Gestalt eines 3-monatigen Frei-Abos). Zu den Hauptzielen der Organisation und ihrer Information über Informationspraktiken der Arzneimittelhersteller gehören:
• "Improving health by reducing harm from inappropriate, misleading or unethical marketing of health products or services, especially misleading pharmaceutical promotion.
• Investigating and communicating about marketing practices.
• Developing, supporting and evaluating initiatives to reduce harmful marketing practices, including reform of regulations and incentives.
- Developing, implementing and evaluating educational strategies to improve health care decision making, including evaluation of drug promotion."
Schließlich finden sich hier noch zahlreiche Links auf weitere Informationsquellen zur Informationspolitik von Herstellern (z.B. Health Action International oder zur Evidence based Medicine.
Bernard Braun, 24.11.2005